Сборник заданий. Сборник заданий Республиканской олимпиады по общеобразовательным. Сборник заданий Республиканской олимпиады по общеобразовательным предметам
 Скачать 2.33 Mb. Скачать 2.33 Mb.
|
|
Задача 7. Смешали 250 мл 21.82 %-ного раствора гидроксида натрия (ρ = 1,10 г/мл) и 200 мл 40.2 %-ного раствора хлорной кислоты (ρ = 1,11 г/мл). К полученному раствору добавили 250 г воды. 1.Вычислите количество вещества гидроксида натрия в исходном растворе. 2.Определите количество вещества хлорной кислоты в исходном растворе. 3.Рассчитайте массовую долю перхлората натрия в конечном растворе. Задача 8. А) В процессе электролиза на электродах происходят так называемые полуреакции. Обычно на катоде происходит полуреакция с участием катиона более пассивного металла, а на аноде происходит полуреакция с участием аниона, содержащего меньшее число атомов кислорода. В этой части мы рассмотрим обычный электролиз раствора сульфата меди. 250г 12,8%-ного раствора сульфата меди подвергали электролизу до тех пор, пока на катоде не начал выделяться газ. а.1) Рассчитайте количество выделившихся на электродах веществ. а.2) Найдите конечную массу раствора. а.3) Рассчитайте массовые доли веществ в растворе после электролиза. Б) В основном галогениды серебра являются нерастворимыми солями. Но есть один галогенид серебра, который все-таки растворим в воде. Это, конечно же, фторид серебра. Оказалось, что фторид серебра отличается от других галогенидов серебра не только своей растворимостью, но и поведением в растворе при пропускании через раствор электрического тока. В этой части задачи вам предлагается решить, что же все-таки происходит при электролизе раствора фторида серебра. Через 200г 6,35%-ного раствора фторида серебра проводили ток до тех пор, пока на аноде не выделилось 4,48л газа (н.у.). б.1) Какой газ выделяется на аноде? Рассчитайте его количество. б.2) Найдите массу раствора после электролиза. б.3) Рассчитайте массовые доли веществ в растворе после электролиза. Задача 9. Ниже представлена диаграмма Латимера для иода при pH=14: 1. Напишите уравнение полуреакции перехода 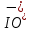 в в 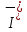 и рассчитайте ее стандартный потенциал. и рассчитайте ее стандартный потенциал. 2. Напишите уравнения двух реакций диспропорционирования, возможных при этих условиях. Дана диаграмма Латимера для иода при pH=0: 3. Рассчитайте потенциал перехода  в І2 в І2 4. Допишите и уравняйте реакцию 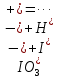 . Для этой реакции вычислите . Для этой реакции вычислите 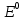 , ,  и константу равновесия. и константу равновесия. Задача 10. Принято считать, что соли, образованные элементами одной группы периодической системы, хорошо растворимы в воде, но в каждом правиле есть исключения. Одним из таких исключений является соль A (содержит 26.75% металла X по массе), которую можно получить тремя способами: ● Взаимодействием 2.81 г соли B с кислотой C ( реакция 1 ), при этом выделяется газ, при пропускании которого через избыток раствора гидроксида кальция выделяется 3.8 г белого осадка. ● Реакцией обмена между соединениями D (ω( X ) = 16,35%) и E ( реакция 2 ). В ходе данной реакции из 1.426 г E получается 1.000 г A. ● Реакцией нейтрализации между кислотой C и основанием F ( реакция 3 ) 1. Установите элемент X. Как называется группа элементов, к которой он относится? Ответ подтвердите расчетом. Для расчетов берите точные атомные массы элементов. 2. Расшифруйте соединения A-F, подтвердив ответ расчетами. Напишите уравнения реакций 1 - 3 . 3. Рассчитайте растворимость соли X в воде в г/л, если ее произведение растворимости равно 1.84· 10 -3 Слаборастворимая соль I, образованная элементом Z, расположенном в той же группе, что и X, может быть получена смешиванием при охлаждении растворов соли J и натриевой соли K ( реакция 4 ). Если 7.77 г I прокалить при 4500 C, то получится 5.08 г J и газ с плотностью по гелию, равной 8 ( реакция 5 ). 4.Установите формулы веществ I-K, если известно, что J дает белый осадок при реакции с нитратом серебра. Напишите уравнения реакций 4-5. Задача 11. Скорость большинства химических реакций зависит от температуры. Одно из самых старых и известных эмпирических правил, описывающих зависимость скорости реакции от температуры – Правило Вант-Гоффа:  Где у – температурный коэффициент реакции. 1. При повышении температуры на 20°С, время протекания некоторой реакции сократилось с 160 минут до 40 минут. Найдите температурный коэффициент. Однако, правило Вант-Гоффа эмпирическое и не имеет под собой никакого теоретического обоснования. В сравнении можно привести уравнение Аррениуса, которое тоже имеет полу-эмпирический характер, но в последствии было подтверждено теорией активных столкновений. Уравнение Аррениуса имеет форму: 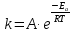 где А – предэкспоненциальный или частотный фактор, а Т – температура в Кельвинах. Примечание: T( K) =T (°C ) +273. 2. Скорость реакции разложения ацетальдегида была измерена в диапазоне от 427 до 727°С и представлена в виде линейной зависимости ln ln (k) от 1/T. Определите энергию активации и предэкспоненциальный фактор .
Однако, скорость некоторых реакций не зависит от температуры. Эти реакции называются фотохимическими. Их скорость пропорциональна количеству поглощенного света, которое можно описать законом Ламберта-Бера:  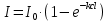 Где І0 – интенсивность (энергия в единицу времени) падающего света, І – интенсивность поглощенного света, k– коэффициент поглощения, l– толщина поглощающего слоя, с – молярная концентрация вещества. Раствор с концентрацией красителя с = 4 *10-6 М имеет коэффициент поглощения k= 1.5* 105 М-1 см-1 . Какая доля света поглотится раствором при оптической длине пути 5 см? Скорость фотохимической реакции пропорциональна интенсивности поглощенного света. Однако, не весь поглощенный свет приводит к протеканию реакции. Доля поглощенных фотонов, приводящих к химической реакции, от общего количества фотонов называется квантовым выходом и обозначается буквой ɸ. Таким образом, скорость фотохимической реакции равна: r =ɸ·I = ɸ·I0 (1-e-kcl ) Реакция разложения фоточувствительного красителя протекает в сосуде, имеющем параллелепипедную форму через который пропускается пучок света вдоль его наиболее длинной стороны. Определите длину параллелепипеда если скорость реакции равна 2.8 ·10-7 М с-1 , концентрация красителя равна c= 4 *10-6М , коэффициент поглощения равен 1.5·105М-1с-1 см-1 а из 10 поглощенных фотонов лишь 3 приводят к протеканию химической реакции. Интенсивность падающего света равна 1 мкДж с-1 . Задача 12. В ушедшем 2020 году необычайно большое внимание общества было уделено химии. В частности, в первой половине года наблюдался чудовищный недостаток жаропонижающих средств. Одним из таких средств является парацетамол (D). Примечательно, что название парацетамол является сокращением от чуть ли не номенклатурного названия молекулы: пара-N-ацетил-аминофенол. Мы не знаем какие планы у простейших (и особенно у тех, у кого нет даже нормальной клеточной мембраны), но на всякий случай научим вас синтезировать парацетамол. 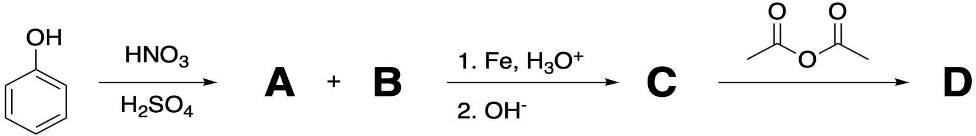 1. Расшифруйте схему синтеза парацетамола и нарисуйте структуры веществ A – D если известно, что: ● А и B – изомеры; ● В дальнейшие реакциях используется только изомер B; 2. Один из изомеров A и В может образовывать внутримолекулярные водородные связи. Какой? Покажите эту водородную связь. Работать с азотной кислотой, а уж тем более в купе с концентрированной серной, довольно опасно. Поэтому предлагаем посмотреть на альтернативный способ синтеза парацетамола: 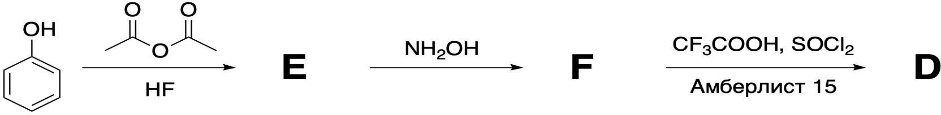 3. Расшифруйте схему и нарисуйте структуры E и F если известно, что: ● В 1H ЯМР спектре соединения E в ароматическом регионе наблюдается два пика с одинаковой интенсивностью ● Формула соединения E – C8H8O2 В любом случае, синтез парацетамола требует усилий и у вас может быть искушение пойти по короткому пути: купить анаферон. Но из чего он состоит? Посмотрим на этикетку: « д е й с т в у ю щ е е в е щ е с т в о п р е д с т а в л я е т с о б о й в о д н о - с п и р т о в о й р а с т в о р ( м а с с а р а с т в о р а 0.0 0 3 г .) а н т и т е л к г а м м а - и н т е р ф е р о н у ( а ф ф и н н о о ч и щ е н н ы х ) в концентрации не более 10 нанограммов на грамм раствора» 4. Если молекулярная масса иммуноглобулина класса G (тех самых антител) составляет около 150 кДа (1 Да – 1 г/моль) найдите количество молекул антител в одной таблетке анаферона. Примечание : не удивляйтесь если у вас получится значение меньше единицы. Вы можете интерпретировать эту цифру как вероятность того, что в одной таблетке будет хотя бы одна молекула антител. 5.Казахстанские мобильные номера имеют формат + 77YX XXX XX XX. Вместо Y может быть 0, 4 и 7. Вместо X может быть любая цифра от 0 до 9. Сравните вероятность найти 1 молекулу антитела в 1 таблетке анаферона с вероятностью случайным образом набрать мобильный номер и дозвониться Президенту Республики Казахстан. Задача 13. Для нейтрализации 10.5 г смеси муравьиной и уксусной кислот необходимо 50 мл 18.67 %-ного раствора гидроксида калия (плотность 1,20 г/мл). 1. Вычислите количество вещества гидроксида калия. 2. Напишите уравнения реакций. 3. Рассчитайте массу уксусной кислоты и её массовую долю в исходной смеси кислот. Задача 14. (Постоянную Фарадея, F, примите равной 96500 Кл/моль) А) В процессе электролиза на электродах происходят так называемые полуреакции. Обычно на катоде происходит полуреакция с участием катиона более пассивного металла, а на аноде происходит полуреакция с участием аниона, содержащего меньшее число атомов кислорода. В этой части мы рассмотрим обычный электролиз раствора сульфата меди. Через 250г 12,8%-ного раствора сульфата меди провели ток с общим зарядом 38600 Кл. а.1) Найдите количество электронов, задействованных в процессе. а.2) Рассчитайте количество выделившихся на электродах веществ. а.3) Рассчитайте массовые доли веществ в растворе после электролиза. Б) При электролизе раствора соли металла средней активности могут происходить дополнительные процессы в зависимости от концентрации соли. При этом решение задачи на такой электролиз будет не столь прямолинейным, как в случае с солями активных или пассивных металлов. В этой части задачи вам предлагается попробовать выяснить, что же в итоге происходит при электролизе раствора соли свинца. Примечание: свинец является металлом средней активности. Через 300 г 33,1%-ного раствора нитрата свинца проводили ток силой 4,825А в течение 3ч. 20 мин. Электролиз остановили, когда массовая доля нитрата свинца в растворе стала равной 24,15%. б.1) Найдите количество электронов, задействованных в процессе. б.2) Найдите массу раствора после электролиза. б.3) Какое вещество останется в растворе помимо воды и нитрата свинца? Найдите его массовую долю. Задача 15. Удобным графическим представлением электрохимических потенциалов являются диаграммы Латимера. Ниже представлена диаграмма Латимера для иода при pH=14 1. Напишите уравнение полуреакции перехода в и рассчитайте ее стандартный потенциал. 2. Напишите уравнения двух реакций диспропорционирования, возможных при этих условиях. Дана диаграмма Латимера для иода при pH=0: 3. Рассчитайте потенциал перехода  в І2 в І2 4. Допишите и уравняйте реакцию 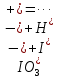 . Для этой реакции вычислите . Для этой реакции вычислите 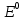 , ,  и константу равновесия. и константу равновесия. Если в растворе присутствует достаточное количество иодид-ионов, то молекулярный иод способен связываться с ними в комплекс  .Стандартный потенциал пары .Стандартный потенциал пары  / /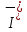 = 0.545 В. = 0.545 В. 5. Рассчитайте константу устойчивости данного комплекса Задача 16. Минерал A крайне мягок, обладает жирным металлическим блеском, а по внешнему виду настолько схож с графитом, что порой их трудно отличить друг от друга без специального оборудования. В промышленности A является одним из основных источников получения металла X. При сжигании 0.544 г A получается 0.4896 г вещества B (оксид X) и газ C ( реакция 1 ). Если полученный газ C пропустить через 25 мл 0.1186 М водного раствора перманганата калия ( р е а к ц и я 2) то на восстановление оставшегося перманганата в кислой среде понадобится 12.25 мл 0.1 М раствора сульфата железа (II) ( реакция 3 ). 1. Установите газ C и напишите уравнения р е а к ц и й 2 - 3 . Чему равно количество полученного в ходе сжигания C? 2. Установите формулы веществ X, A и B, а также напишите уравнение реакции 1 . Ответ подтвердите расчетом. В промышленности металл X получают восстановлением оксида B водородом. Если полученный металл обработать хлором, то получится вещество D, содержащее 64.9% хлора по массе. 3. Установите формулы вещества D и напишите уравнения реакций. На самом деле, структура D представляет собой димер, состоящий из двух октаэдров, соединенных двумя хлоридными мостиками. 4. Изобразите строение D. Некоторое время назад вещество A рассматривалось в качестве перспективного компонента литий-ионных аккумуляторов. Слоистая структура A позволяет атомам лития интеркалироваться в нее для дальнейшего участия в процессе зарядки и разрядки аккумулятора. Соединение интеркалированного в A лития можно описать с помощью общей формулы 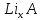 , где x находится в интервале от 0 до 1. 5. Установите формулу интеркалята лития, если его 1 моль содержит 4.527 1025 электронов. , где x находится в интервале от 0 до 1. 5. Установите формулу интеркалята лития, если его 1 моль содержит 4.527 1025 электронов. Задача 17. В ушедшем 2020 году необычайно большое внимание общества было уделено химии. В частности, в первой половине года наблюдался чудовищный недостаток жаропонижающих средств. Одним из таких средств является парацетамол (D). Примечательно, что название парацетамол является сокращением от чуть ли не номенклатурного названия молекулы: пара-N-ацетил-аминофенол. Мы не знаем какие планы у простейших (и особенно у тех, у кого нет даже нормальной клеточной мембраны), но на всякий случай научим вас синтезировать парацетамол.  Расшифруйте схему синтеза парацетамола и нарисуйте структуры веществ A – D, если известно, что: ● А и B – изомеры; ● В дальнейшие реакциях используется только изомер B; 2. Один из изомеров A и В может образовывать внутримолекулярные водородные связи. Какой? Покажите эту водородную связь. Другое менее известное, но не менее эффективное, жаропонижающее – ибупрофен. Его синтез немного проще – хотябы потому, что не нужно использовать смесь концентрированных азотных и серных кислот.  3. Расшифруйте синтез ибупрофена (M) и нарисуйте структуры G – L (5.5 баллов) если известно, что: ● Формула соединения  ● Формула ибупрофена –  ● В 1H ЯМР спектре соединения I в ароматическом регионе наблюдается два пика с одинаковой интенсивностью В любом случае, синтез парацетамола требует усилий и у вас может быть искушение пойти по короткому пути: купить анаферон. Но из чего он состоит? Посмотрим на этикетку: « д е й с т в у ю щ е е в е щ е с т в о п р е д с т а в л я е т с о б о й в о д н о - с п и р т о в о й р а с т в о р ( м а с с а р а с т в о р а 0.0 0 3 г.) а н т и т е л к г а м м а - и н т е р ф е р о н у ( а ф ф и н н о о ч и щ е н н ы х ) в концентрации не более 10-15 нанограммов на грамм раствора» 4. Если молекулярная масса иммуноглобулина класса G (тех самых антител) составляет около 150 кДа (1 Да – 1 г/моль) найдите количество молекул антител в одной таблетке анаферона. Примечание : не удивляйтесь если у вас получится значение меньше единицы. Вы можете интерпретировать эту цифру как вероятность того, что в одной таблетке будет хотя бы одна молекула антител. 5. Казахстанские мобильные номера имеют формат 77YX XXX XX XX. Вместо Y может быть 0, 4 и 7. Вместо X может быть любая цифра от 0 до 9. Сравните вероятность найти 1 молекулу антитела в 1 таблетке анаферона с вероятностью случайным образом набрать мобильный номер и дозвониться Президенту Республики Казахстан. |
