способы синтеза антибиотиков. способы получения антибиотиков. Способы получения антибиотиков
 Скачать 0.8 Mb. Скачать 0.8 Mb.
|
Механизм биосинтеза эритромицина.Биосинтез эритромицина является еще более сложным, так как в структуру молекулы входят макроцикл, сахара и необходима конденсация этих соединений. Структурной основой является одна молекула пропионил-КоА и шесть молекул метилмалонил-КоА. Первоначально синтезируется эритронолид В, который далее циклизуется и превращается в различные формы эритромицина (А, В и С) после присоединения сахаров – производных глюкозы. Все реакции происходят в мультиферментном комплексе, от которого молекулы отщепляются после полного синтеза. Способность производных пропионовой кислоты и пропилового спирта участвовать в биосинтезе в качестве предшественника молекулы используется на практике: при ферментации их вводят в ферментационную среду, что значительно повышает выход антибиотика. [6] Ниже представлена схема биосинтеза молекулы эритромицина.(рис.8) 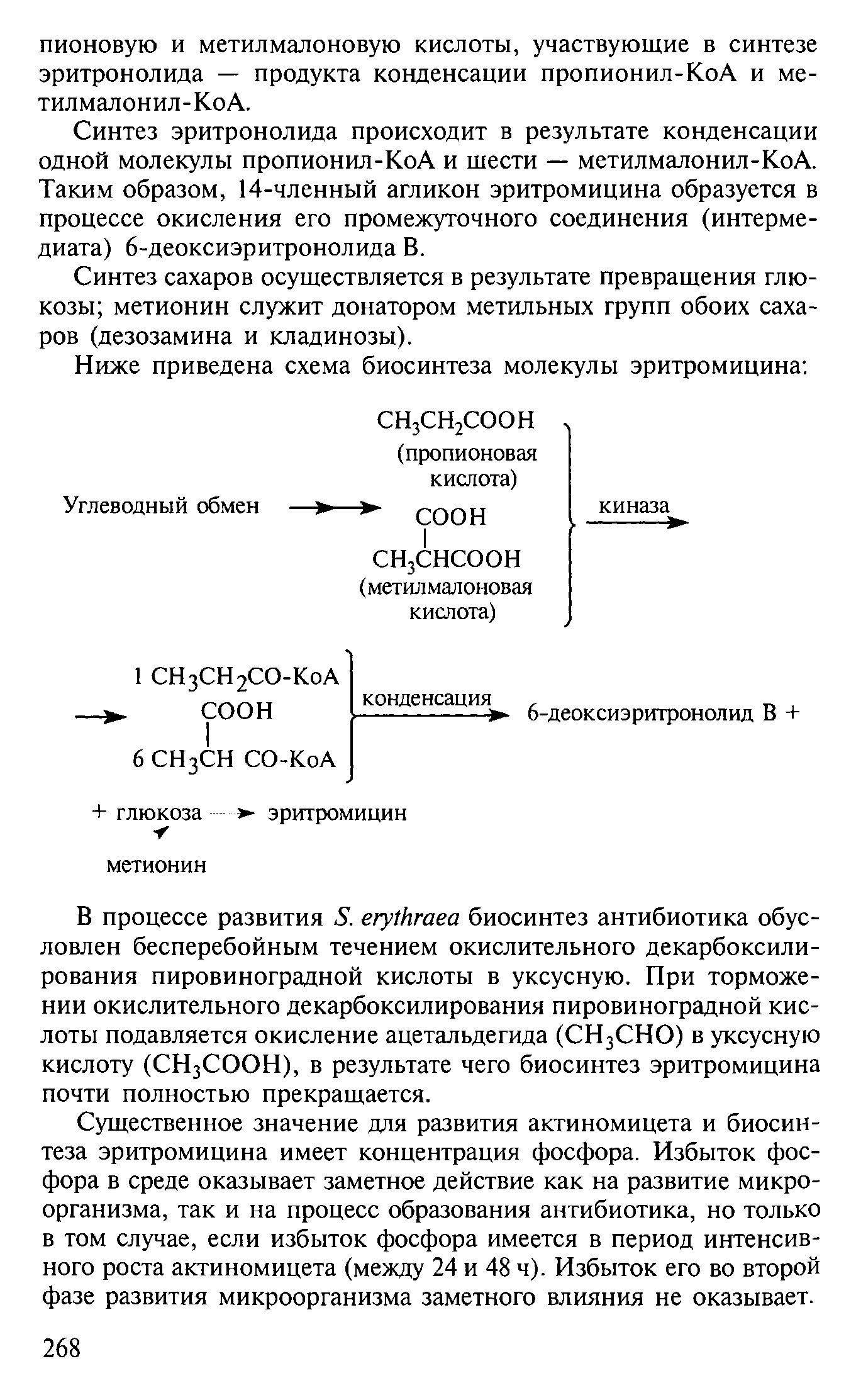 рис.8. Схема синтеза молекулы эритромицина Биотрансформация природных антибиотиков.Поиск новых природных беталактамов и целенаправленная трансформация беталактамной молекулы.Мишени для беталактамов в бактериальной клетке множественны, в клетке имеются разные виды пенициллин-связывающих белков (PBPs). Преимущественное воздействие на белок того или иного вида ведет к разным эффектам — литическому, бактерицидному без лизиса, бактериостатическому с разной длительностью бактериостазиса и т. п. Все это имеет значение для клиники при определении выбора препарата для конкретного больного, режима антибиотикотерапии: частоту введения, возможность использования комбинаций двух беталактамных антибиотиков и т.д. При оценке новых беталактамных структур проверяется их устойчивость к действию разных беталактамаз - пенициллаз и цефалоспориназ плазмидного и хромосомного происхождения, выделенных из разных бактерий. С этой целью используются большие наборы беталактамаз, обладающих разной субстратной специфичностью. Если большинство используемых беталактамаз не инактивирует новую беталактамную структуру, то она признается перспективной для клиники и заслуживает дальнейшего углубленного изучения. Первые успехи в этом направлении были получены, когда химиками были созданы нечувствительные к распространенным у стафилококков пенициллиназам полусинтетические пенициллины, такие как метициллин и оксациллин, а также нечувствительный к ферменту из синегнойной палочки карбенициллин. Получить эти полусинтетические пенициллины удалось после того, как из бензилпенициллина была выделена 6-аминопенициллановая кислота (6АПК): условно названная «ядром» молекулы пенициллина. В промышленных условиях 6АПК производят ферментативным гидролизом либо бензилпенициллина (в России), либо феноксиметилпенициллина (за рубежом) с помощью фермента пенициллинацилазы. Значительный интерес представляют природные соединения с гаммалактамным, т.е. пятичленным, кольцом, обладающие высокой антибактериальной активностью и широким спектром действия. Их мишенями, как и у беталактамов, являются транспептидазы пептидогликана, т.е. разные PBPs. При контакте с мишенью гаммалактамное кольцо подобно беталактамному расщепляется и происходит ацилирование одного из аминокислотных остатков в активном центре транспептидаз. Беталактамазы могут, как оказалось, инактивировать и гаммалактамы. Однако большая стабильность пятичленного гаммалактамного кольца по сравнению с четырехчленным беталактамным расширяет возможности химического синтеза, т. е. получение синтетических гаммалактамов с пространственной защитой гаммалактамного кольца от беталактамаз. Ряды получаемых синтетических гаммалактамов быстро растут и некоторые из этих соединений уже проходят предклинические испытания.[1] Испытания новых беталактамов на степнь сродства к пенициллинсвязывающим белкам (PBPs).Показано, что действие антибиотиков-беталактамов в бактериальной клетке обусловлено взаимодействием их с разными видами пенициллин-связывающих белков (РВРs). Преимущественное воздействие на белок того или иного вида ведет к разным эффектам - литическому, бактерицидному без лизиса, бактериостатическому с разной длительностью бактериостазиса и т.п. У некоторых встречающихся в клинике резистентных к беталактамам штаммов бактерий резистентность проявляется, как отмечалось, на уровне РВРs, т.е. мишени уменьшают сродство к «старым» беталактамам. Поэтому новые природные и полусинтетические беталактамы проверяются на степень сродства к РВРs этих штаммов. В настоящее время распространенным методом лабораторного анализа на выявление РВРs является тест латексной агглцинации (от латинского agglutinare – склеивать). Примером такого теста является набор для выявления РВРs у изолятов Staphylococcus aureus (MRSA) Oxoid РВРs Test, позволяющий определить устойчивость к метициллину. Для выявления гена mecA (ген, кодирующий пенициллиин-связывающий белок) и выявление белка PBPs с помощью латексной агглютинации могут использоваться как коммерческие наборы реагентов и оборудование, так и тесты, разработанные в лаборатории. Вместе с тем, следует помнить, что ген mecC и кодируемый этим геном пенициллин-связывающий белок в настоящее время может не обнаруживаться коммерчески доступными молекулряно-генетическими или фенотипическими методами. Руководства по методам обнаружения гена mecC недавно были опубликованы в официальных источниках.[10,11, 16] Также для определения степени сродства к РВРs используют метод флюориметрии. |
