способы синтеза антибиотиков. способы получения антибиотиков. Способы получения антибиотиков
 Скачать 0.8 Mb. Скачать 0.8 Mb.
|
|
В) грибами
Иллюстрированно представить примеры промышленного оборудования, используемого при направленном биосинтезе антибиотиков. Указать производителя, название марки, назначение, характеристика. 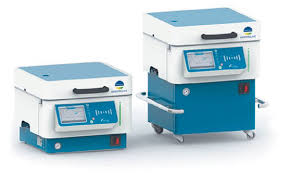 Приборы для приготовления питательных сред MASTERCLAVE® 10 и MASTERCLAVE® 20 Производитель Biomireux. Подходят для подготовки всех видов питательных сред, агара или бульона. Превосходная однородность среды и температуры (±0,5 °С) за счет усовершенствованной запатентованной стальной мешалки с магнитным креплением. Широкий выбор параметров – более 50 программ: простой цикл, двухфазный цикл, цикл с заданными параметрами. Встроенная функция розлива благодаря подключению опционального перистальтического насоса непосредственно к средоварке. Температура стерилизации 95–125 °С. Фильтр встроен непосредственно в крышку: отсутствует риск контаминации. Температура розлива 25–80 °С. Плоская крышка и водяной пистолет для быстрой очистки. Функция автозапуска (автоматическое заполнение водой с отложенным запуском) позволит иметь готовые среды к моменту открытия лаборатории. Полная прослеживаемость благодаря встроенному принтеру, печатающему параметры цикла (ID пользователя, партия, название программы, дата, время, график изменения параметров процесса). Защитная крышка с функцией автоматической блокировки от 80 °С. Компактные системы: размещение под столом и мобильная комплектация.  Биореактор BIOSTAT® B-DCU Производитель Sartorius Stedim Biotech GmbH. Biostat® C-DCU компактный стационарно стерилизуемый ферментер с емкостями для культур, объемом 10, 15, 20 и 30 л (Высота и диаметр емкостей соотносятся как 3:1 или 2:1). Biostat® C-DCU предназначен для решения различных задач, как в области бактериологии, так и области культуры клеток. Biostat ® C-DCU выполнен по модульной технологии и состоит из монтажного блока, емкостей для культур, блока управления и системы DCU3. “Открытая” конструкция монтажного блока обеспечивает быстрый доступ и легкость обслуживания трубопроводов, сосудов и исполнительных устройств. Блок управления, включающий 4 встроенных перистальтических насоса, изготовлен из нержавеющей стали, и позволяет, в зависимости от потребностей, устанавливать в нем различное дополнительное оборудование. Функциональные возможности программного обеспечения ферментера позволяют проводить измерения параметров процесса, автоматическую рутинную калибровку и управлять замкнутыми рабочими циклами. В стандартное оснащение входит система стерилизации реакторов, включающая в себя впускные и выпускные воздушные фильтры. Кроме того, дополнительные возможности включают систему управления давлением, систему измерения и управления весом, измерение pH, мутности и т. д.  Автоматический посев Spiral Plater (Eddy Jet 2) - IUL Компания «МикроБио». Метод спирального посева образцов является широко распространенной в микробиологии техникой, которая была разработана для сокращения количества чашек Петри с питательной средой, используемых для поверхностных посевов. Метод спирального посева позволяет не выполнять серийные разбавления образца, которые необходимы при традиционном способе посева, и которые отнимают много времени. Один спиральный посев позволяет сэкономить 3 чашки питательной среды, что существенно сокращает время опрерации и расход материалов. Спиральный посев образцов проводится по так называемой Архимедовой спирали. Объем пробы, нанесенный вдоль спирали экспоненциально уменьшается так, что один посев содержит несколько концентраций образца, распределенных вдоль спирали. После инкубации, результат учитывают с помощью специальной учетной сетки (вручную) или автоматически с помощью автоматического счетчика колоний ShpereFlash. Особенности: Высокая производительность Возможность соединения с Интернетом Наличие 2xUSB и 2xRS-232 портов позволяет подсоединять прибор к принтеру для распечатки этикеток и протокола посева. Штрих-код ридер обеспечивает прослеживаемость посевов. Интуитивно понятное программное обеспечение Цветная сенсорная панель экрана Минимальное время посева. Используют при контроле качества продукта.  Вертикальная центрифуга с верхней разгрузкой PSB Компания «Алси-ФармТех». Применяются при разделении суспензий, содержащих твёрдую и жидкую фракции, гранулы и волокнистые вещества. - Элементы конструкции идут с гладкой отполированной поверхностью. Части, находящиеся в контакте с рабочим веществом, выполнены из нержавеющей стали. - Откидная крышка позволяет легко чистить пространство между корпусом и барабаном. - Имеет компактные размеры, низкий центр тяжести, жидкостные амортизаторы. - Герметичная конструкция с силиконовым и фторопластовым уплотнением. - Опционально устанавливается CIP система (система мойки элементов центрифуги). - Дополнительная система продувки инертным газом позволяет использовать центрифуги для работы с ядовитыми, легковоспламеняющимися и взрывоопасными веществами. Назвать группу антибиотиков наиболее критичную в отношении совместного производства с другими лекарственными препаратами. Чем это объясняется? Что именно предполагает производство данной группы антибиотиков в отдельных зонах? Беталактамы яляются наиболее критичной группой антибиотиков в отношении совместного производства с другими лекарственными препаратами на одном участвке. Сходство химической структуры предопределяет одинаковый механизм для всех беталактамов, а также перекрестную аллергию – от сыпи до анафилактического шока. Чтобы предупредить перекрестную контаминацию, персонал беталактамных участков не может иметь доступа в другие производственные зоны. Производство беталактамов в отдельных зонах также предполагает полное физическое разделение оборудования и наличие отдельной системы воздухоподготовки. При существовании потенциальной опасности перекрёстной контаминации, необходимо проводить тестирование всех серий любого лекарственного средства на наличие следов β-лактамов. И, соответственно, при обнаружении отказывать в разрешении на выпуск серии лекарственного средства, независимо от других результатов. Выводы.При написании курсовой работы мною была изучена литература по тема «Способы получения антибиотиков», а также изучены группы микроорганизмов, образующих антибиотики, закономерности ферментационного процесса, типы ферментации, биохимические механизмы биосинтеза антибиотиков, принципы метода получения гибридных антибиотиков. Способностью вырабатывать антибиотики обладают не все микроорганизмы, а лишь некоторые штаммы отдельных видов. Так, пенициллин образуют некоторые штаммы Penicillium notatum и P. chrysogenum, а стрептомицин – определенный штамм Streptomyces griseus, тогда как другие штаммы тех же видов либо вообще не вырабатывают антибиотики, либо вырабатывают, но другие. Существуют также различия между штаммами-продуцентами антибиотиков, причем эти различия могут быть количественными или качественными. Один штамм, например, дает максимальный выход данного антибиотика, когда культура растет на поверхности среды и находится в стационарных условиях, а другой – лишь когда его культура погружена в среду и постоянно встряхивается. Некоторые микроорганизмы выделяют не один, а несколько антибиотиков. Так, Pseudomonas aeruginosa образует пиоцианазу, пиоцианин, пиолипоевую кислоту и другие пио-соединения; Bacillus brevis производит грамицидин и тироцидин (смесь, известную под названием тиротрицин); P. notatum – пенициллин и пенатин; Aspergillus flavus – пенициллин и аспергилловую кислоту; Aspergillus fumigatus – фумигатин, спинулозин, фумигацин (гельволевую кислоту) и глиотоксин; Streptomyces griseus – стрептомицин, маннозидострептомицин, циклогексимид и стрептоцин; Streptomyces rimosus – окситетрациклин и римоцидин; Streptomyces aureofaciens – хлортетрациклин и тетрациклин. Один и тот же антибиотик может продуцироваться микроорганизмами разного рода. Так, глиотоксин образуют виды Gliocladium и Trichoderma, а также Aspergillus fumigatus и др. Разные микрорганизмы или их штаммы могут вырабатывать разные химические формы одного и того же антибиотика, например разные пенициллины или различные формы стрептомицина. В последние годы выделено и описано огромное число антибиотиков, продуцируемых различными организмами. Способностью вырабатывать антибиотики обладают как спорообразующие, так и не образующие спор бактерии, а кроме того, более половины изученных на этот предмет родов грибов. Биосинтез антибиотиков – это сложный процесс, состоящий из множества этапов и требующий высокого уровня асептики. В настоящее время ведется поиск новых способов получения антибиотиков с высоким выходом целевого продукта. Приложение 1 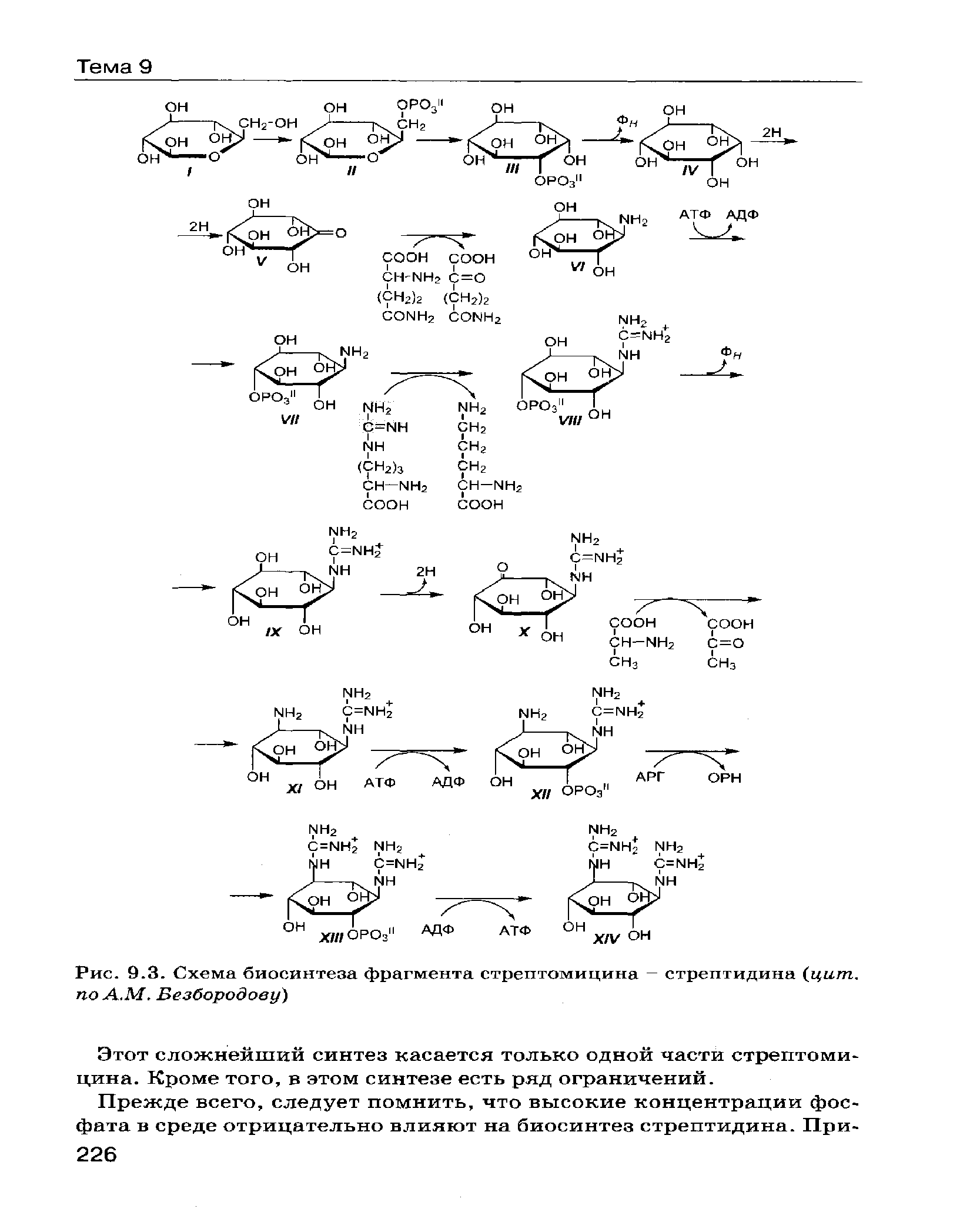 (I) Глюкоза; (II) глюкоза-6-фосфат; (III) мио-инозитол-фосфат; (IV) мио-инозитол; (V) кето-сцилло-инозитол; (VI) 1-амино-1-деокси-сцилло-инозитол; (VII) n-фосфорил-сцилло-инозамин; (VIII) n-фосфорил-N-амидино-сцилло-инозамин; (IX) N-амидино-сцилло-инозамин; (X) N-амидино-3-кето-сцилло-инозамин; (XI) N-амидинстрептамин; (XII) n-фосфорил-N-амидинострептамин; (XIII) фосфорилированный стрептидин; (XIV) стрептидин. 4. Список литературы:Сазыкин Ю.О.: Биотехнология: учебное пособие для студентов высших учебных заведений/ Ю.О.Сазыкин, С.Н.Орехов, И.И.Чакалева; под ред. А.В.Катлинского. – 2-е изд., стер. – М.: Издательский центр «Академия», 2007. – 256 с. Ковалева Т.А.: Биотехнология, часть 1: : учебное пособие для студентов высших учебных заведений/ Т.А. Ковалева, А.И. Сливкин, А.С. Беленова, С.Н. Суслина. – М.: Издательско-полиграфический центр Воронежского государственного университета, 2011. – 89 с. Белясова, Н. А. Микробиология / Белясова Н.А. - Мн.:Вышэйшая школа, 2012. - 443 с.: ISBN 978-985-06-2131-3. - Текст : электронный. - URL: https://new.znanium.com/catalog/product/508546 (дата обращения: 20.05.2020) Н.Г. Селезенев, В.К.Петров, Р.М.Стрельцова, М.В.Пахомова Биотехнология. Материалы лекций. – Рязань, 2004. – 250 с. Сазыкин Ю.О.: Курс лекций по биотехнологии/ Ю.О.Сазыкин, С.Н.Орехов, И.И.Чакалева; под ред. А.В.Катлинского.–Москва, 205. – 152 с. Желдакова Р. А.: Механизмы биосинтеза антибиотиков и их действие на клетки микроорганизмов: Учеб.-метод. комплекс для студентов специальности 1-31 01 01 «Биология» / Р. А. Желдакова. – Мн.: БГУ, 2004. – 111 с. Краснопольский Ю. М.: Фармацевтическая биотехнология: Производство биологически активных веществ : учеб. пособие : в 2 ч. – Ч. 1 / Ю. М. Краснопольский, Н. Ф. Клещев. – Харьков : НТУ «ХПИ», 2013. – 304 с. Бутова С.Н.: Теоретические основы биотехнологии. Биохимические основы синтеза биологически активных веществ./ Бутова С.Н., Типисева И.А., Эль-Регистан Г.И. под общей редакцией И.М.Грачевой.// - М.: Элевар, 2003. - 554 с. Егоров И.С.: Основы учения об антибиотиках: Учебник. 6-е изд., перераб. и доп. / Н.С. Егоров. - М.: Изд-во МГУ; Наука, 2004. - 528 с. Статьи: Stegger M, Andersen PS, Kearns A, Pichon B, Holmes MA, Edwards G, Laurent F, Teale C, Skov R, Larsen AR. Rapid detection, differentiation and typing of methicillin-resistant Staphylococcus aureus harbouring either mecA or the new mecA homologue mecALGA251. Clin Microbiol Infect. 2012; 4:395-400 (Stegger M, Andersen PS, Kearns A, Pichon B, Holmes MA, Edwards G, Laurent F, Teale C, Skov R, Larsen AR. Быстрое обнаружение, дифференциация и типизация метициллин-устойчивого Staphylococcus aureus, содержащего либо mecA, либо новый гомолог mecA - ecALGA251. Европейское общество клинической микробиологии и инфекционных болезней. Журнал «Клиническая микробиология и инфекционные заболевания» 2012 г.; 4: 395-400). Pichon B, Hill R, Laurent F, Larsen AR, Skov RL, Holmes M, Edwards GF, Teale C, Kearns AM. Development of a real-time quadruplex PCR assay for simultaneous detection of nuc, PantonValentine leucocidin (PVL), mecA and homologue mecALGA251. J Antimicrob Chemother. 2012; 67:2338-41 (Pichon B, Hill R, Laurent F, Larsen AR, Skov RL, Holmes M, Edwards GF, Teale C, Kearns AM. Использование квадруплексной ПЦР в режиме реального времени для одновременного выявления nuc, лейкоцидина Пантон Валентина (ЛПВ), mecA и его гомолога mecALGA251. Журнал антимикробной химиотерапии. 2012 г.; 67: 2338-41). Создание антибиотиков двойного действия как путь поиска новых перспективных лекарственных препаратов / А.Н.Тевяшова, Е.Н.Олсуфьева, М.Н.Преображенская // Успехи химии. – 2015. – Т.84, N.1. – с.1-120. Интернет-ресурсы: Бурьян Н. И., Тюрина Л. В: Миробиология виноделия// Синреф: интерне-портал – Режим доступа: https://sinref.ru/000_uchebniki/05599_vinodelie/020_mikrobiologia_vinodel/001.htm/ - Дата обращения 22.04.2020 Актиномицеты // Микросайт: интернет-портал – Режим доступа: http://microsight.ssmu.ru/morfologiya-mm/morfologiya-mikroorganizmov-mm/nitevidnye/aktinomitsety - Дата обращения 22.04.2020 Познайка: интернет-портал – Режим доступа: https://poznayka.org/s2528t1.html - Дата обращения 25.04.2020 Руководство EUCAST по выявлению механизмов резистентности и резистентности, имеющей особое клиническое и/или эпидемиологическое значение [Электронный ресурс] – Режим доступа: http://www.antibiotic.ru/minzdrav/files/docs/eucast-guideline-on-detection-of-resistance-mechanisms-1.0-rus.pdf - Дата обращения 1.05.2020 Библиотека авторефератов и диссертаций по физико-математическим и химическим наукам // Физматим: интернет-портал. – Режим доступа: http://fizmathim.com/read/589498/a?#?page=40 – Дата обращения 05.05.2020 |
