Краткий справочник гальванотехника - 1993 - Ильин. Справочник гальванотехника санктПетербург " политехника"
 Скачать 3.02 Mb. Скачать 3.02 Mb.
|
|
Соотношение плотности и концентрации растворов аммиака при 20С
Таблица 8 Соотношение плотности и концентрации хромового ангидрида при 15С
Таблица 9 Содержание металлов в их соединениях
Таблица 10 Концентрации некоторых продажных материалов
Таблица 11 Удельное сопротивление некоторых растворов-электролитов, Оммм
Коррозией называется процесс разрушения металлов при их химическом, электрохимическом или биологическом воздействии с окружающей средой. На металле, находящемся в контакте с электропроводной жидкостью, возникает электрический потенциал, который измеряется по отношению к потенциалу водородного электрода, принятому за нуль. Электрический заряд на металле образуется в результате перехода металла в раствор в виде положительно заряженного иона (катиона), а сам металл приобретает поэтому отрицательный заряд; возможен и обратный процесс, т. е. адсорбция катионов поверхностью металла, заряжающих металл положительно. Между металлом и его катионом наступает равновесное состояние, которое можно представить в следующем виде: Если два металла, имеющих различные потенциалы, соединить в одну электрическую цепь, то получится система, называемая гальваническим элементом; в этом случае равновесие нарушается и более отрицательный электрод растворяется, посылая электроны к более положительному электроду. Электрохимическая коррозия протекает по схеме гальванического элемента. Процесс с водородной деполяризацией характерен для растворения металла в кислой среде (рис. 1, а), процесс с кислородной деполяризацией протекает при атмосферной коррозии, когда кислород и влага являются основными факторами коррозии (рис. 1, б). Для оценки свойств металла, определяющих его электрохимическое поведение, можно пользоваться стандартным потенциалом, 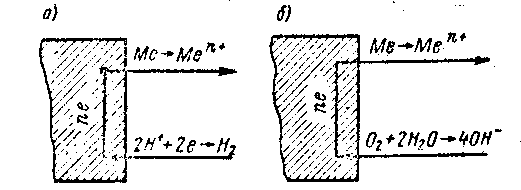 Рис. 1. Схема процесса электрохимической коррозии: а—водородная деполяризация; б — кислородная деполяризация который возникает при погружении металла в раствор его соли, содержащей 1 грамм-ион данного металла в 1 л раствора. Значения стандартных потенциалов ряда окислительно-восстановительных электродных реакций приведены в табл. 12. В том случае, если концентрация растворов отличается от нормальной где 0 — стандартный потенциал; z— валентность иона; Меп+ — концентрация ионов металла, г-экв/л. Для определения коррозионных свойств металлов можно использовать их потенциалы в пресной и морской воде (табл. 13). На скорость коррозии металла кроме электродного потенциала влияют также состав среды, ее электропроводность и наличие структурных неоднородностей в металле. В табл. 14 представлены данные о коррозионной устойчивости металлов в различных растворах. В конструкциях приборов и машин помимо сведений о коррозионной устойчивости металлов следует учитывать контакт различных металлов между собою, руководствуясь табл. 15, в которой представлены допустимые и недопустимые контакты между металлами. Знаком плюс отмечены допустимые пары, а знаком минус — недопустимые. Таблица 12 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
