курсовая. ПРОМ%20яссин. Технология капсулированных биопрепаратов. Пробиотики
 Скачать 1.13 Mb. Скачать 1.13 Mb.
|
|
1.2. Классификация пробиотиков. Препараты для восстановления микрофлоды представлены пробиотиками различного состава: на основе живых клеток молочнокислых бактерий, препаратами инактивированных клеток пробиотической флоры, продуктами метаболизма или стимуляторами роста физиологических бактерий (пребиотиками), а также синбиотиками — комбинированными препаратами, содержащими пробиотики и пребиотики. В зависимости от состава пробиотическго препарата: 1.Монопробиотики: Бифидосодержащие: Бифидумбактерин, Пробифор, Бифидоген. Лактосодержащие: Лактобактерин, Биобактон. Колисодержащие: Колибактерин. 2. Полипробиотики (синбиотики): Бифидосодержащие: Бифилонг. Лактосодержащие: Ацилакт. Бифидо- и лактосодержащие: Бифацид. Бифидо- и колисодержащие: Бификол. Энтерококксодержащие: Бифиформ, Линекс 3. Самоэлиминирующиеся антагонисты: Бациллярные: Бактисубтил, Биоспорин, Споробактерин. Сахаромицетсодержащие: Энтерол. 4. Комбинированные (синбиотики): Линекс Био, Аципол, Бифиформ комплекс, Бифилиз, Капацид. 5. Бесклеточные пробиотики: Хилак-форте. В зависимости от назначения: 1. Гетеропробиотики — вне зависимости видовой принадлежности хозяина, от которого первоначально были выделены штаммы. 2. Гомопробиотики — назначаются только представителям того де вида животных или человека, из биоматериала которого были выделены соответствующие штаммы. 3. Аутопробиотики — штаммы нормальной микрофлоры, изолируемые от конкретного индивидуума и предназначенные для коррекции его микроэкологии. От времени создания и усовершенствования. 1 поколение. Монокомпонентные препараты, состоящие из одного штамма микроорганизма — типичные обитатели кишечника (бифидумбактерии, лактобактерии и др.) 2 поколение. Самоэлиминирующиеся антагонисты (бактисубтил, энтерол и др.) 3 поколение. Поликомпонентные препараты (симбиотики), состоящие из нескольких (от 2-30) штаммов бактерий (бифилонг и др.) или несколько видов бактерий (линекс, бификол и др.) 4 поколение. Комбинированные препараты (синбиотики), состоящие из штамма бактерий и ингридиентов, способствующих их росту, размножению и метаболитной активности (бифилиз, кипацид и др.) 5 поколение. Поликомпонентные комбинированные препараты. Состоящие из нескольких видов бактерий и ингредиентов, способствующих их росту, размножению и метаболической активности (бифиформ и др.) 1.3. Технология получения пробиотиков. Необходимым условием массового производства препаратов пробиотиков является сохранение их стабильности в течение длительного времени. Бактерийные препараты, содержащие живые организмы, относятся к наименее стойким. На выживаемость микроорганизмов в сухих препаратах влияют следующие факторы: регламентированное содержание остаточной влаги; наличие защитных сред; хранение сухих препаратов в атмосфере, не содержащей кислород. В целях защиты пробиотиков от кислой среды желудка на таблетированные и капсулированные формы наносят ацидорезистентные покрытия или проводят иммобилизацию бактерий на сорбенте. Для получения препаратов пробиотиков необходимо иметь штаммы микроорганизма симбионта. Их выделяют из кишечного содержимого здоровых детей и взрослых. Микроорганизмы, которые будут использоваться в качестве пробиотиков, должны соответствовать следующим требованиям: Предлагаемый штамм должен быть идентифицирован до вида по фено- и генотипическим признакам и по профилю плазмидной ДНК. Штамм, имеющий R-плазмиды, транспозоны, конвертируемые бактериофаги (профаги), не может быть использован при производстве пробиотиков. При обнаружении других разновидностей плазмид следует представить материалы по характеристике их функциональных свойств. Устойчивость штамма к антибиотикам должна быть обусловлена хромосомной природой, что необходимо подтверждать до её выявления. Генетически модифицированные микроорганизмы должны стабильно экспрессировать клонированные целевые гены и при многократном пассировании in vivo на культуре клеток или при введении лабораторным животным должны сохранять исходные биологические свойства. Должны быть экспериментально установлены отсутствие неконтролируемой передачи клонированной ДНК «новым хозяевам» и невозможность широкого распространения их плазмиды, следствием чего может быть нарушение микробной экосистемы; т.е. должна быть доказана их биобезопасность. Рекомбинантная ДНК, используемая для получения генетически модифицированных штаммов микроорганизмов, не должна содержать маркеров антибиотикорезистентности. Штамм, независимо от вида и рода, должен обладать однородными морфологическими, тинкториальными, культуральными свойствами без признаков диссоциации. Не допускается образование слизистых колоний пробиотическими производственными штаммами и наличие у них капсул, которые являются признаками вирулентности бактериальных культур. Штамм с неясной характеристикой не может использоваться для производственных целей. Штамм должен быть однороден по физиолого-биохимическим свойствам, охарактеризованным с помощью регламентированных методов или с использованием зарегистрированных тест-систем. Штаммы с неясной биохимической характеристикой не могут быть рекомендованы в качестве производственных. Штамм не должен продуцировать ферменты, относящиеся к факторам патогенности, например, каталазу, гиалуронидазу, фибринолизин, плазмокоагулазу, гемолизин, летициназу С, нейраминидазу и др. Штамм должен обладать антагонистической активностью по отношению к клиническим свежевыделенным патогенным и условно-патогенным микроорганизмам и сертифицированным тест-штаммам (в соответствии с требованиями нормативной документации). Зона угнетения роста тест-культур быть должна быть более 10 мм. Штамм не должен обладать высокими адгезивными свойствами. Штамм должен обладать высокой устойчивостью к воздействию желудочного сока, желчи, щёлочи или быть защищённым от их воздействия в лекарственной форме пробиотика. Штамм должен быть охарактеризован по способности продуцировать биологически активные вещества (например, ферменты, витамины, кислоты, лизоцим, бактериоцины, антибиотикоподобные вещества и др.). Штаммы всех видов микроорганизмов, предлагаемые для производства пробиотиков, должны быть невирулентными, нетоксигенными, нетоксичными, безопасными для людей, включая, при необходимости, иммунологическую безопасность. Исследование осуществляют в соответствии с ОФС «Безопасность пробиотиков для медицинского применения». Штаммы, предполагаемые в качестве кандидатов на применение в составе пробиотика, должны быть изучены на лабораторных моделях для оценки механизма их терапевтического действия при введении способом, рекомендованным для человека. В готовой форме препарата пробиотика оценивают соотношение терапевтической и безопасной дозы (клинические исследования, фаза I — оценка переносимости, безопасности, терапевтического действия, подтверждение механизма действия), сохранение способности к продукции биологически активных веществ, наличие живых микробных клеток на протяжении срока годности экспериментально-производственных серий препарата. Рекомендуемый для изготовления пробиотических препаратов штамм должен быть депонирован в официальной национальной или международной коллекции с указанием источника и даты выделения, характеристики биологических свойств. Удовлетворяющие всем этим требованиям штаммы поступают в контрольный институт, откуда их передают в фармацевтическое производство с соответствующими документами, отражающими их характеристики [3]. В заводских лабораториях штаммы высеивают на искусственные питательные среды, проверяют их соответствие паспортным данным (род, вид, биологические свойства). После этого их используют для получения препаратов пробиотиков. В условиях промышленного производства эти штаммы рассеивают и получают отдельные колонии, которые затем пересевают на агаризированные или жидкие питательные среды (например, молочнокислые бактерии хорошо растут в обезжиренном молоке). Бифидобактерии, лактобациллы, энтерококки – это ауксотрофы. Они не могут сами синтезировать аминокислоты, пуриновые и пиримидиновые основания, витамины, поэтому их должна содержать питательная среда, в которой они выращиваются. Для культивирования этих бактерий используется сырье, разрешенное в пищевой промышленности, так как препарат, выращенный на этих средах, используется для внутреннего применения. Источником аминокислот обычно служит белок молока (казеин), который гидролизуют с помощью ферментов (трипсина и пепсина) и получают, соответственно триптол или пептол. Как источник витаминов, а также пиримидиновых и пуриновых оснований используют дрожжевой экстракт, который получают из дрожжей Saccharomyces (пивных либо пекарстких). В качестве микроэлементов используют соли магния, марганца, цинка, которые добавляют в питательную среду для культивирования молочнокислых бактерий. Источником энергии служит лактоза или глюкоза. Молочнокислые бактерии культивируют от 8 до 16 часов, собирают штаммы в той фазе роста, при которой выживание клеток будет наиболее длительным. Это обеспечит длительное хранение полученного препарата. После процесса культивирования получают бактериальную суспензию, содержащую в 1 мл 109 и более клеток. Эти клетки собирают, используя поточные центрифуги или сепараторы, в которой образуется похожая на сметану с кремовым оттенком масса со специфическим запахом кислого молока. Раствор криопротекторов (вещества белковой природы - обезжиренное молоко или желатин, углеводы – лактоза, сахароза) добавляют в проточную массу и получают густую суспензию клеток, которую разливают в ампулы. Затем их замораживают в жидком азоте и подвергают лиофильной сушке. Сухая масса приобретает пузырчатый вид. Ее измельчают и определяют титр, в соответствии с которым вносят во флаконы или смешивают с культурой другого штамма. Для увеличения сроков жизнеспособности бактерий показана сублимационная сушка, проходящая в условиях низкой температуры (-400ºС) и глубокого вакуума. Укупорку сухих биопрепаратов в виду их гигроскопичности производят под вакуумом или в токе инертного газа. Форма выпуска: Жидкие лекарственные формы: эмульсия для приема внутрь, концентрат жидкий во флаконах, раствор масляный, капли для приема внутрь. Твердые лекарственные формы: капсулы, порошок для перорального применения во флаконах или саше, таблетки жевательные, порошок во флаконе с растворителем, лиофилизат для приготовления суспензии для приема внутрь. Мягкие лекарственные формы: суппозитории. Чаще всего используют капсулы, так как это наиболее удобная лекарственная форма для применения. Рисунок 1. Схема получения пробиотиков (лактобактерина) 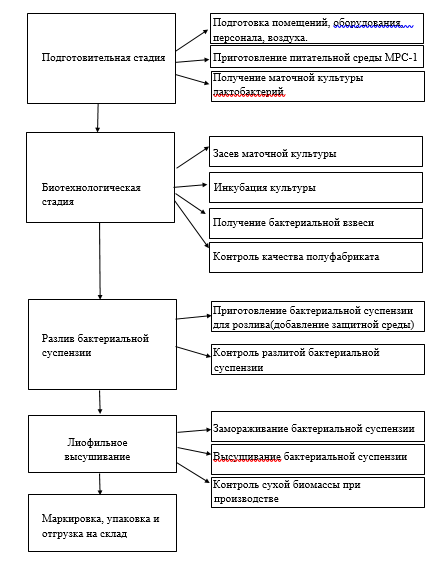 1.4. Капсулы — определение, классификация. Преимущества и недостатки лекарственной формы. Капсулы представляют собой дозированную лекарственную форму, содержащую одно или несколько действующих веществ различной консистенции, с добавлением или без вспомогательных веществ, заключенных в твердую или мягкую оболочку. [2] Большое разнообразие капсулированных препаратов, выпускаемых промышленностью, требует их систематизации и классификации. В зависимости от технологии получения: 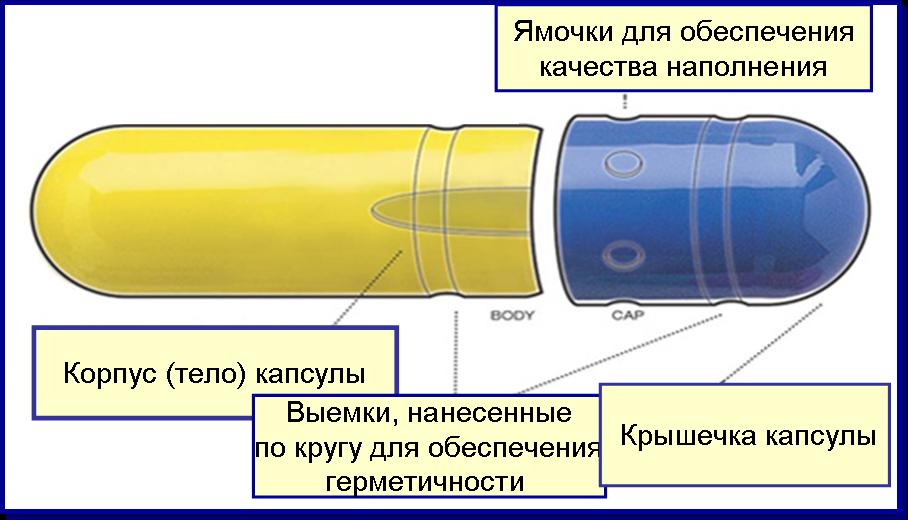 1. Твердые или двухстворчатые (capsulae dure or operculatae)–капсулы цилиндрической формы с полусферическими концами, состоящие из двух частей – корпуса и крышечки, которые входят одна в другую, не образуя зазоров. Корпус и крышечка могут иметь специальные канавки и выступы для обеспечения «замка». Рис.2. 1. Твердые или двухстворчатые (capsulae dure or operculatae)–капсулы цилиндрической формы с полусферическими концами, состоящие из двух частей – корпуса и крышечки, которые входят одна в другую, не образуя зазоров. Корпус и крышечка могут иметь специальные канавки и выступы для обеспечения «замка». Рис.2.Рисунок 2. Строение твердой желатиновой капсулы •Спансулы–твердые желатиновые капсулы, содержащие смесь микрокапсул (драже) с жировой оболочкой, которые имеют разное время растворенияю •Медулы–твердые желатиновые капсулы с крышечкой, заполненные микрокапсулами с пленочной оболочкой, имеющими разное время растворения. 2. Мягкие или цельные (capsulae molles)– цельные капсулы различной формы: сферической, цилиндрической, яйцевидной (ректальные или вагинальные), продолговатой или цилиндрической с полусферическими концами, со швом или без шва. Мягкие капсулы имеют более толстую оболочку, чем твердые. Капсулы могут быть различных размеров, вместимостью до 1,5 мл. Эластичность оболочки мягких капсул зависит от содержания пластификаторов. 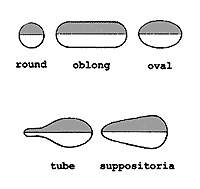 Они, в свою очередь мягкие желатиновые капсулы подразделяются по форме (рис.3.) : Они, в свою очередь мягкие желатиновые капсулы подразделяются по форме (рис.3.) : Рисунок 3.Желатиновые капсулы Шовные (имеющие продольный шов спайки двух одинаковых половинок). Сферические. Овальные. В виде суппозиториев. Тубатины–специальная детская лекарственная форма, представляющая собой мягки желатиновые капсулы с удлиненной шейкой. Они предназначены для маленьких детей, не умеющих глотать таблетки: при надкусывании шейки тубатины, ребенок высасывает содержимое. По назначению капсулы подразделяются на: 1. Медицинские 2. Лечебно-профилактические 3. Для пищевых добавок 4. Ветеринарные 5. Продукты питания 6. Косметические (ароматизаторы, масло) По месту введения капсулы делятся на: 1. Энтеральные, которые, в свою очередь, подразделяются в зависимости от места высвобождения на: Желудочные Кишечные (распадающиеся в среде тонкого кишечника) В отдельную подгруппу выделяют капсулы-ретард —капсулы с пролонгированным высвобождением действующего вещества 2. Ректальные 3. Вагинальные 4. Жевательные Различают желатиновые капсулы и по вместимости: 1. Во всем мире твердые желатиновые капсулы выпускаются 8 стандартных типоразмеров от №5 (наименьшие) до № 000 (наибольшие). Кроме того, существуют 3 модели ветеринарных капсул, имеющих следующие емкости: №10—8 см3, №11—15см3, №12—30см3. 2. Мягкие капсулы со швом могут вмещать до 7,5 мл. При получении мягких капсул на автоматических линиях емкость валков автомата, с помощью которых капсулы формируются, наполняются и запаиваются измеряется в еденицах, именуемых minim. Один minim равен, в среднем, 0,0062 мл. Наиболее часто применяется размеры ячеек валков составляют от 2 до 80 minim. По характеру высвобождения действующего вещества делят на: капсулы с обычным высвобождением (капсулы) капсулы с модифицированным высвобождением Капсулы с модифицированным высвобождением действующего вещества представляют собой твердые или мягкие капсулы, полученные по особой технологии, или в состав оболочки и/или содержимого которых входят специальные вспомогательные вещества, которые позволяют регулировать время и/или место высвобождения действующего вещества. Среди капсул с модифицированным высвобождением действующего вещества различают капсулы с пролонгированным высвобождением, капсулы с отсроченным высвобождением. Капсулы кишечнорастворимые – капсулы, покрытые оболочкой, устойчивой к действию желудочного сока, или полученные с использованием веществ, устойчивых к воздействию желудочного сока, или капсулы, представляющие собой твердые капсулы, наполненные гранулами, микрокапсулами или другими частицами, покрытыми кислотоустойчивой оболочкой. Содержимое кишечнорастворимых капсул высвобождается в верхнем отделе кишечника. Разновидностью капсул являются пеллеты. Пеллеты – покрытые оболочкой твердые частицы шарообразной формы, содержащие одно или несколько действующих веществ различной консистенции с добавлением или без вспомогательных веществ, обычно имеющие размеры от 2000 до 5000 мкм. К преимуществам лекарственной формы относят: Точность дозирования. Современное оборудование обеспечивает высокую точность дозирования. Высокая производительность. Производительность может достигать до 120 тыс. в 1 час. Высокая биодоступность в сравнении с таблетками. Быстрота наступления лечебного действия. Оболочки капсул быстро набухают и распадаются. Возможность использования разнообразных веществ. Высокая стабильность лекарственной формы. Это достигается благодаря герметичности. Корригирующая способность. Скрыт неприятный запах и вкус. Минимальная возможность производственной ошибки. Возможность придания лекарственному средству определенных заданных свойств: пролонгированность действия, кишечнорастворимость. Высокая эстетичность. Использование щадящих технологических режимов. При этом существуют недостатки лекарственной формы: Отсутствует контроль вскрытия. Они подвержены влиянию относительной влажности и микробному загрязнению. Так как желатин может поглощать влагу. Трудность проглатывания. Возможная несовместимость оболочки с компонентами ЛВ. |
