Химия ответы. с ответами. Тема Основные химические понятия и законы химии Ключевые понятия атом
 Скачать 0.55 Mb. Скачать 0.55 Mb.
|
Тема 3. Химическая связь. Строение вещества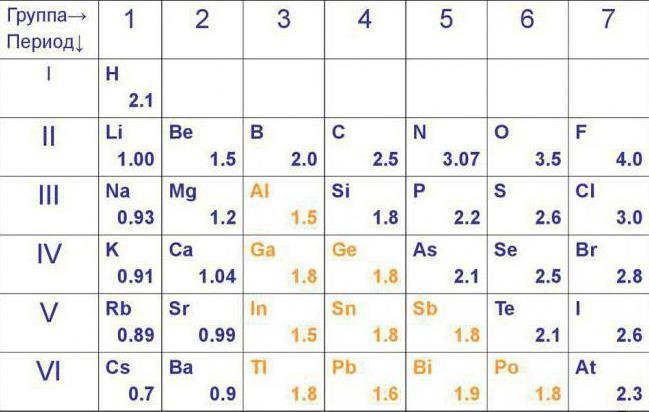 Ключевые понятия: восстановитель; Склонность к отдаче электронов, то есть восстановительные свойства,металлы окислитель; присоединяют электроны, то есть проявляют окислительные свойства, неметаллы, хотя их атомы могут и отдавать электроны (кроме фтора).уц относительная электроотрицательность; Для характеристики способности атома в соединении притягивать электроны используют понятие относительная электроотрицательность . химическая связь; взаимное сцепление атомов в молекуле и кристаллической решетке под воздействием электрических сил притяжения между атомами. ковалентная (полярная и неполярная) связь; Химическая связь, осуществляемая за счет образования общих (связывающих) электронных пар, называется ковалентной.Ковалентная связь, образованная атомами с одинаковой электроотрицательностью называется неполярной. Образование ковалентной связи между атомами с различной электроотрицательностью (электроотрицательность которых различается незначительно), называется полярной донор; Другой механизм образования ковалентной связи — донорно-акцепторный. В этом случае связь возникает за счет двух спаренных электронов одного атома (донора) и свободной орбитали другого атома (акцептор). Хорошо известный пример — образование иона аммония: Н++:NH3– [Н:NH3]+ NH4+ акцептор; ионная связь; Ионная связь возникает между атомами, электроотрицательность которых резко различается. Химическая связь, осуществляемая за счет электростатического притяжения между ионами, называется ионной связью водородная связь; форма ассоциации между электроотрицательным атомом и атомом водорода H, связанным ковалентно с другим электроотрицательным атомом. кристаллическая решетка; особая структура твердого вещества ,в котрой частицы вещества расположены в строго определенном порядке силы Ван-дер-Ваальса; Межмолекулярные взаимодействия - взаимодействия молекул между собой, не приводящие к разрыву или образованию новых химических связей. Межмолекулярные взаимодействия определяют отличие реальных газов от идеальных, существование жидкостей и молекулярных кристаллов. От межмолекулярных взаимодействий зависят многие структурные, спектральные, термодинамические, теплофизические и другие свойства веществ. Появление понятия межмолекулярные взаимодействия связано с именем Й. Д. Ван-дер-Ваальса, который для объяснения свойств реальных газов и жидкостей предложил в 1873 уравнение состояния, учитывающее межмолекулярные взаимодействия. Поэтому силы межмолекулярного взаимодействия часто называют ван-дер-ваальсовыми. Силы Ван-дер-Ваальса относительно слабые, энергия химической связи приблизительно на порядок превышает их величину. атомная кристаллическая решетка; Кристаллические решетки, в узлах которых находятся нейтральные атомы, называются атомными, все атомы решетки связаны между собой прочными неполярными или слабо полярными связями, образуя как бы одну гигантскую «молекулу» ионная кристаллическая решетка; Ионные кристаллические решетки состоят из чередующихся положительных и отрицательных ионов, связанных силами электростатического притяжения металлическая кристаллическая решетка; Кристаллические решетки, образуемые металлами, называются металлическими. молекулярные кристаллы; Молекулярные кристаллы образованы молекулами, между которыми действуют относительно слабые межмолекулярные силы (силы Ван-дер-Ваальса, водородная связь). чистое вещество; это вещества, которые обладают постоянными физическими свойствами. гомогенные и гетерогенные смеси. Различают смеси гомогенные (однородные) и гетерогенные (неоднородные). Однородные смеси – это такие смеси двух или нескольких веществ, в которых даже под микроскопом нельзя обнаружить частицы этих веществ. Например, раствор сахара в воде, чистый воздух и др. Неоднородные смеси – это такие смеси, в которых невооруженным глазом или при помощи микроскопа можно обнаружить частицы двух или нескольких веществ. Например, пыльный воздух, мутная вода, кровь, молоко и др. |
