Химия ответы. с ответами. Тема Основные химические понятия и законы химии Ключевые понятия атом
 Скачать 0.55 Mb. Скачать 0.55 Mb.
|
Вопросы для самопроверки:По каким признакам классифицируются химические реакции? 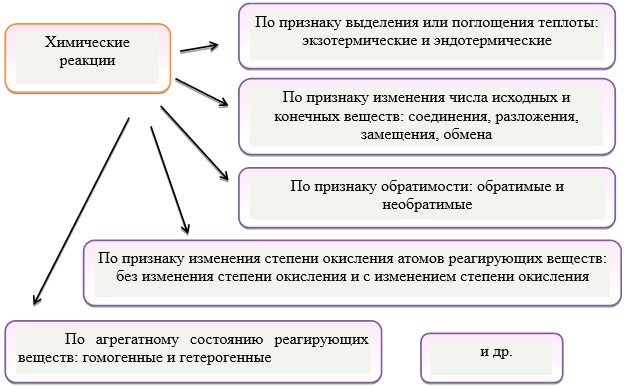 Чему равна степень окисления в любой частице? В простых веществах степень окисления любого элемента равна нулю, в сложных соединениях металлы имеют исключительно положительную степень окисления, неметаллы могут быть как положительными, так и отрицательными. Назовите важнейшие восстановители. Важнейшими восстановителями являются: аммиак NН3, гидразин N2H4 и его органические производные, углеводороды, спирты, амины и другие вещества. Назовите важнейшие окислители. Важнейшими окислителями являются: азотная кислота НNO3 и ее соли – нитраты, тетраoксид азота N2O4, соли хлорной кислоты НСlО4 – перхлораты, перманганат калия КМnО4 и др. В чем смысл метода электронных уравнений (электронного баланса)? Количество электронов, отданных восстановителями равно количеству электронов, принятых окислителями От каких факторов зависит скорость химической реакции? От природы реагирующих веществ, концетрации реагентов, площади соприкосновения реагирующих реагентов, температуры , наличия катализатора Как скорость химической реакции зависит от температуры? При увеличении температуры молекулы начинают двигаться быстрее, чаще сталкиваться друг с другом. Таким образом ,скорость реакции всегда возрастает при повышении температуры и уменьшается-при понижении Какие реакции считаются необратимыми? Реакции при которых взятые вещества нацело превращаются в продукты реакции Какие реакции считаются обратимыми? Реакции, одновременно протекающие в двух противоположных направлениях В чем суть такого явления как «катализ»? Катализаторами называют вещества, которые увеличивают скорости химических реакций, но сами при этом не расходуются. Явление такого ускорения реакций называется катализом. Тема 7. Металлы и неметаллы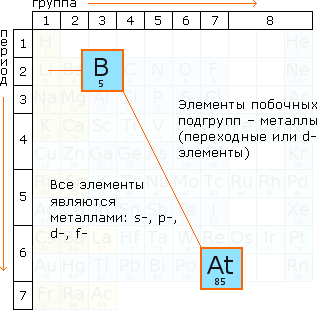 Рис. 10. Положение металлов в Периодической системе Электрохимический ряд напряжения металлов. Таблица 5. Положение неметаллических элементов в периодической системе химических элементов
Ключевые понятия: металл; К металлам относят простые вещества, образованные атомами элементов, имеющих небольшое число (от 1 до 4) электронов на внешнем энергетическом уровне металлическая связь; ― это связь между положительно заряженными ионами металлов и свободными электронами в кристаллической решетке металлов. Металлическая связь имеет некоторое сходство с ковалентной, но и кристаллическая решетка; Металлы имеют кристаллическую решетку, в узлах которой находятся атомы или ионы (+); между ними находятся свободные электроны (электронный газ). коррозия металлов; Коррозия металлов - (от латинского corrodere - грызть) процессы, происходящие в результате химического воздействия окружающей среды, в результате которых происходит их разрушение. химическая коррозия; Химическая коррозия, которую иногда ещё называют газовой, так как иногда она происходит под воздействием газообразных компонентов из окружающей среды при высоких температурах. Химическая коррозия может происходить и под воздействием некоторых агрессивных жидкостей. электрохимическая коррозия; поверхностное разрушение в среде электролита с возникновением в системе электрического тока. Характер разрушения поверхности металла может быть различным и зависит от свойств этого металла и условиях протекания процесса. атмосферная коррозия; протекает во влажном воздухе при обычной температуре. Поверхность металла покрывается плёнкой влаги, содержащей растворённый кислород. Интенсивность разрушения металла возрастает с ростом влажности воздуха, а также содержанием в нём газообразных оксидов углерода, серы, при наличии в металле шероховатостей, трещин облегчающих конденсацию влаги. почвенная коррозия; Почвенной коррозии подвержены трубопроводы, кабели, подземные сооружения. В этом случае металлы соприкасаются с влагой почвы, содержащей растворённый кислород. Во влажной почве, с повышенной кислотностью трубопроводы разрушаются в течение полугода после их укладки (конечно, если не принять меры по их защите). электрическая коррозия; происходит под действием блуждающих токов, возникающих от посторонних источников (линии электропередач, электрические железные дороги, различные электроустановки, работающие на постоянном электрическом токе). Блуждающие токи вызывают разрушение газопроводов, нефтепроводов, электрокабелей, различных сооружений. ингибиторы коррозии; Для замедления коррозии металлических изделий в агрессивную среду добавляют вещества (чаще всего органические), называемые ингибиторами (замедлители окисления металла). щелочные металлы; элементы 1й группы периодической таблицы химических элементов щелочноземельные металлы; элементы 2й группы периодической таблицы химических элементов переходные металлы; химические элементы побочных подгрупп 1-8 групп периодической системы элементов Менделеева. Переходные металлы выделяют на основании незавершенности внутренних электронных оболочек их атомов или ионов. Термин переходнын связан с тем что в периодах эти элементы распологаются между s и p элементами неметалл; это химические элементы, которые образуют в свободном состоянии простые вещества, не обладающие физическими и химическими свойствам металлов. Неметаллы – это химические элементы, атомы которых принимают электроны для завершения внешнего энергетического уровня, образуя при этом отрицательно заряженные ионы. галоген; химические элементы 7 группы .Реагируют почти со всеми простыми веществами, все галогены энергичные окислители, поэтому встречаются в природе в виде соединений халькоген. O, S, Se, Te, Po |
