Тема Соединения со смешанными функциями Гидроксиальдегиды и гидроксикетоны. Гидрокси и оксокислоты Цель занятия
 Скачать 1.67 Mb. Скачать 1.67 Mb.
|
|
|
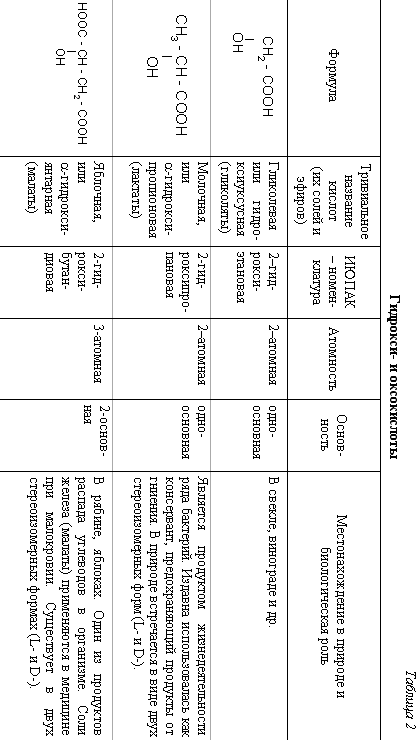
| Формула | Тривиальное Название кислот (их солей и эфиров) | ИЮПАК-номенклатура | Атомность | Основность | Местонахождение в природе и биологическая роль |
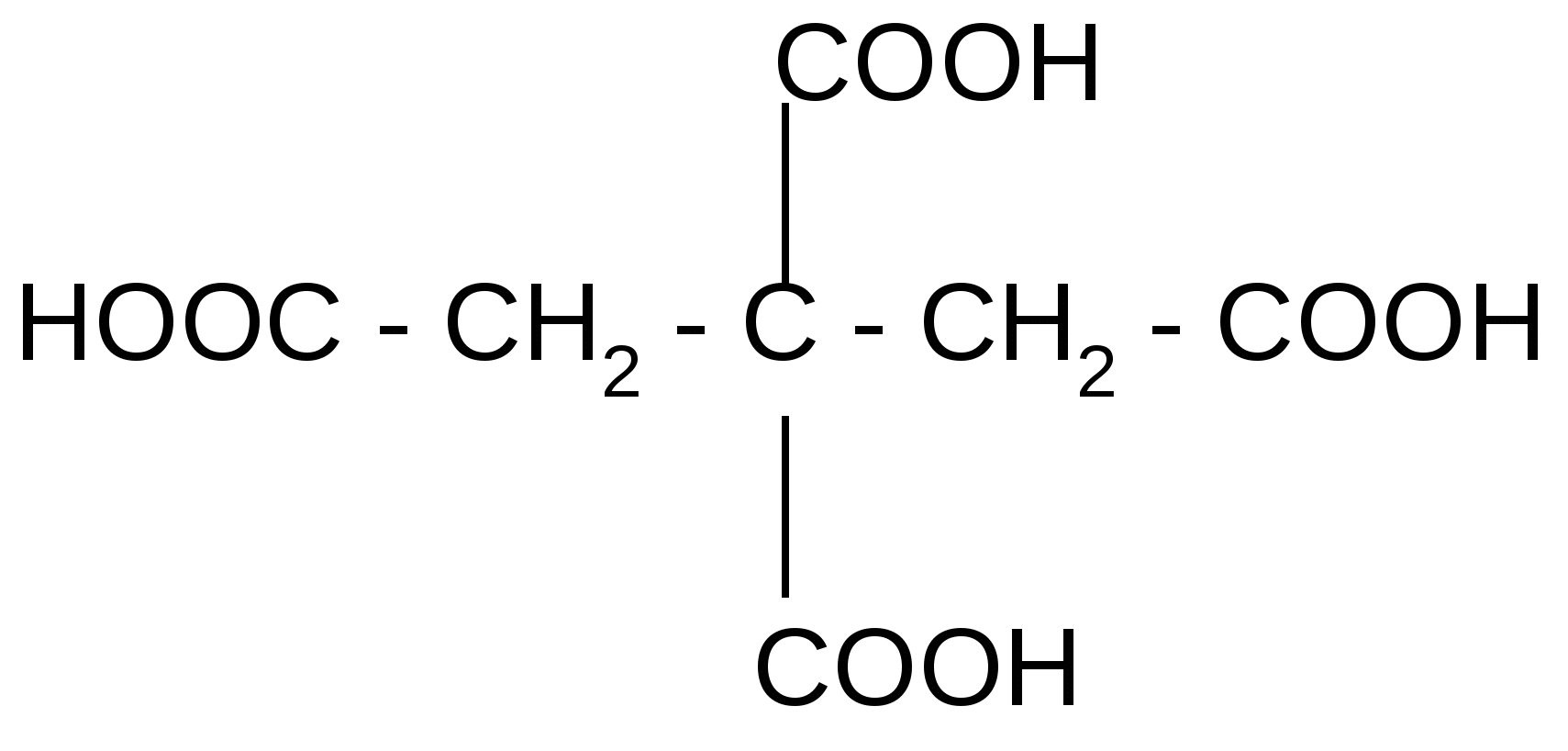
| | Винная (виноградная), или ,-дигидрокси янтарная кислота (тартраты) | 2,3-дигидрокси бутандиовая кислота | 4-х атомная | 2х основная | Содержится в виноградном соке. Является продуктом жизнедеятельности бактерий. Применяется как консервант в пищевой промышленности, в красильном деле. Соли (тартраты) применяются в радиотехнике (пьезокристаллы) и в биохимическом анализе в виде Фелинговой жидкости для обнаружения альдегидов. Существует в трех стереоизомерных формах (L-, D- и мезо-) |
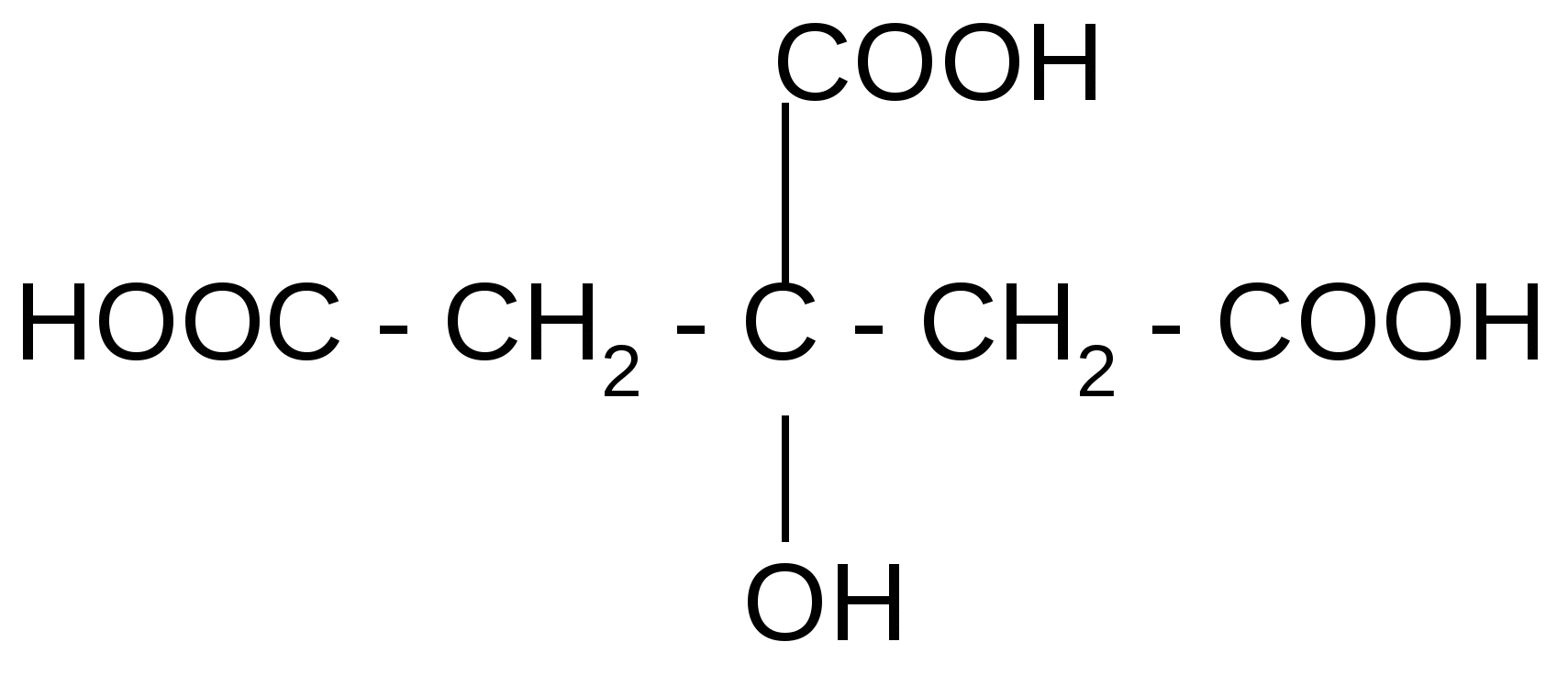 | Лимонная , или -гидрокси--карбокси-глутаровая (цитраты) | 3-гидрокси-3-карбоксипентан диовая | 4-х атомная | 3-х основная | Содержится в лимонах, апельсинах, винограде, в листьях махорки. Играет важную роль в ЦТК. Соли (цитраты) применяются для консервирования донорской крови, соли железа – при малокровии. |
Оксокислоты
Наиболее важные природные оксокислоты представлены в Таблице 3
Химические свойства
I. Они проявляют общие свойства, присущие альдегидам или кетонам и кислотам, но как кислоты они сильнее соответствующих карбоновых кислот (сказывается –I эффект карбонильной группы)
П Специфические свойства, обусловленные взаимным влиянием
>C=O и -COOH групп:
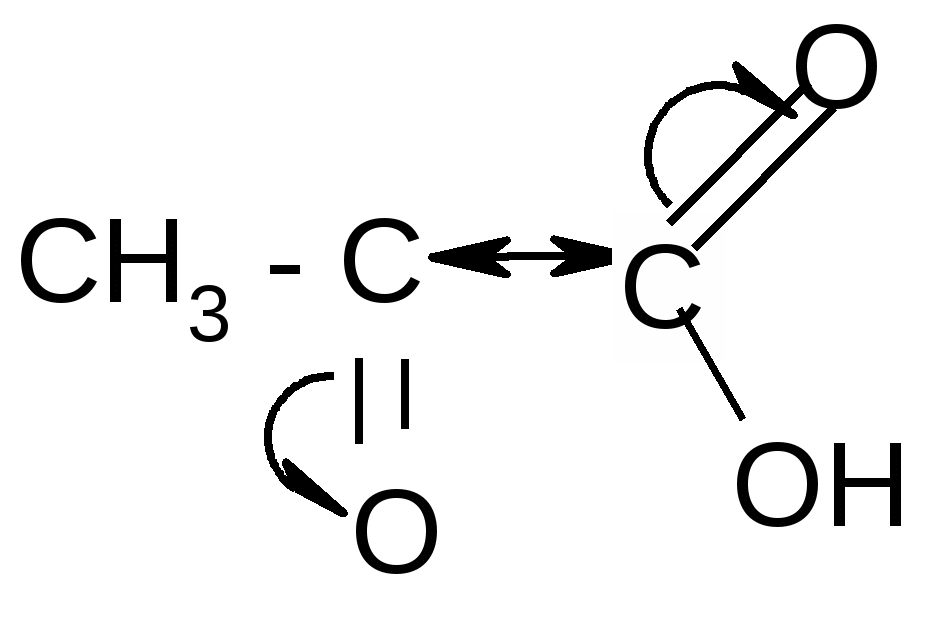
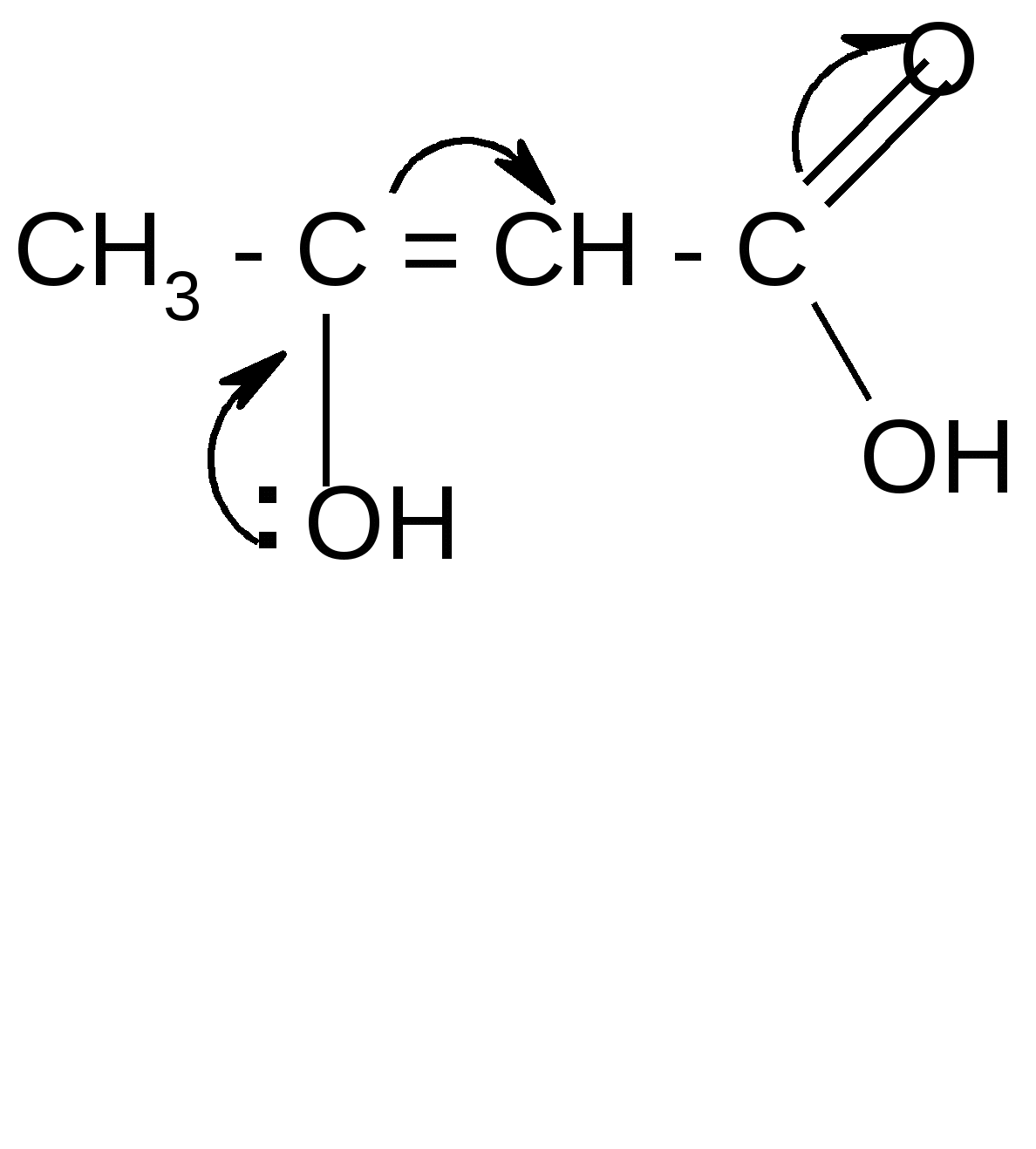
1. Расщепление - и - оксокислот при нагревании – декарбоксилирование:
 ˉ
ˉ а) + CO2
а) + CO2ˉ
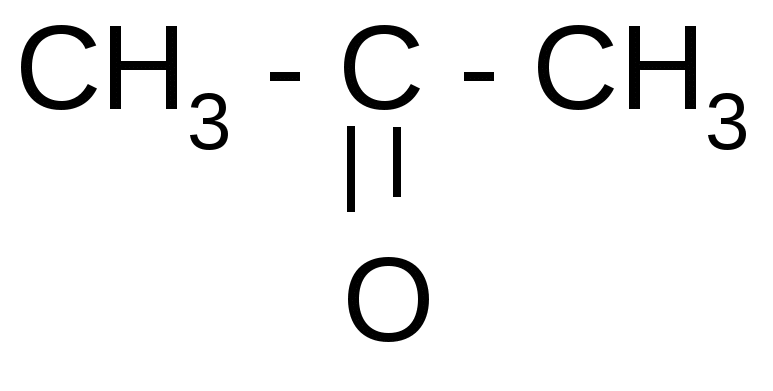 t° комн.
t° комн. 
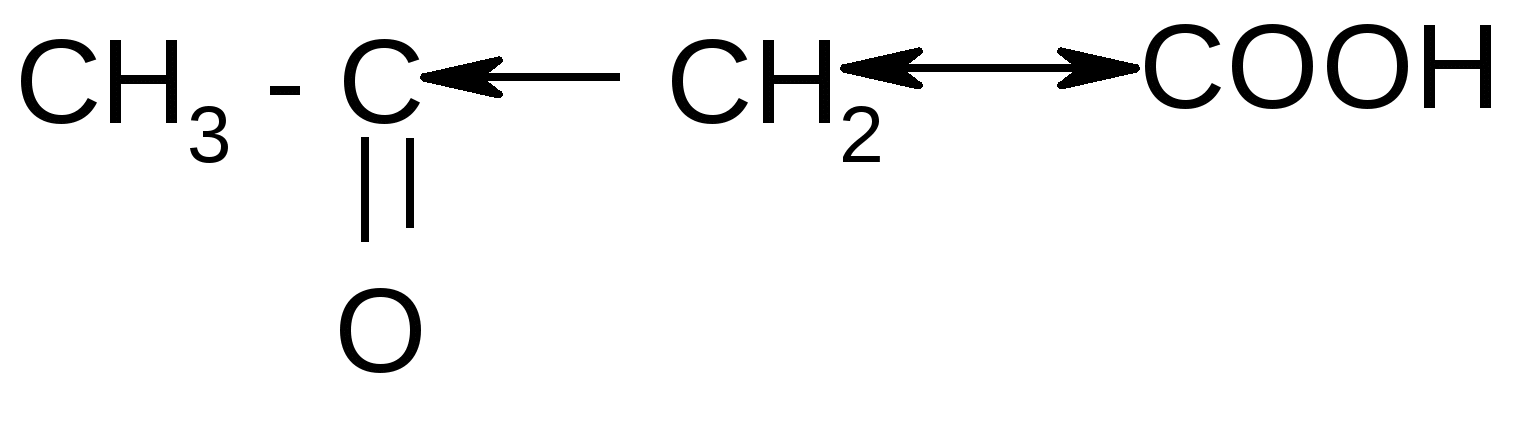 б) + CO2
б) + CO22
 . Кето-енольная таутомерия -оксокислот.
. Кето-енольная таутомерия -оксокислот.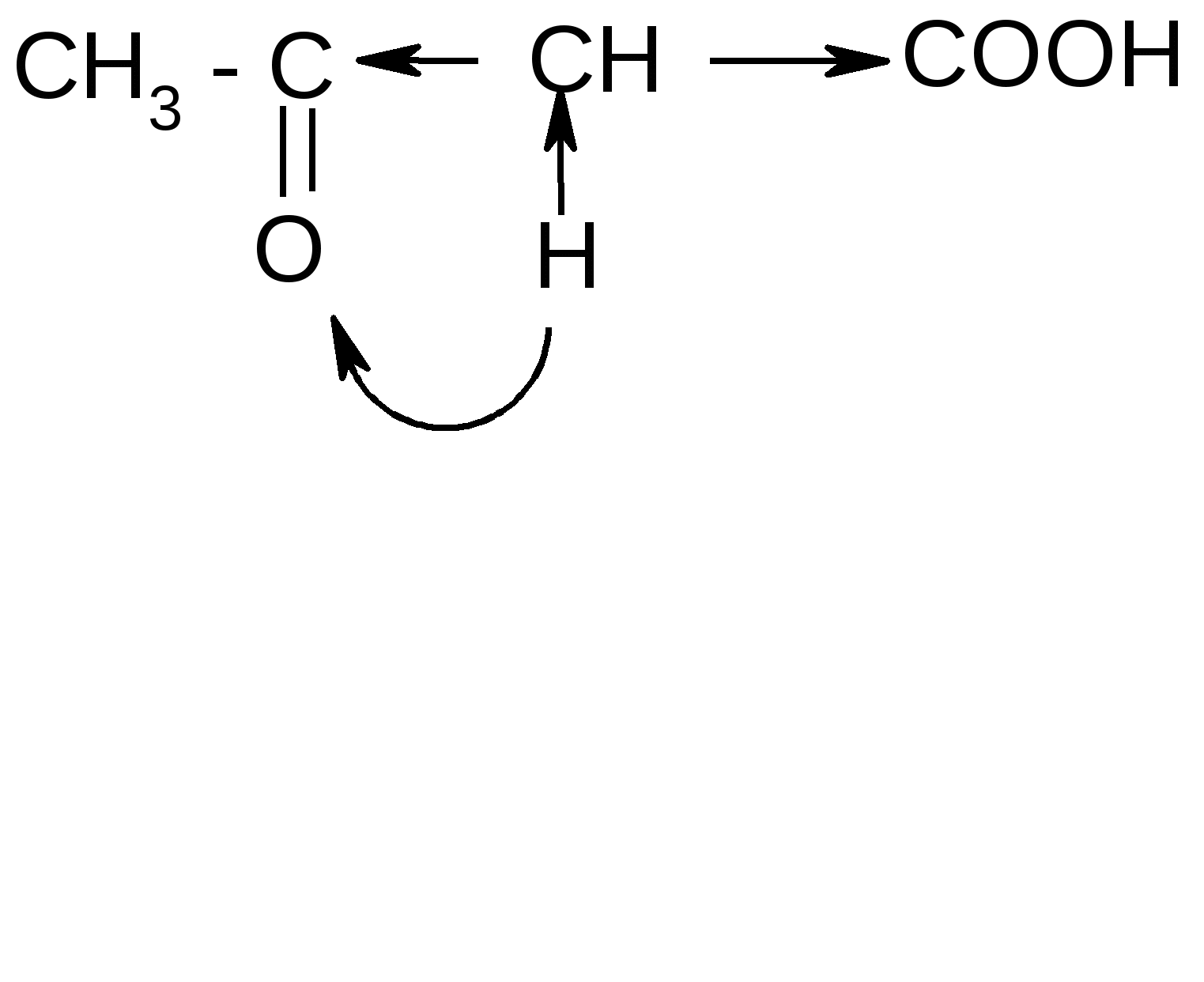 +
+ 

:

 –
– 

 кето-форма енольная форма
кето-форма енольная форма
 ацетоуксусная кислота (АУК)
ацетоуксусная кислота (АУК) Обе формы известны в свободном состоянии и могут быть при определенных условиях выделены. Однако они обе неустойчивы – легко превращаются в равновесную смесь с содержанием кето-формы (93%) и енольной (17%). Стойкость енола по сравнению с другими енольными формами возрастает из-за сопряжения.
Для доказательства существования обеих форм пользуются соответствующими реакциями. Например, как кетон АУК восстанавливается до вторичного спирта, реагирует с HCN, фенилгидразином и т.д. Как енол АУК или ее этиловый эфир (ацетоуксусный эфир) дает окрашивание при действии разбавленного водного раствора FeCl3 вследствие образования комплексной железной соли (хелата):

 родолжение таблицы 2
родолжение таблицы 2