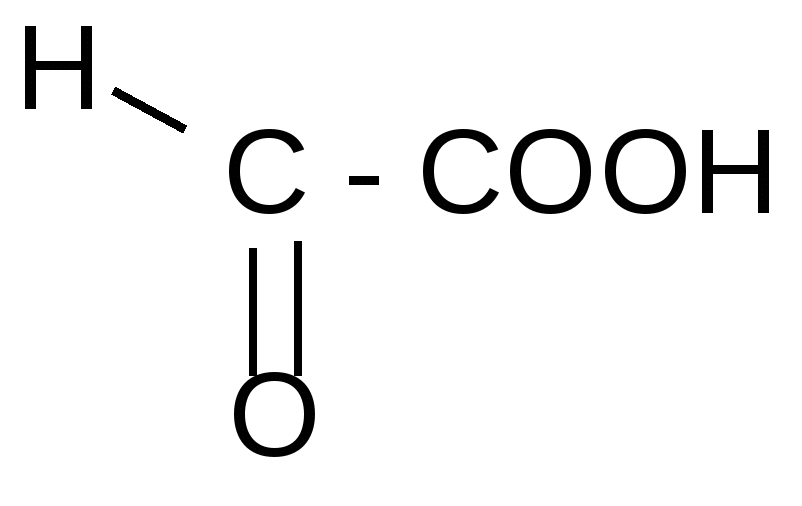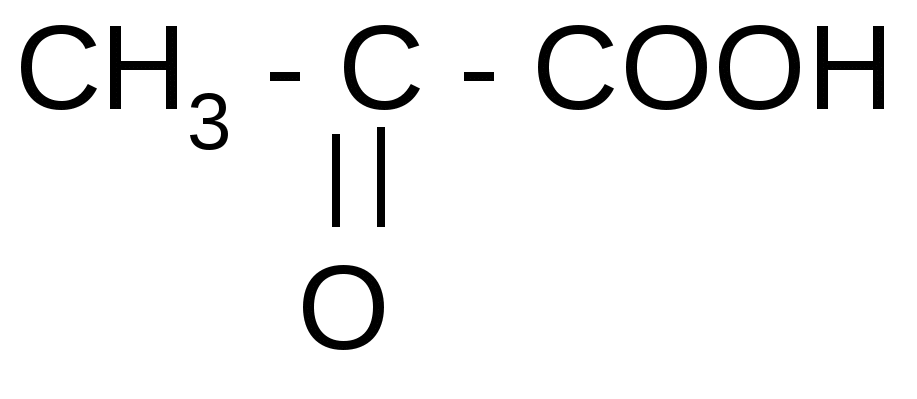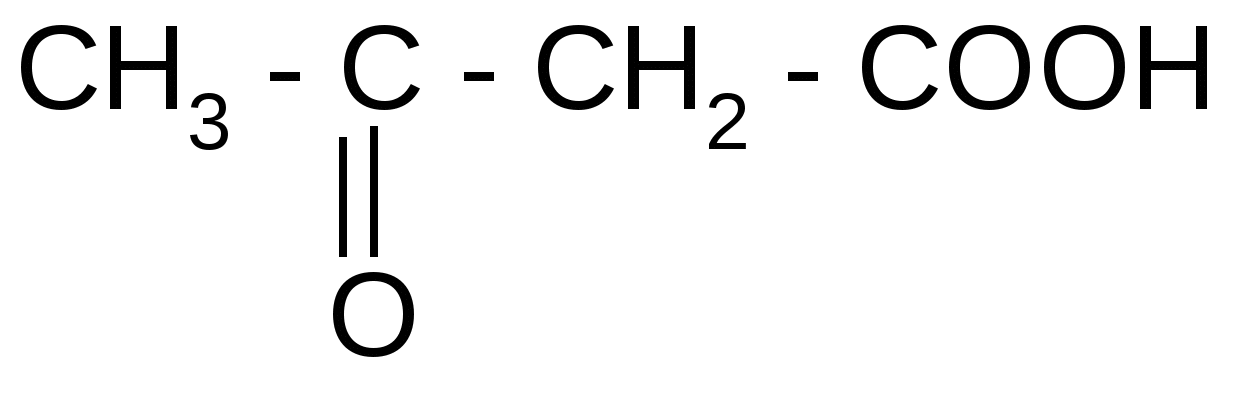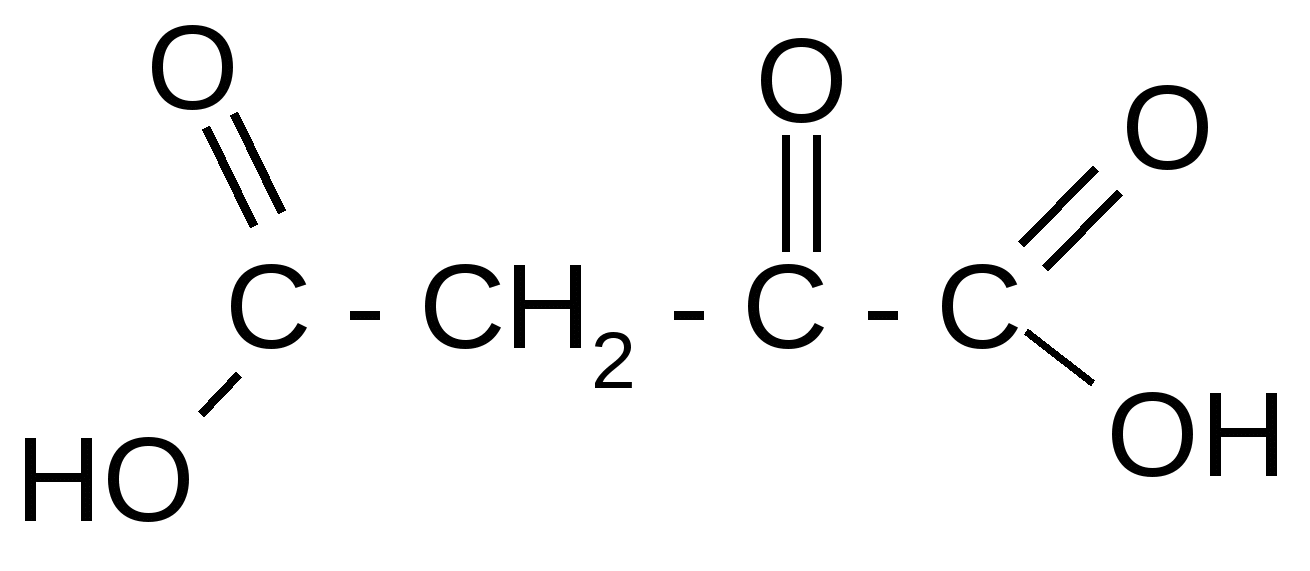Тема Соединения со смешанными функциями Гидроксиальдегиды и гидроксикетоны. Гидрокси и оксокислоты Цель занятия
 Скачать 1.67 Mb. Скачать 1.67 Mb.
|
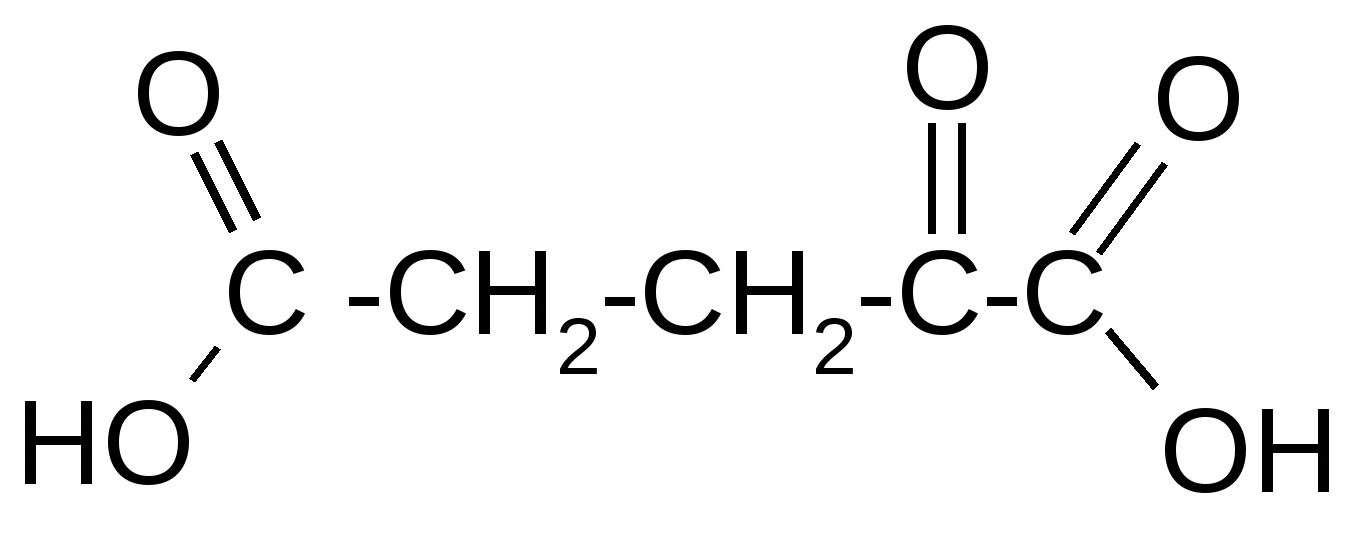
Таблица 3Оксокислоты
Стереоизомерия Стереоизомеры отличаются друг от друга пространственным расположением атомов или групп атомов. Стереоизомеры   Энантиомеры Диастереомеры (оптические,или зеркальные, изомеры) Знание стереоизомерии очень важно для изучения строения природных соединений (биорегуляторов и лекарственных средств – гормонов, витаминов, антибиотиков), так как все они существуют в строго определенных пространственных формах и их биологическая активность тесно связана с пространственным строением. Так, для построения белковой молекулы используется один вид энантиомеров – L– аминокислоты, а в классе углеводов большее распространение имеют D–сахара. Из двух энантиомерных форм гормона адреналина большей фармакологической активностью обладает D(-)–форма. Стереоспецифично протекают многие биохимические реакции, так как они катализируются ферментами – белковыми молекулами. Приведем некоторые примеры значения диастереомерии. Бутендиовая кислота существует в виде двух геометрических изомеров (цис- и транс-), но только один из них – фумаровая кислота (транс–изомер) – служит субстратом для действия фермента. Ретинол с транс–расположением всех двойных связей более эффективен в процессах зрения, чем его цис–изомер. В липиды клеточных мембран в качестве структурных составляющих входят также только цис-формы высших жирных кислот. Энантиомерия осуществляется у так называемых «хиральных» молекул. Хиральными, или асимметрическими, молекулами называются те, которые не могут быть совмещены со своим зеркальным отражением; у них отсутствует плоскость симметрии:   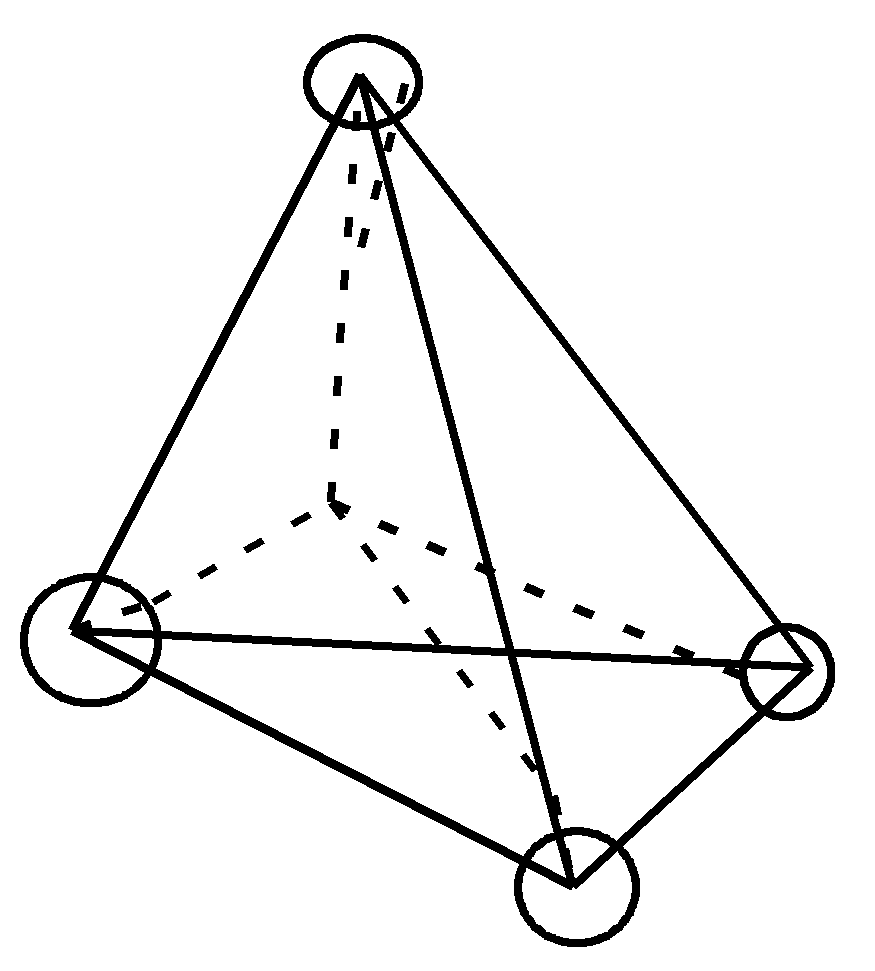 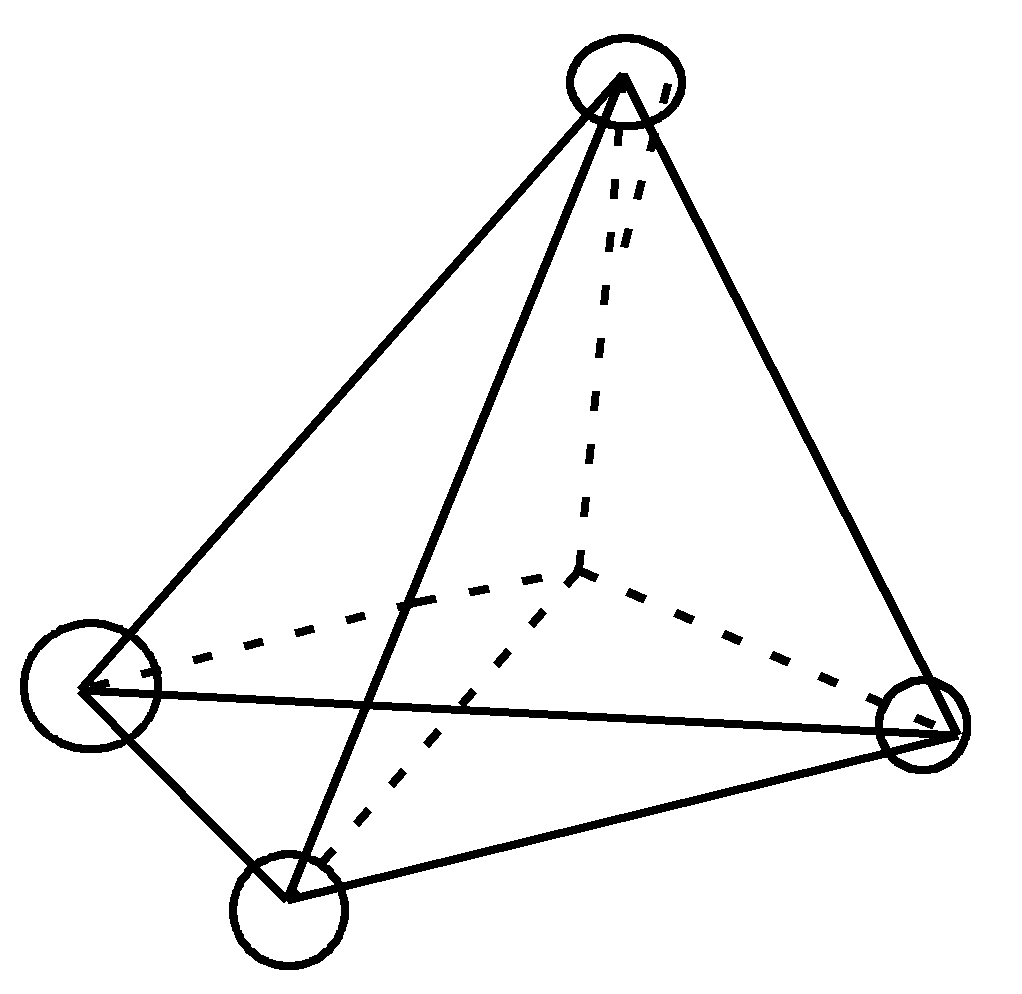    Термин «хиральность» произошел от греческого слова «хиро» – рука. Самым простым наглядным примером хиральных объектов являются правая и левая руки. Атом углерод с четырьмя различными группами называется асимметрическим, или хиральным, центром. Для изображения энантиомеров на плоскости используются проекционные формулы Фишера, называемые проекциями Фишера: 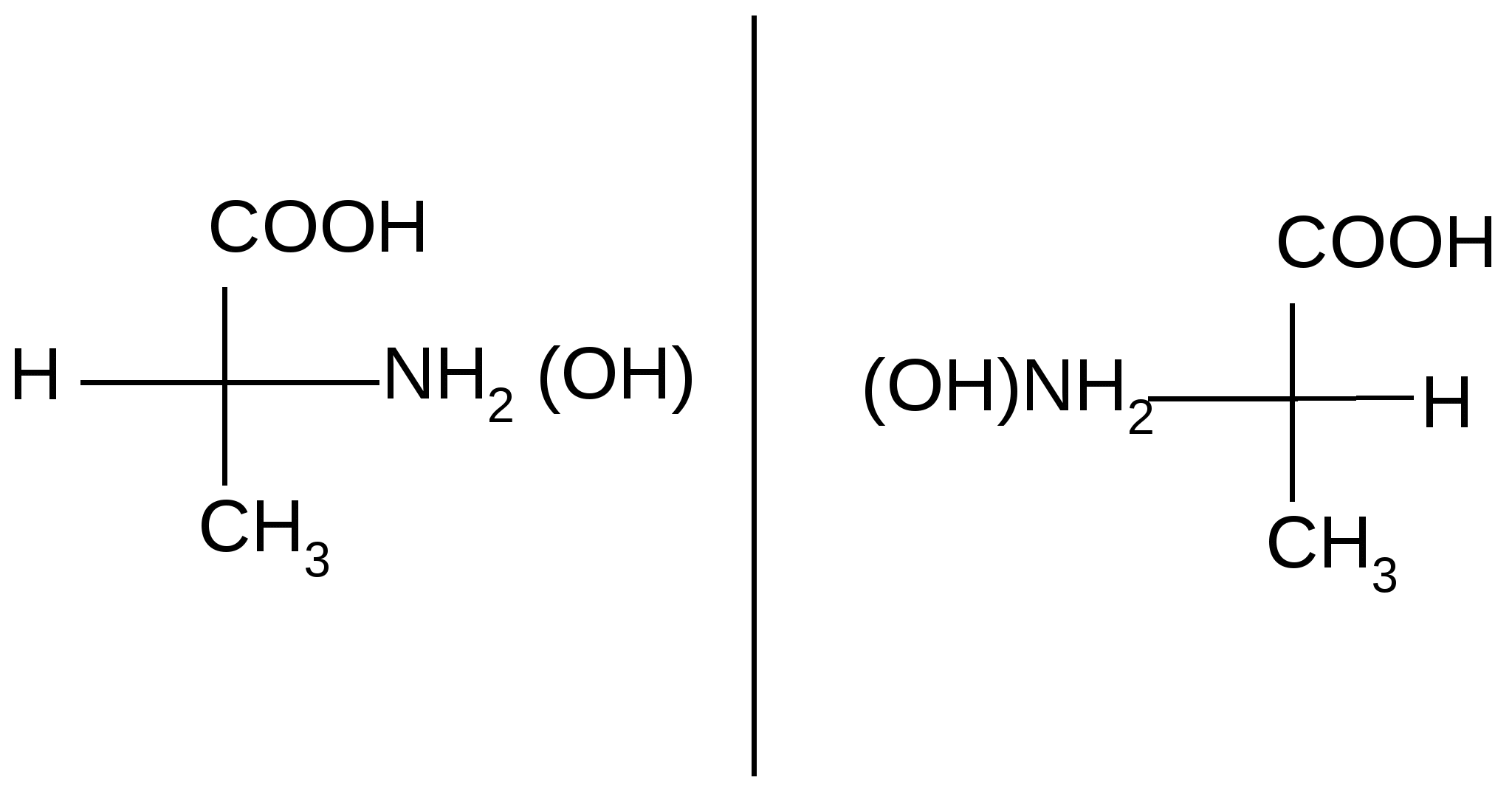 |