А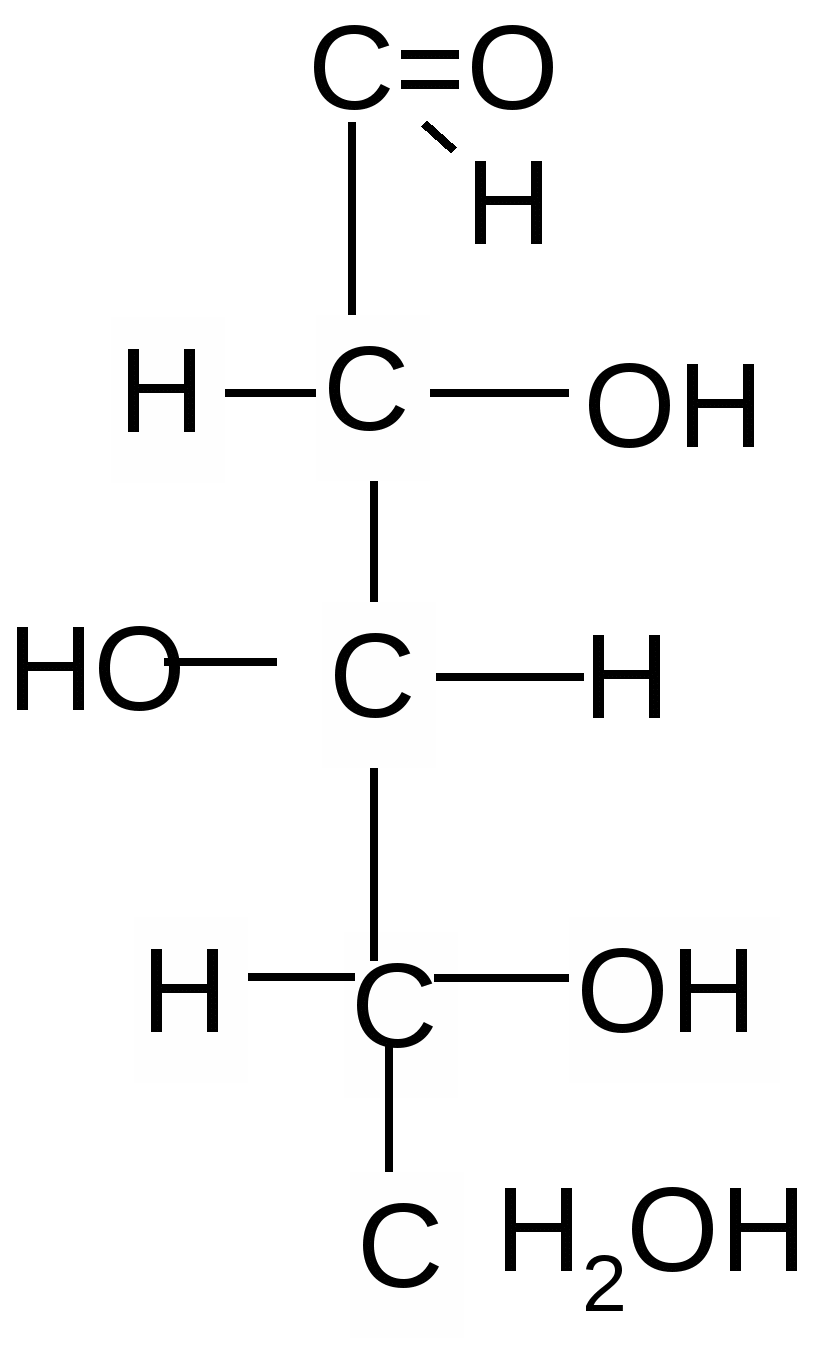 льдопентозы льдопентозы
*
*
*
D-рибоза 2–дезокси-D–рибоза D–ксилоза
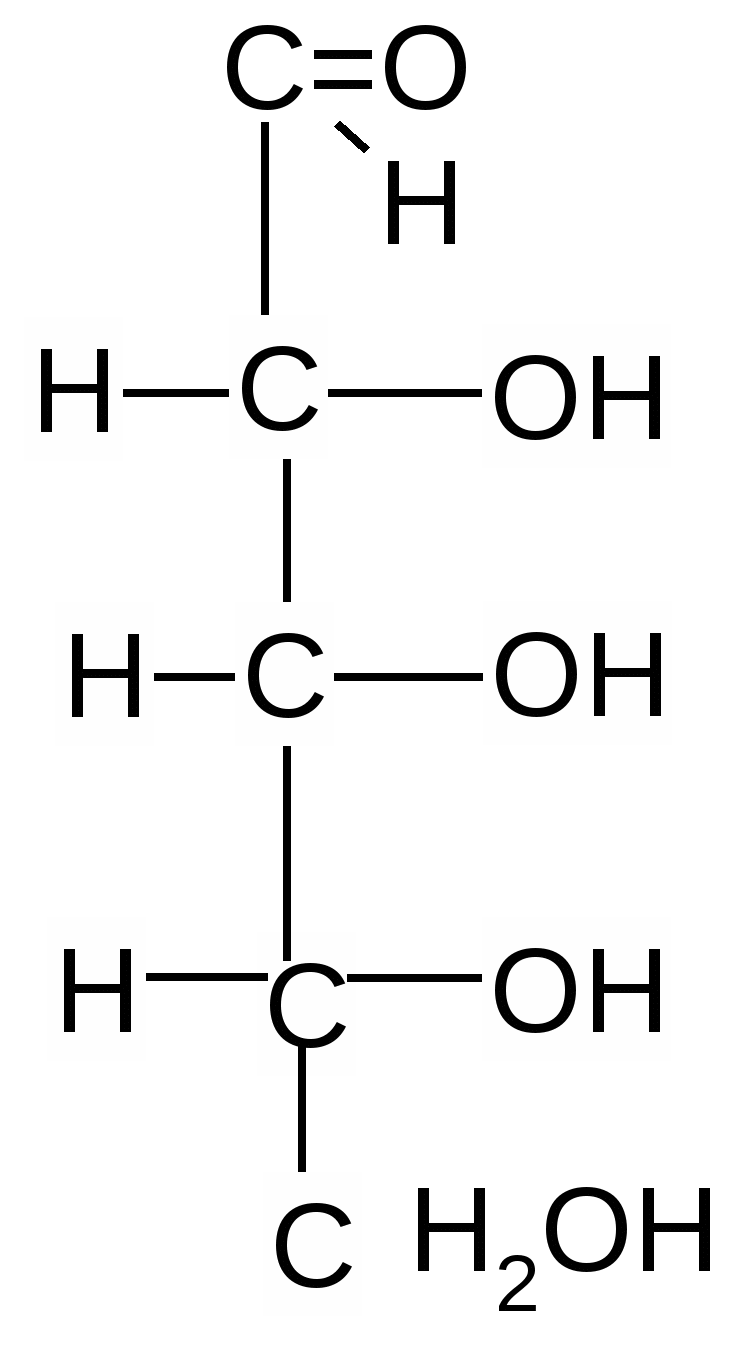
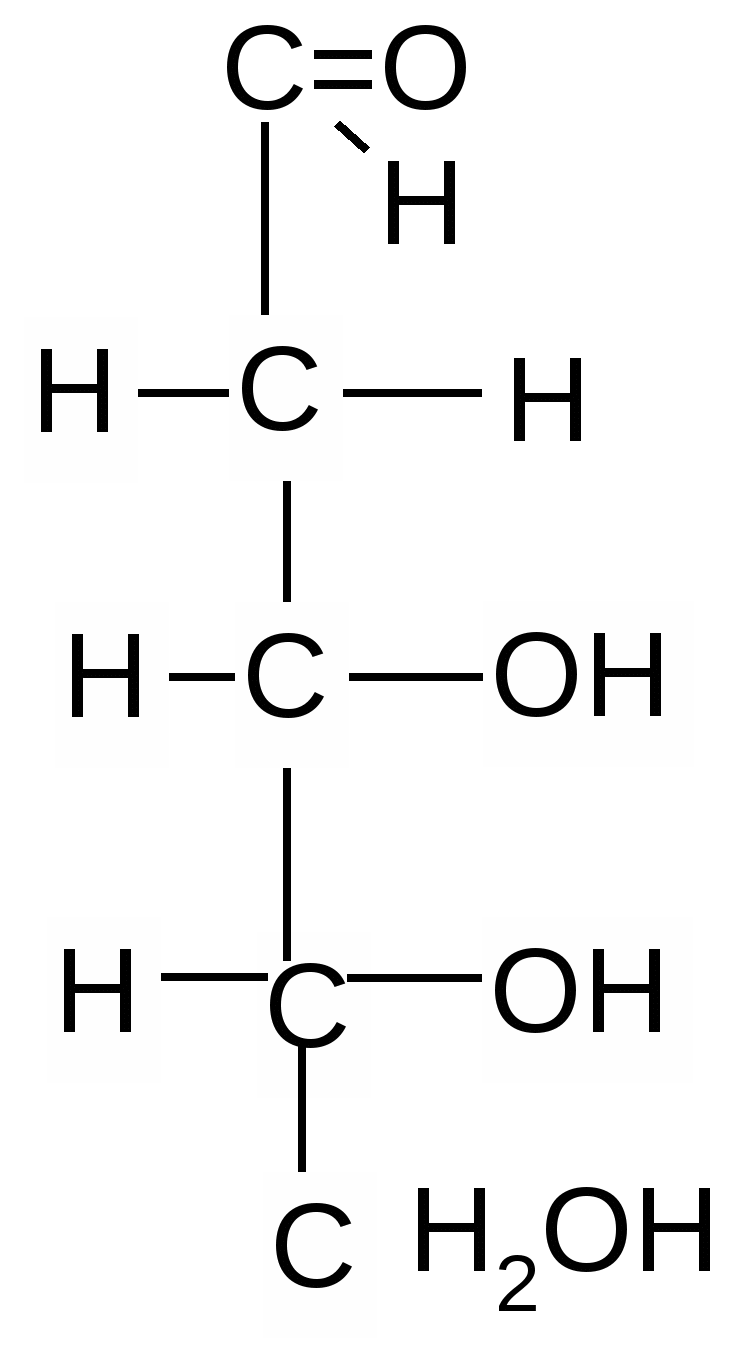
Альдогексозы Кетогексоза
  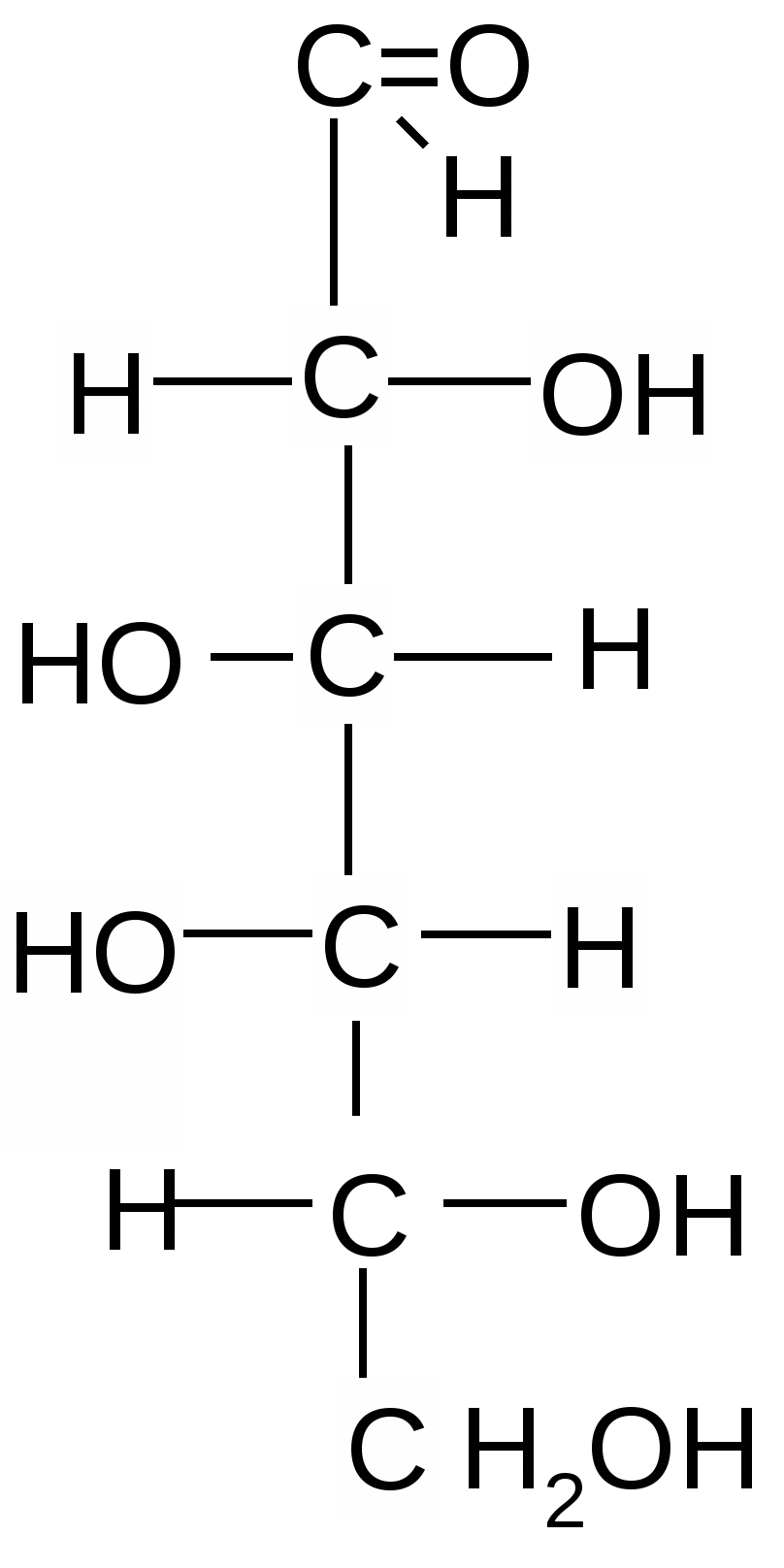 
D- глюкоза D-манноза D-галактоза D-фруктоза
Кроме перечисленных выше пентоз и гексоз существуют и их пространственные изомеры, общее число которых вычисляется по формуле N=2n , где n – число асимметрических атомов углерода. Так, число возможных альдопентоз, стереоизомеров D-рибозы, составляет N=23 =8 , т.к. в этой молекуле 3 асимметрических атома углерода (см. формулу выше).
Например:
1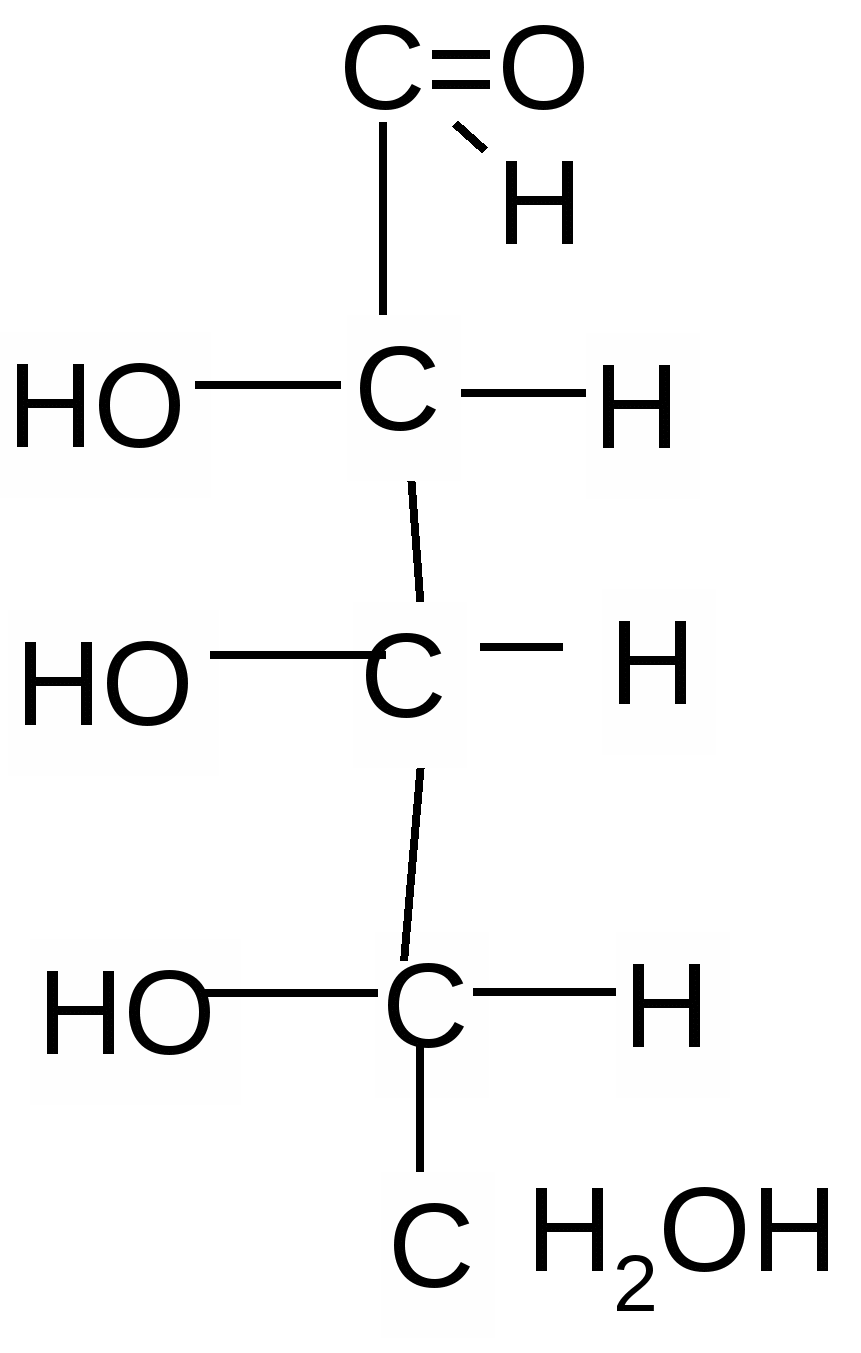  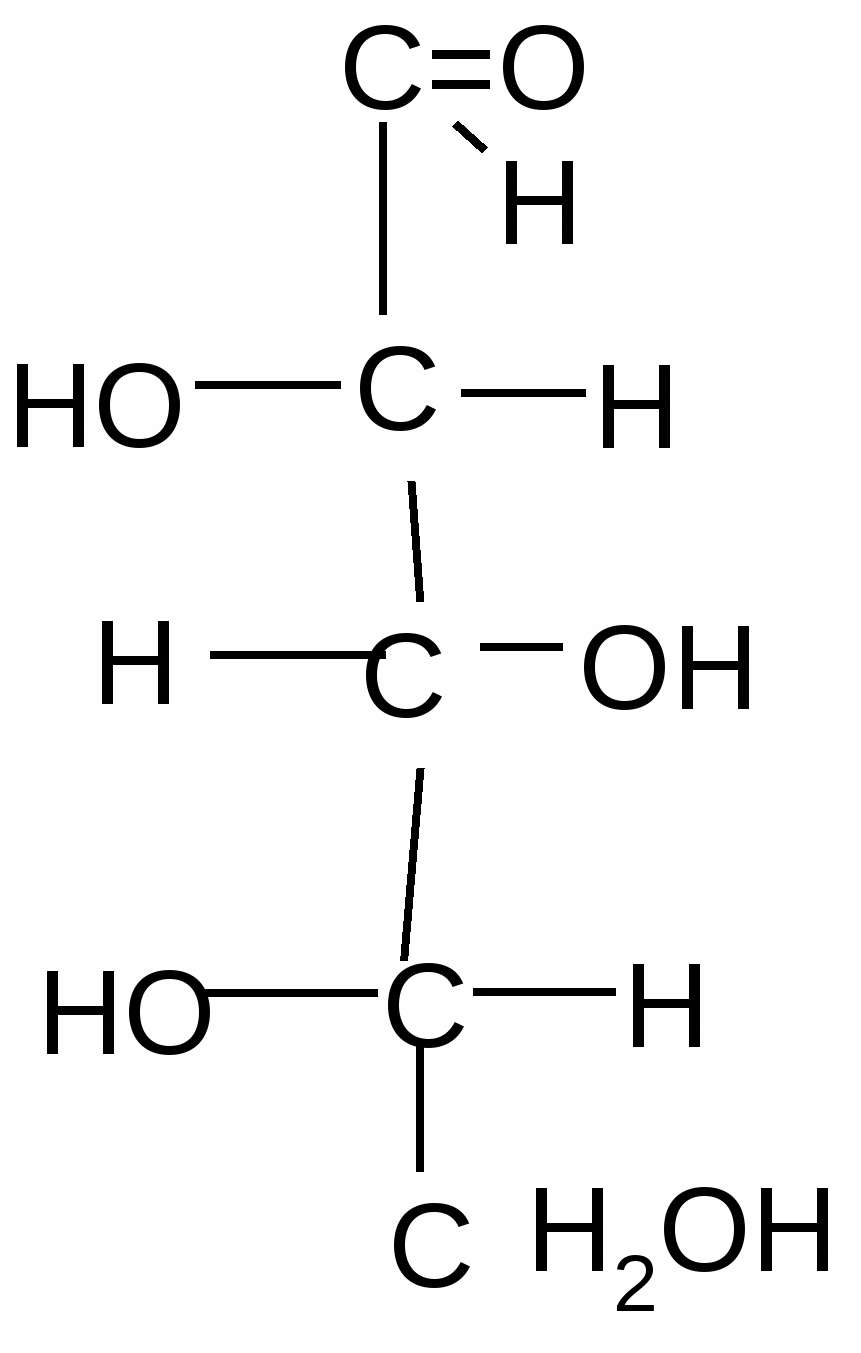 . 2. 3. 4. . 2. 3. 4.

D-рибоза L-рибоза D-ксилоза L–ксилоза
1 и 2, 3 и 4 – это энантиомеры; 1 и 3; 1 и 4; 2 и 3; 2 и 4 – диастереомеры.
Напишите формулы недостающих стереоизомеров D–рибозы. Выделите среди них энантио - и диастереомеры. (см. раздел «Стереоизомерия»)
В природе наиболее распространены углеводы D–ряда. Из природных моносахаридов L-ряда выделены: L-арабиноза (свекла), L-рамноза (растительные гликозиды), L-фукоза (пентозаны).
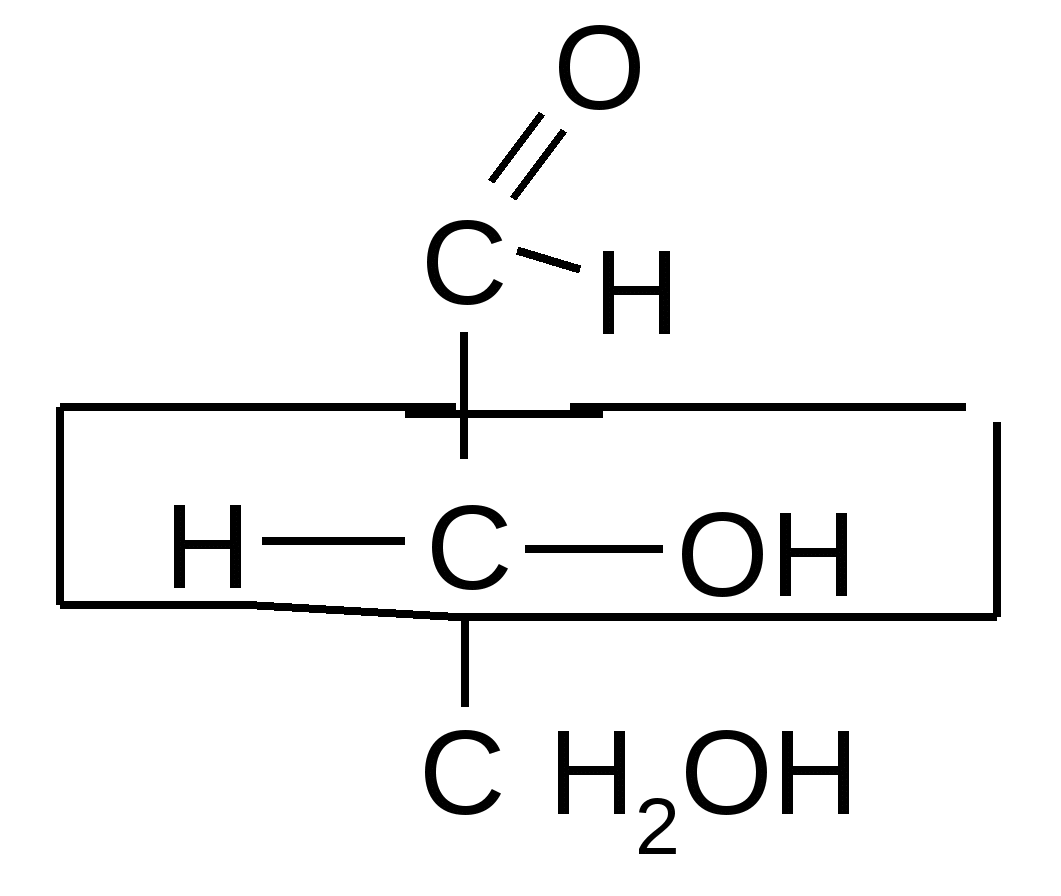
Принадлежность моносахарида к L- или D- ряду определяется по конфигурации его нижнего хирального атома углерода. Эта конфигурация остается без изменения при переходе от эталонного соединения - глицеринового альдегида с помощью оксинитрильного синтеза Килиани–Фишера.
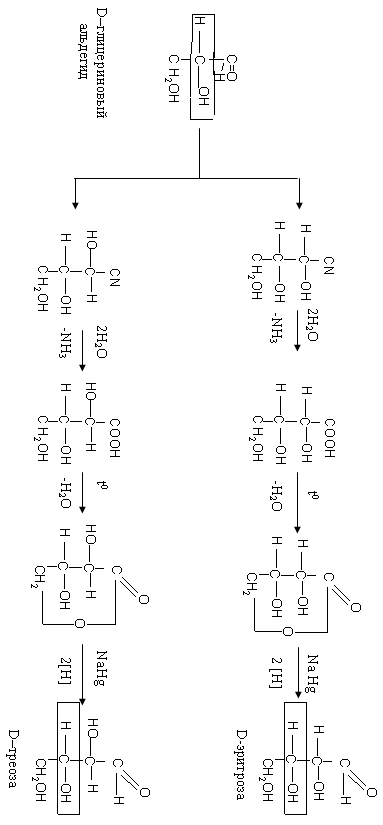
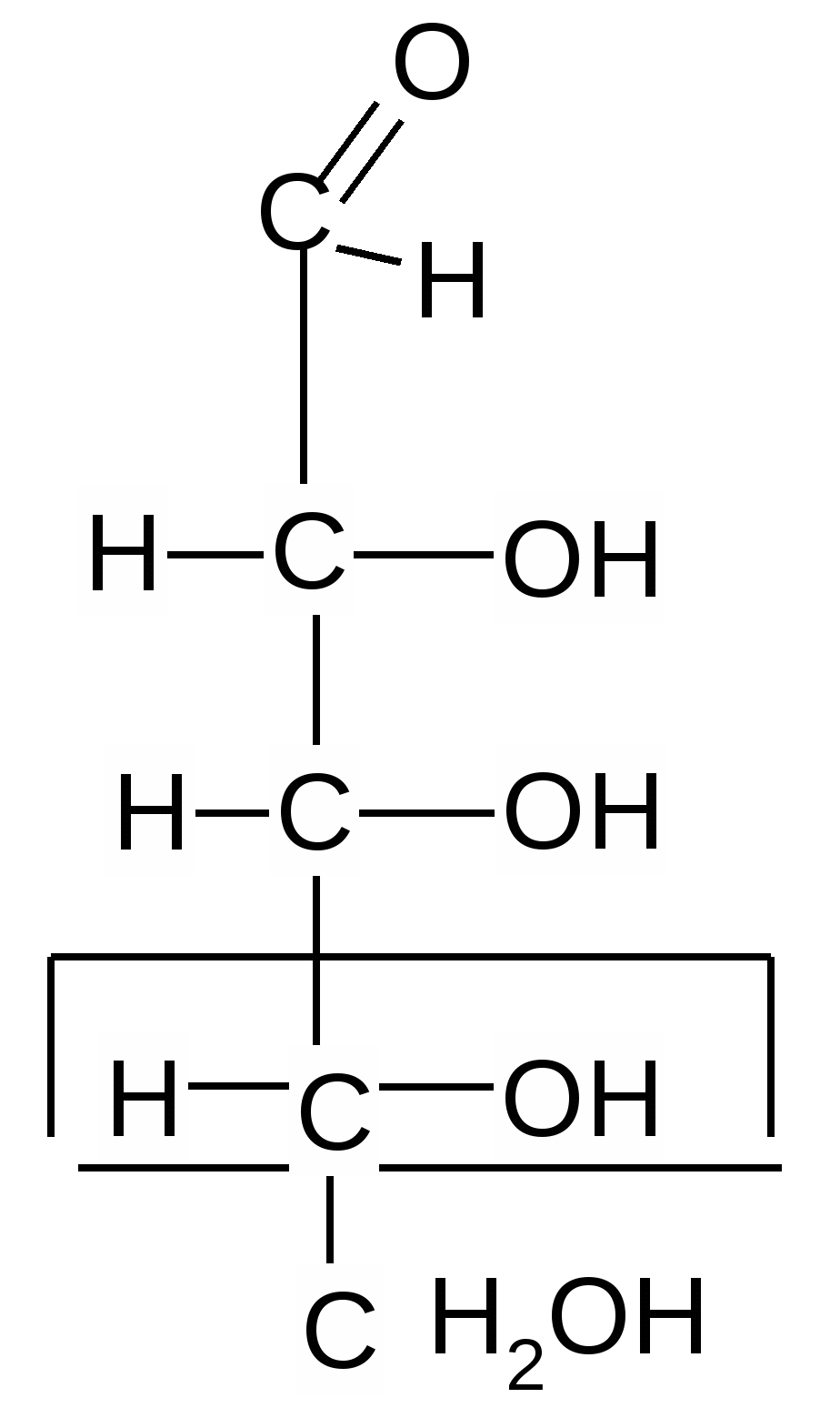
Сравнивая конфигурацию нижнего хирального центра углевода с конфигурацией глицеринового альдегида, определяют стереохимический ряд: L- или D-.
 * *
*
* *
D-глицериновый D-рибоза
альдегид
Отнесите написанные вами стереоизомеры D–рибозы к D- или L– рядам.
Цикло-цепные таутомеры моносахаридов
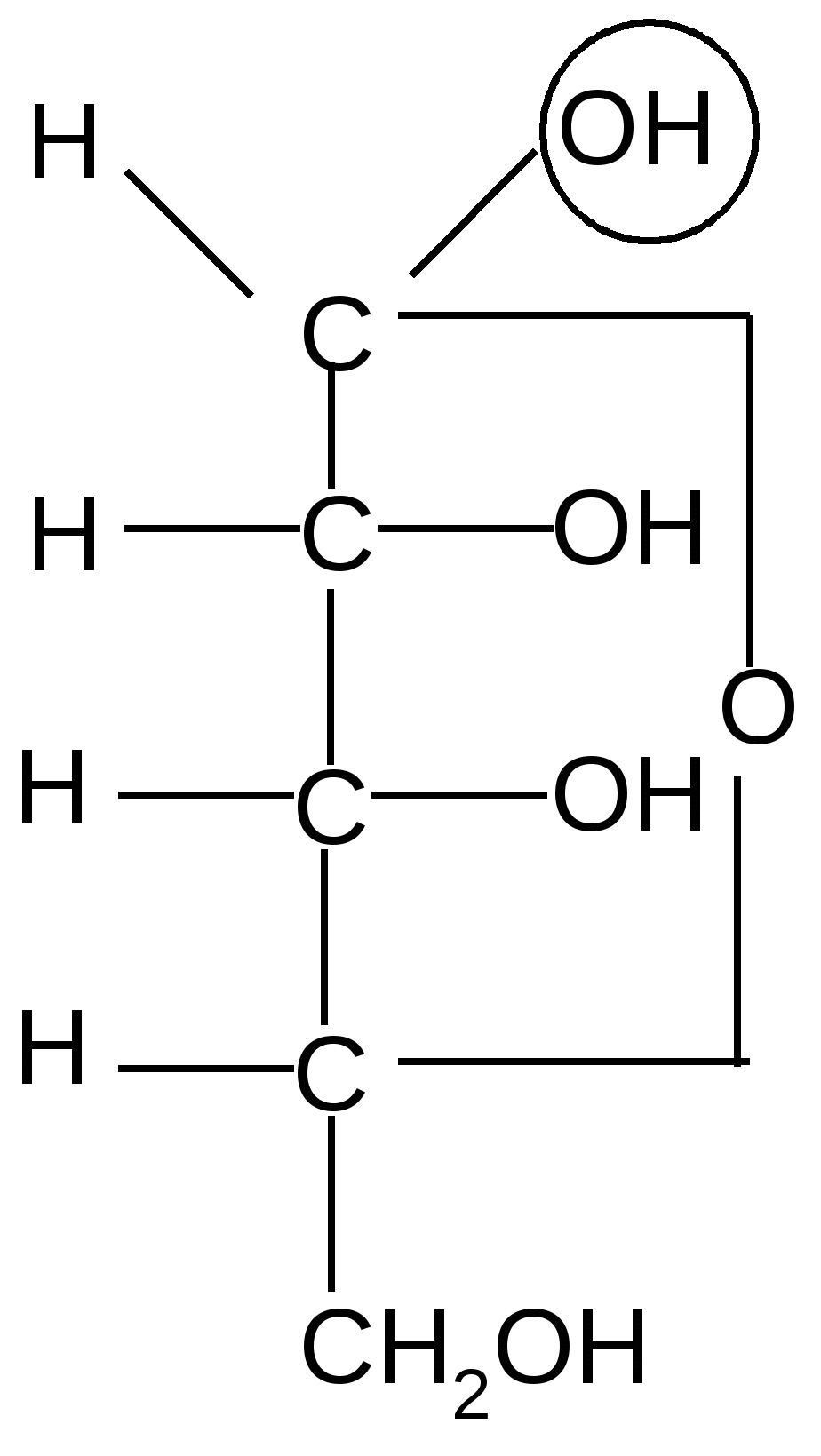
По мере изучения свойств моносахаридов выяснилось, что открытые (цепные) формулы не описывают полностью химическое поведение сахаров. Например, несмотря на наличие в молекуле глюкозы пяти ОН– групп, только одна из них вступает в реакцию со спиртами в присутствии сухого хлористого водорода с образованием гликозидов. Для объяснения подобных противоречий было высказано предположение (1870 г. А. Колли; 1883 г. Б. Толленс), что истинное строение моноз не описывается лишь открытой (цепной) формулой. Моносахариды образуют в водном растворе таутомерные смеси открытых и циклических форм. В основе их образования лежит внутримолекулярная реакция нуклеофильного присоединения спиртовых групп к альдегидной или кетонной группе:
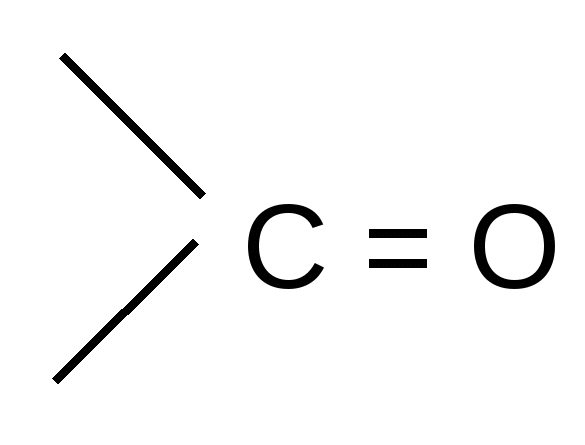 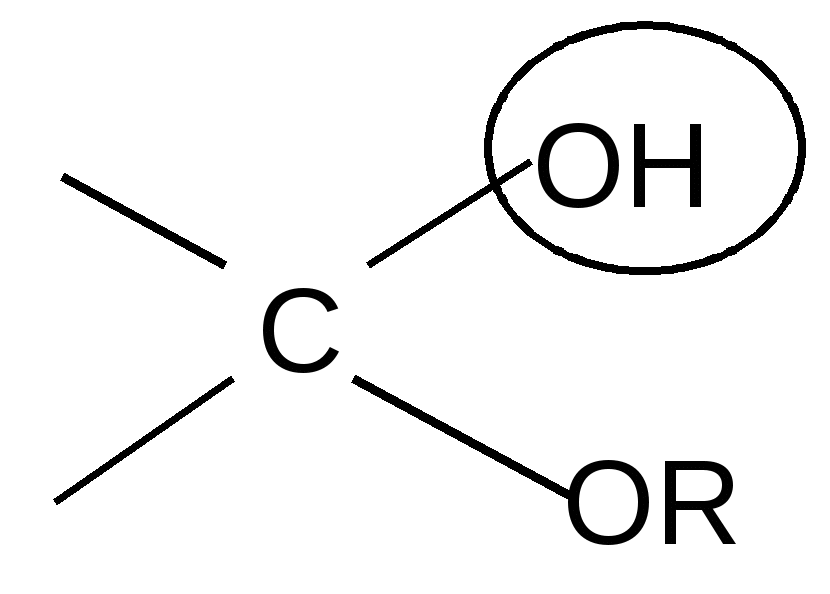
H+ полуацетальный,
     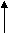 + HOR или гликозидный + HOR или гликозидный
    гидроксил гидроксил
 
полуацеталь
Т
акой реакции способствует клешневидноя конформация углеродной цепи углевода:
В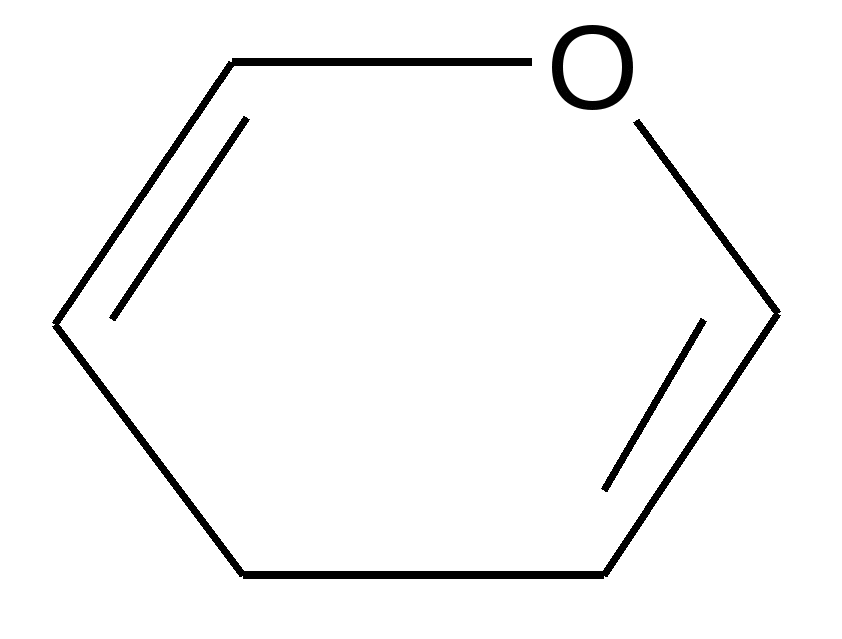 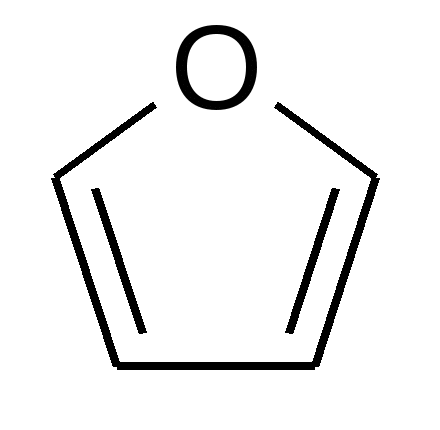 1925–30 гг. У. Хеуорс экспериментально определил размер возможных циклических таутомеров. Он предложил называть пятичленные циклы углеводов фуранозами, а шестичленные – пиранозами как производные фурана и пирана, соответственно: 1925–30 гг. У. Хеуорс экспериментально определил размер возможных циклических таутомеров. Он предложил называть пятичленные циклы углеводов фуранозами, а шестичленные – пиранозами как производные фурана и пирана, соответственно:
фуран пиран
Пример. Изобразите цикло-цепные таутомеры D-рибозы по Фишеру и Хеуорсу.
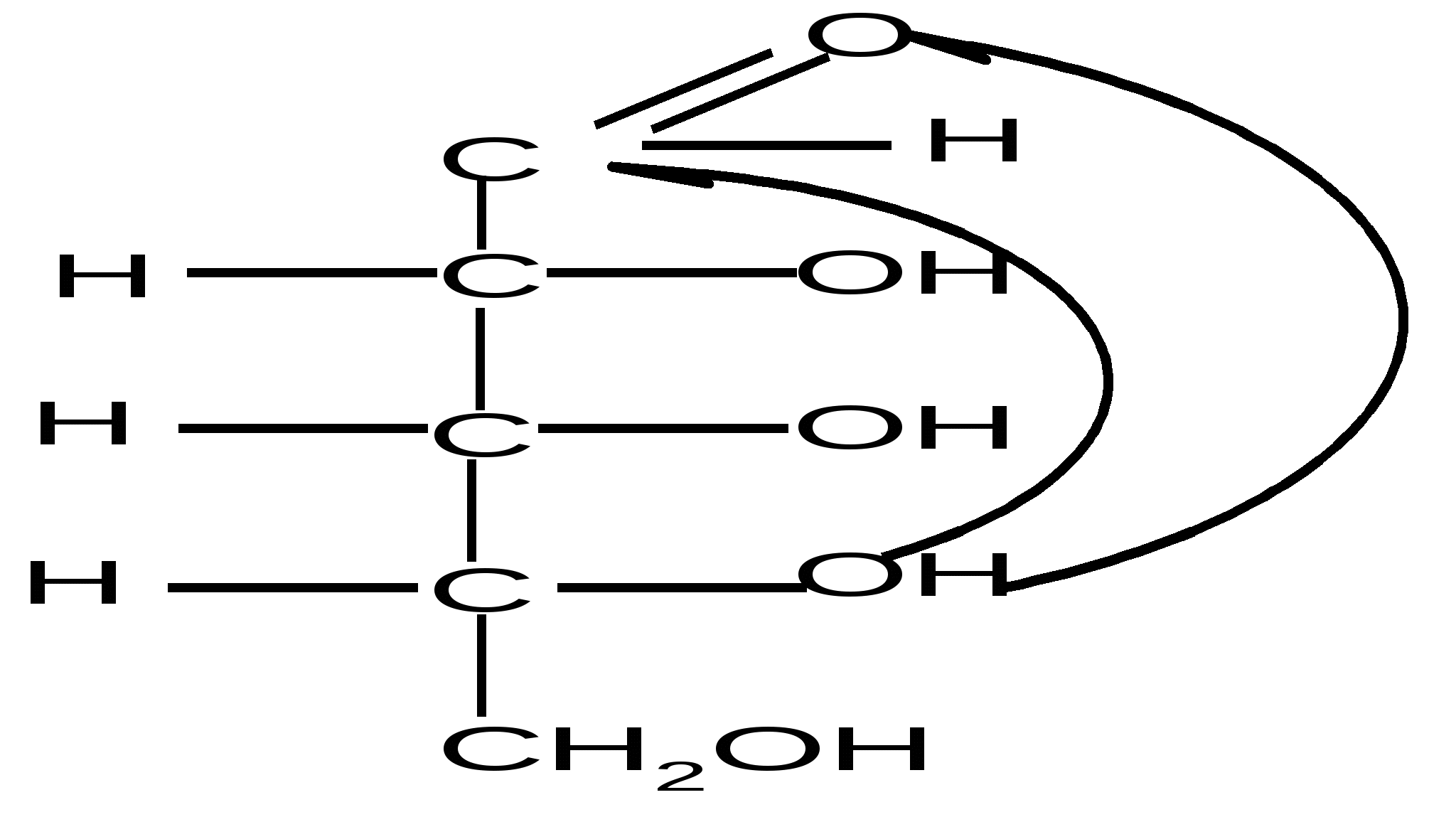
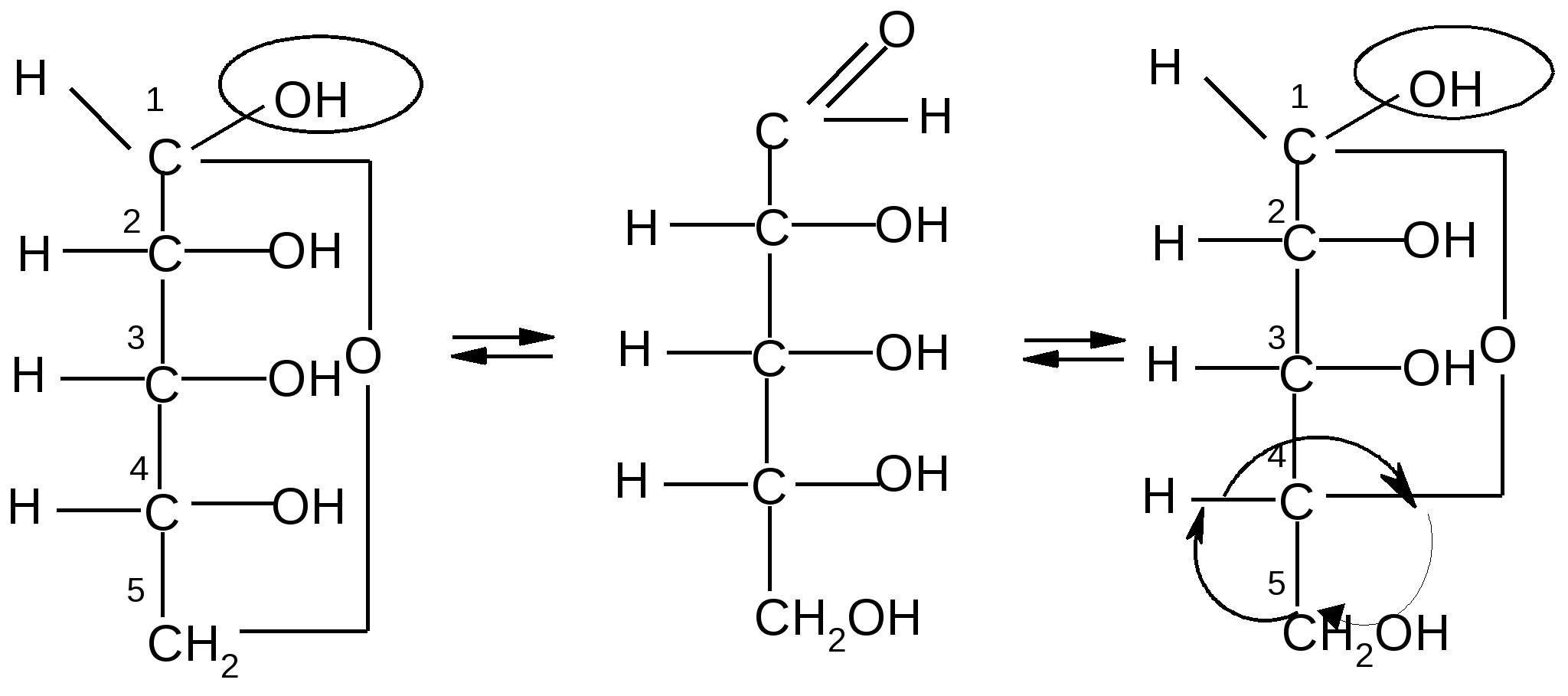
Пиранозные формы рибозы образуются путем взаимодействия гидроксильной группы при С5 рибозы с альдегидной группой:
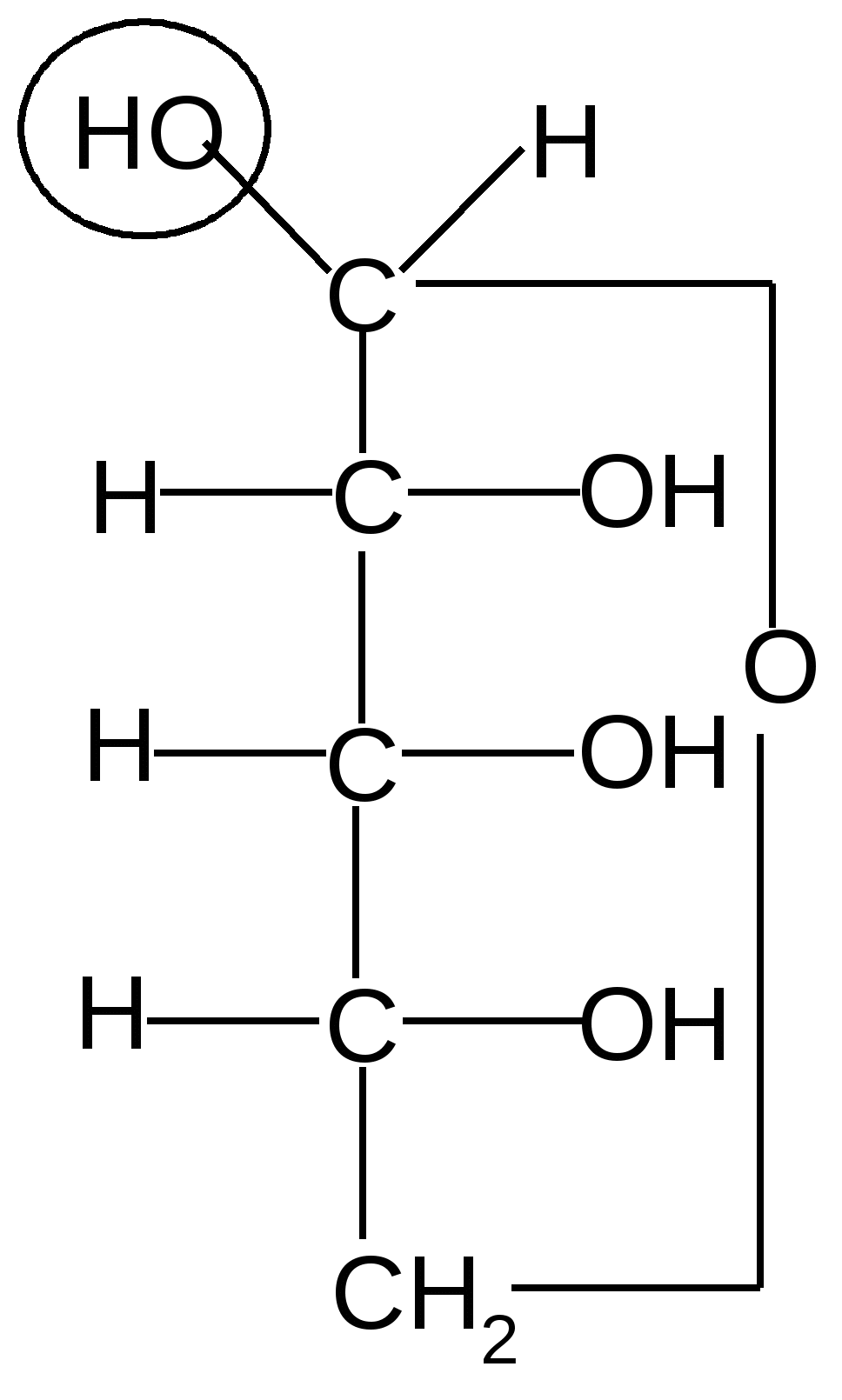    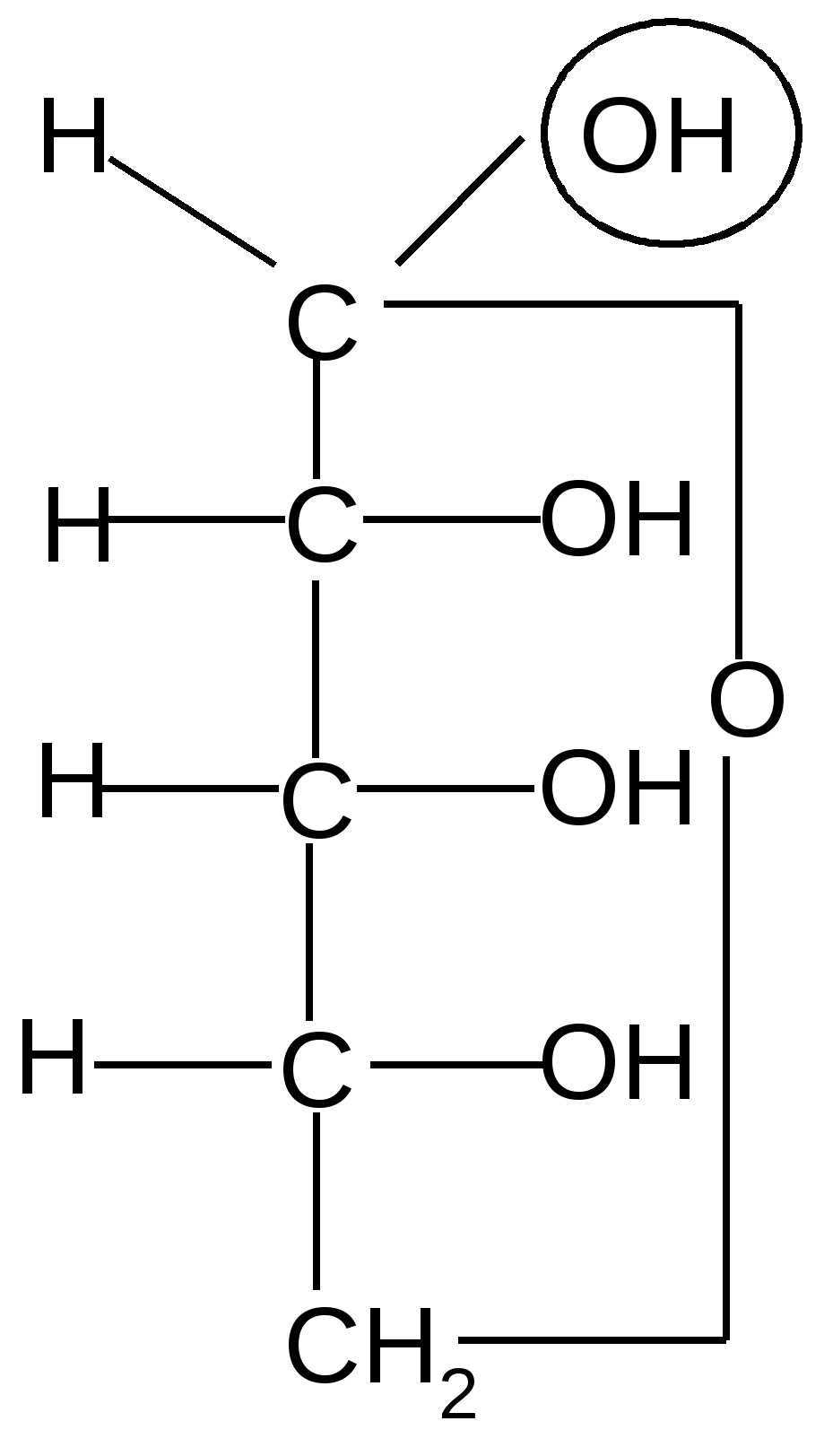 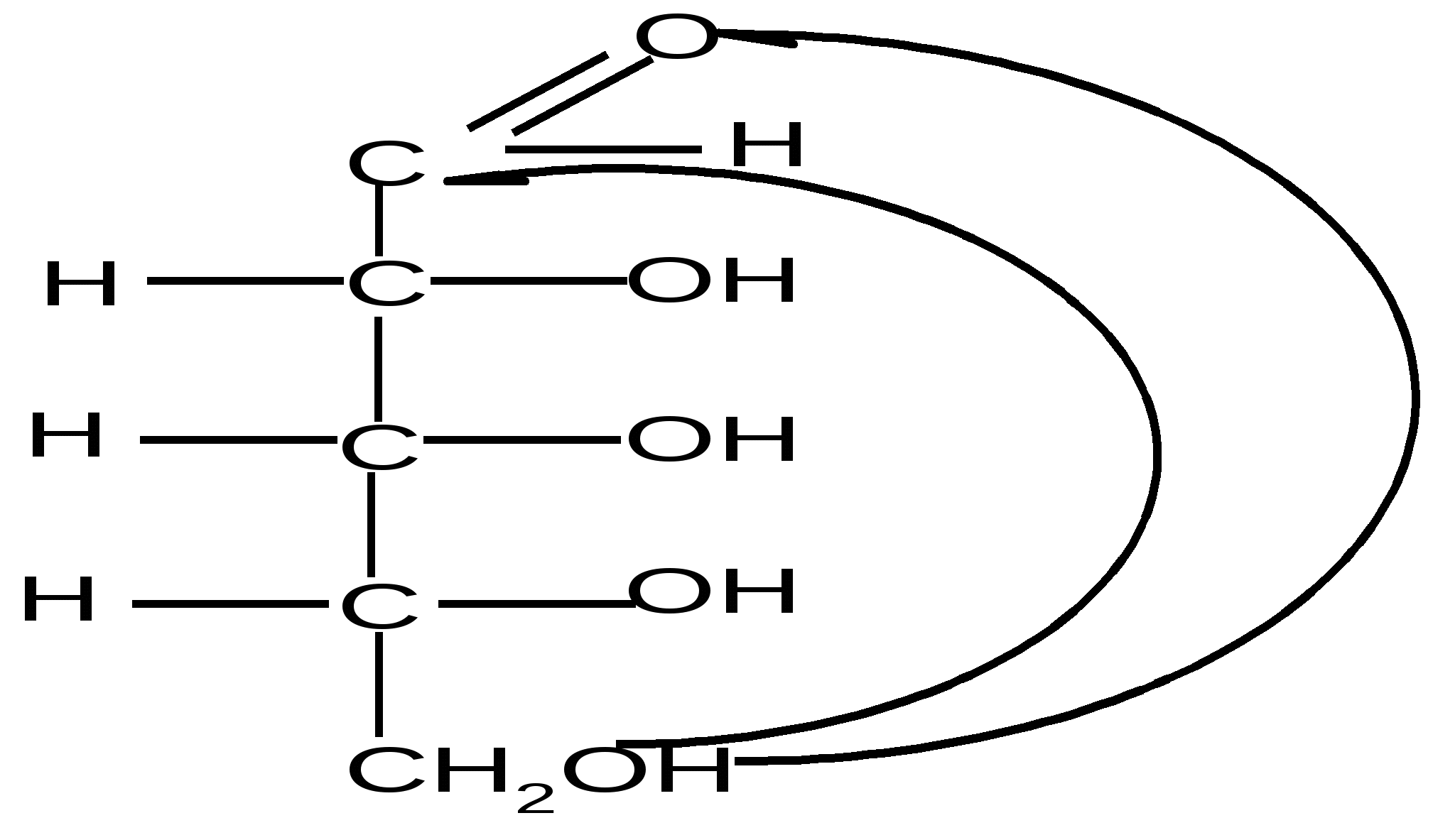
 ,D–рибопираноза D–рибоза ,D–рибопираноза ,D–рибопираноза D–рибоза ,D–рибопираноза
Образование циклической полуацетальной формы приводит к появлению нового хирального центра у первого атома углерода, в результате при такой циклизации получаются два диастереомера, которые отличаются конфигурацией только С1 атома и называются - и -аномерами. В - форме полуацетальный (гликозидный) гидроксил справа от углеродной цепи молекулы; он расположен с той же стороны, что и гидроксил, определяющий принадлежность углевода к D-ряду. В -форме эта группа с противоположной стороны, слева.
Аналогично, только с участием гидроксила при атоме С4, происходит образование фуранозных форм D-рибозы:
    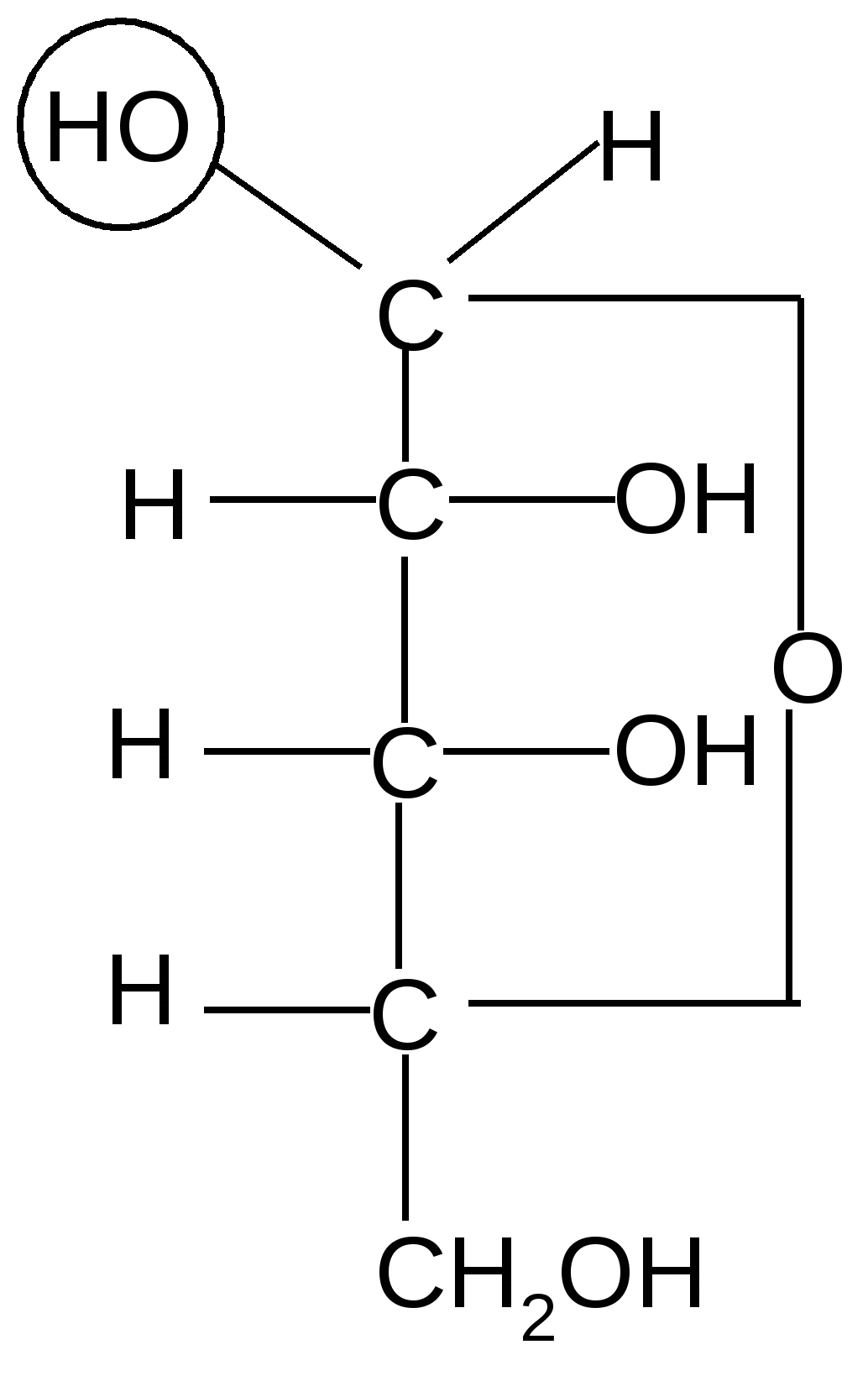  
,D–рибофураноза D–рибоза ,D–рибофураноза
Перспективные формулы Хеуорса
Недостатком проекционных формул Фишера является их несоответствие истинной геометрии молекулы. Поэтому для циклических таутомеров были введены формулы Хеуорса, которые строятся по следующим правилам:
1. Написать формулу Фишера для цепной формы углевода.
2. Написать формулу для циклической таутомерной формы и пронумеровать атомы углерода в ней.
,D–рибопираноза D–рибоза ,D–рибофураноза
(циклическая форма) (открытая форма) (циклическая форма)
Н
арисовать необходимый цикл (5- или 6-членный) с атомом кислорода в правом верхнем углу и пронумеровать атомы углерода, связанные с кислородом, по часовой стрелке (см. рисунок)
4. Заместители, стоящие справа от цепи в проекции Фишера, располагают снизу от плоскости цикла, а стоящие слева – сверху.
И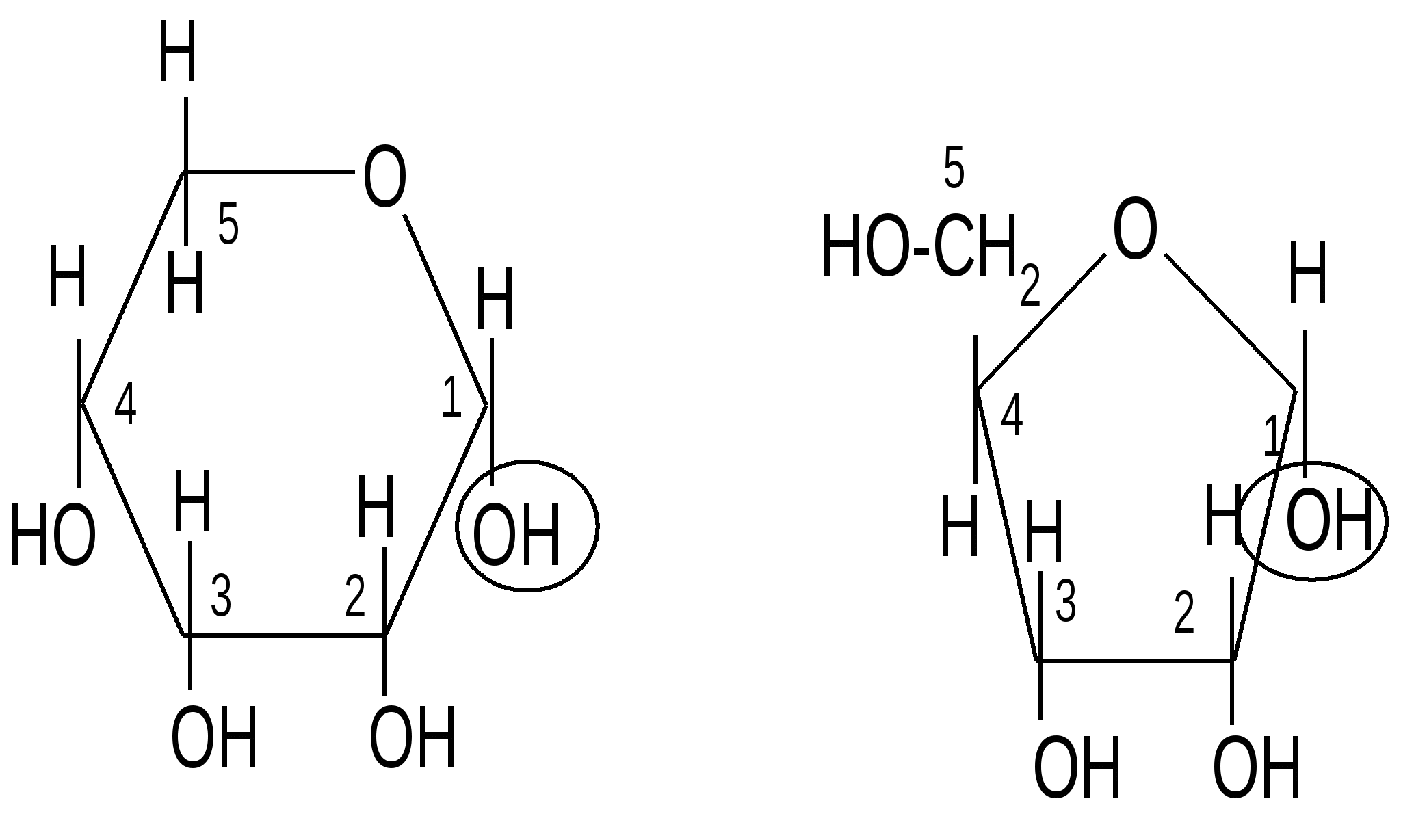
сключение составляют заместители у того углеродного атома, при котором происходит циклизация. У такого атома углерода необходимо делать циклическую перестановку заместителей (см. рисунок).
,D –рибопираноза ( по Хеуорсу ) , D–рибофураноза (по Хеуорсу)
Цикло-цепная таутомерия моносахаридов – это существование в водном растворе смеси таутомерных форм, способных превращаться друг в друга через открытую таутомерную форму:
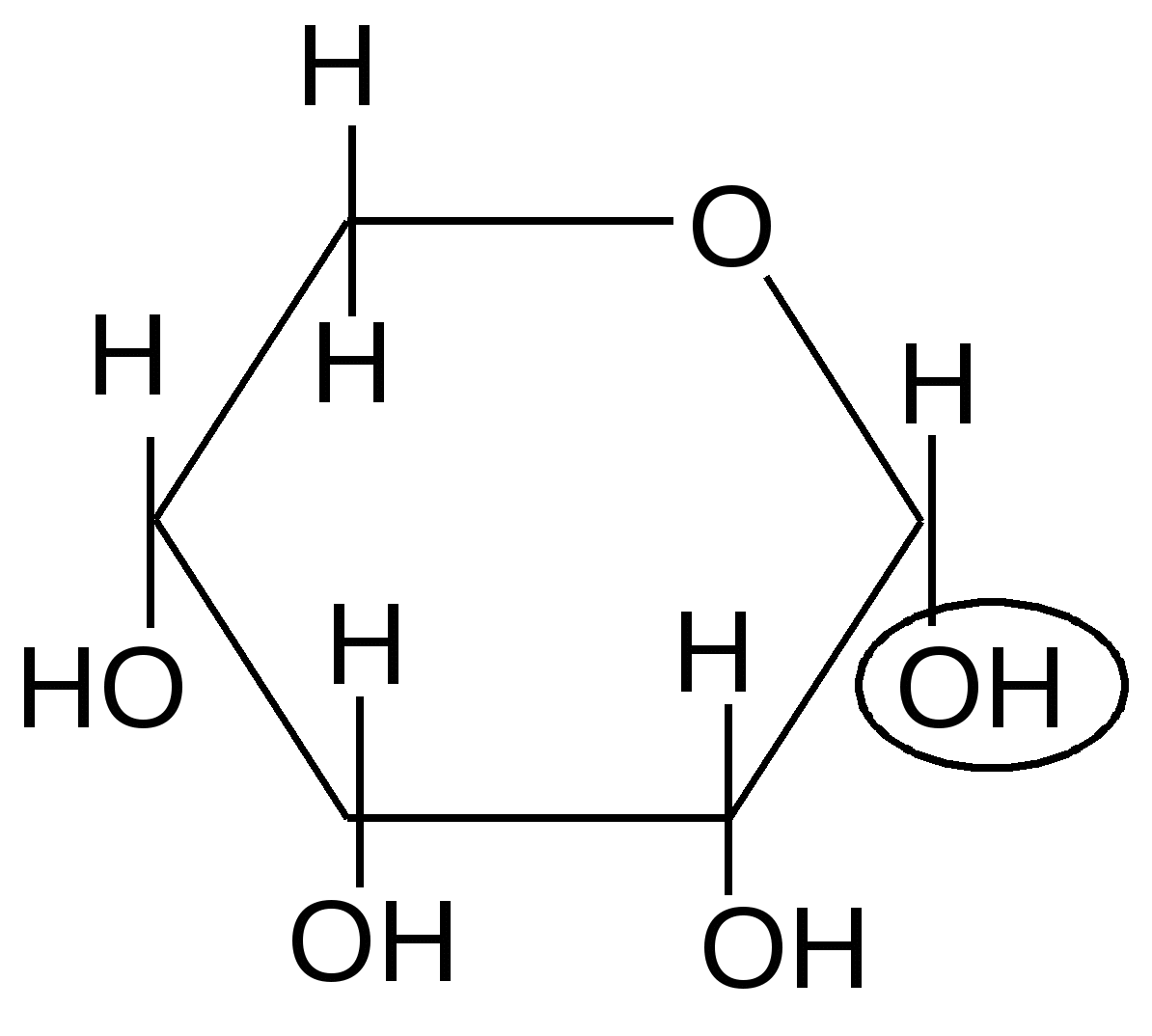
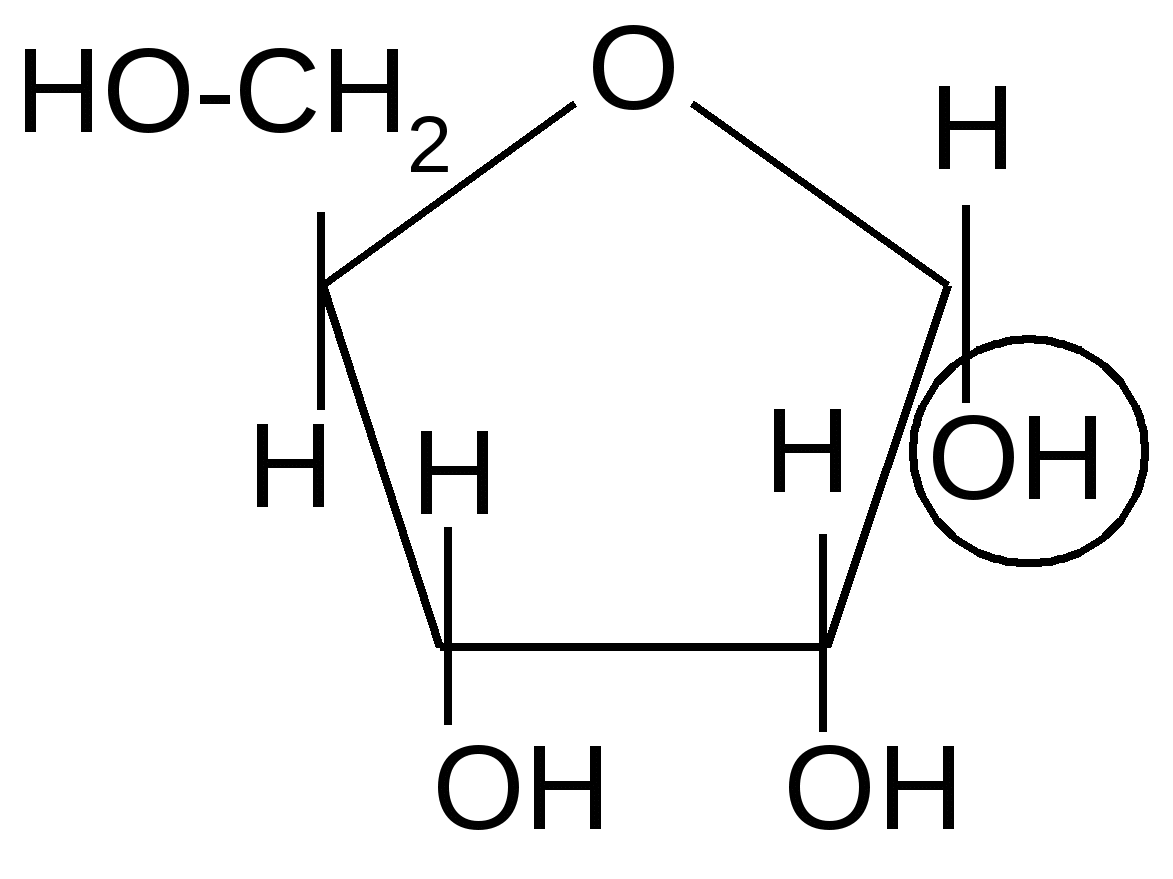
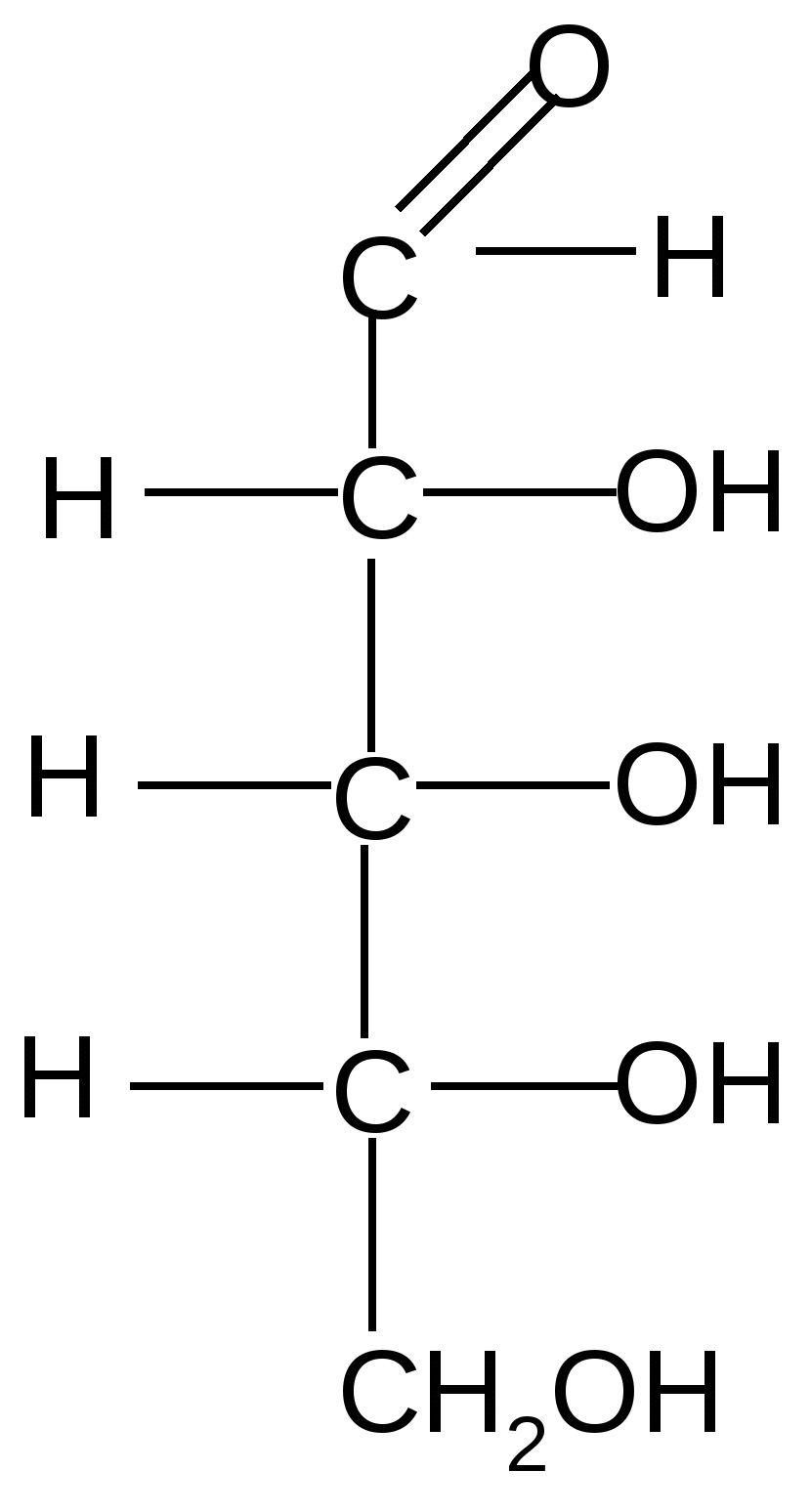
 
 
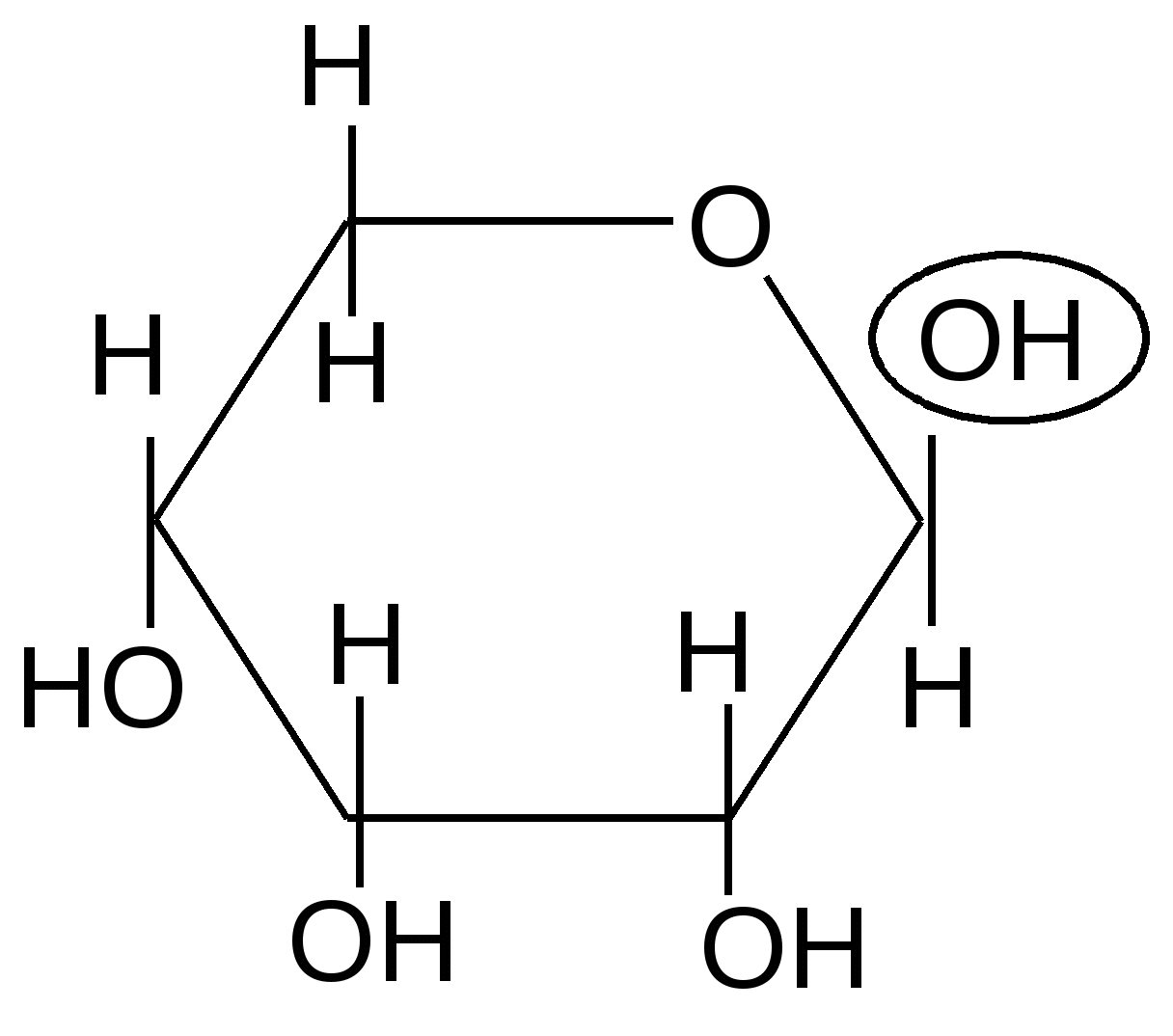
,D-рибопираноза ,D-рибофураноза
18 % 16,5 %
 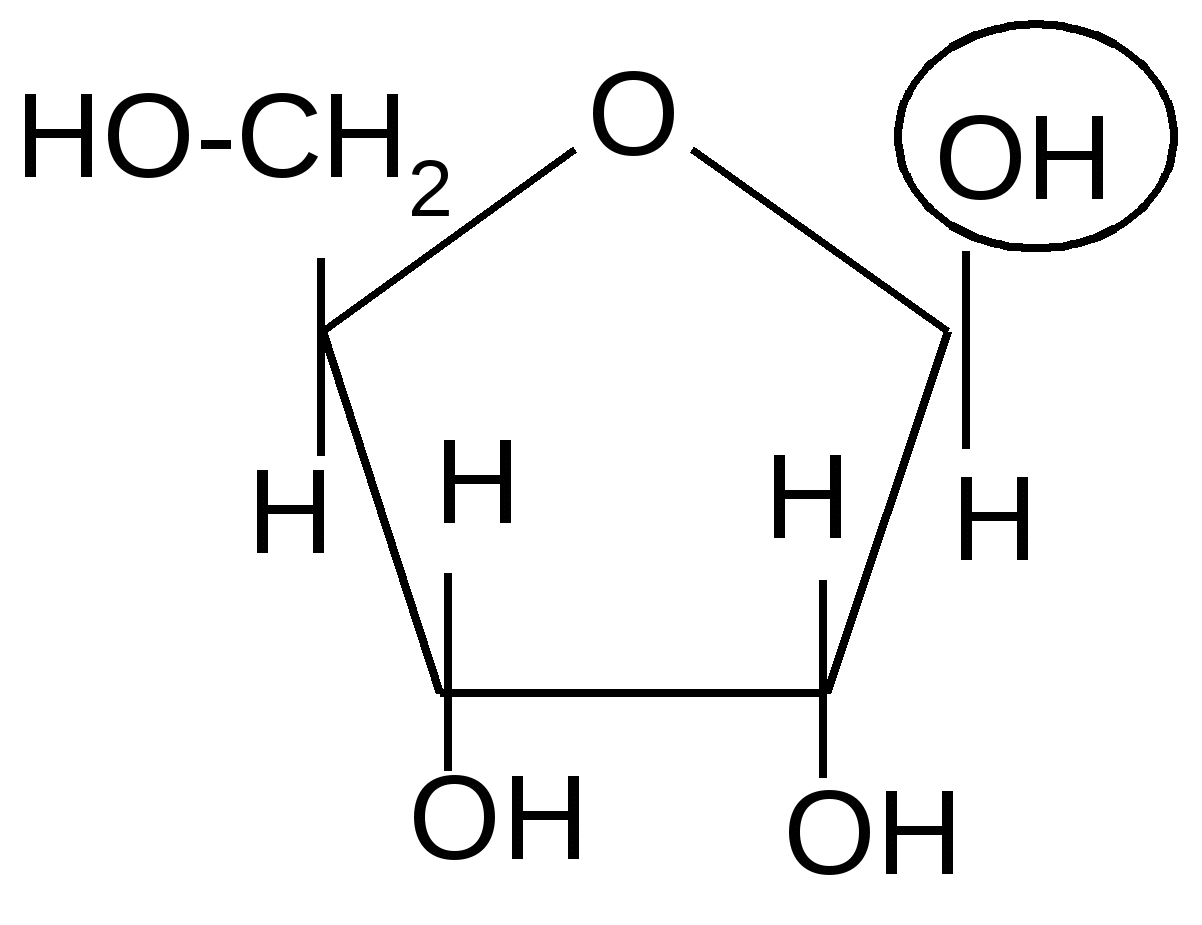
 
 
D-рибоза
8,5 %
,D-рибопираноза ,D-рибофураноза
51 % 6 %
3. Мутаротация сахаров При растворении кристаллической таутомерной формы углевода в воде наблюдается явление мутаротации.
Мутаротация объясняется тем, что кристаллический циклический таутомер, растворяясь в воде, переходит постепенно через открытую форму во все другие таутомерные формы. При этом угол вращения плоскости поляризованного света будет меняться во времени до достижения равновесия между всеми цикло-цепными таутомерами. Это изменение во времени угла вращения плоскости поляризованного света в свежеприготовленных растворах сахаров называется мутаротацией.
4. Конформации моносахаридов
Углеводы в циклической форме существуют в виде неплоских конформаций. Так, для пиранозных форм наиболее энергетически выгодной является конформация «кресла».
В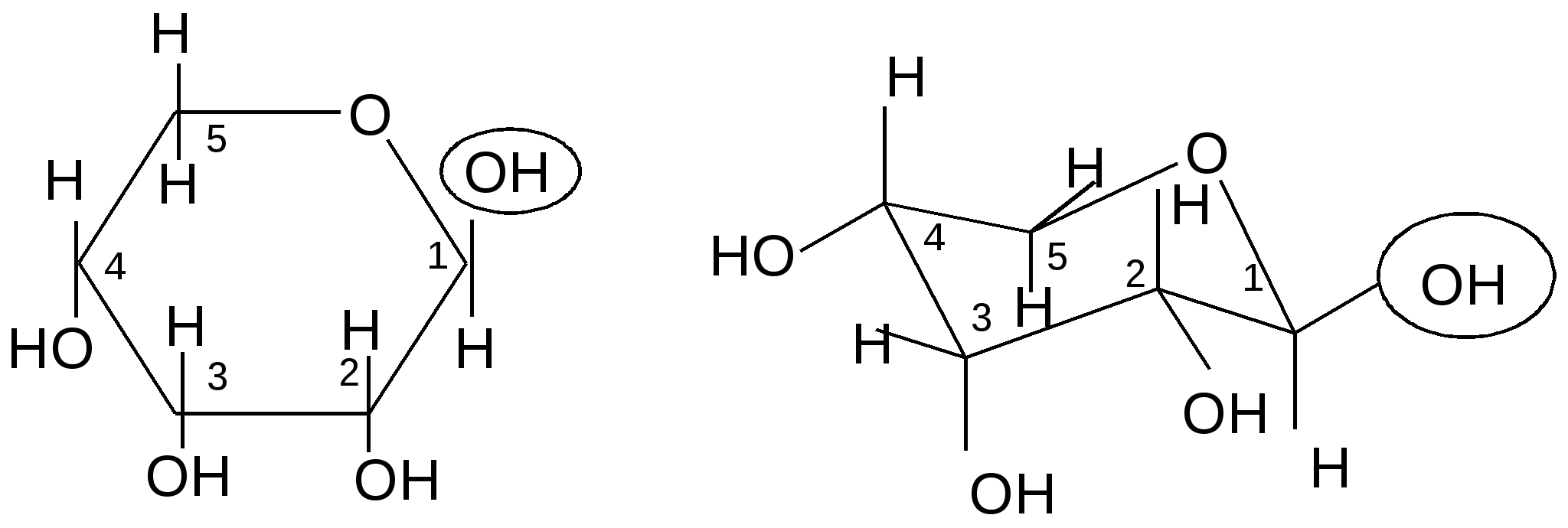
равновесной смеси таутомеров D-рибозы преобладает ,D-рибопираноза (51 %), так как этот таутомер существует в конформации кресла с экваториальным расположением большинства гидроксильных групп, что обеспечивает стабильность этой формы:
, D–рибопираноза
Только одна ОН группа в третьем положении кольца занимает аксиальное положение в этой конформации.
В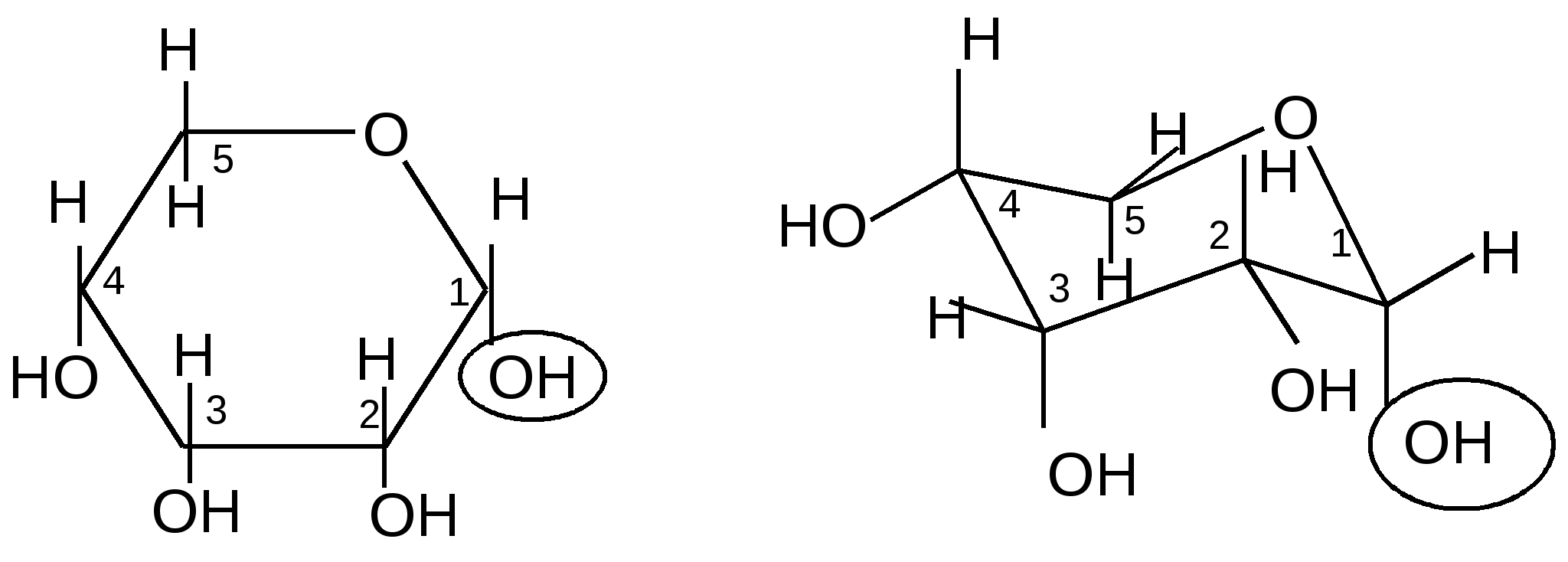
конформации ,D-рибопиранозы таких групп две – в первом и третьем
положениях:
, D- рибопираноза
Эта форма менее стабильна; ее содержание составляет всего 18 %.
Пятичленные циклы и ациклическая форма содержатся в смеси в меньшей
концентрации.
5. Эпимеризация
П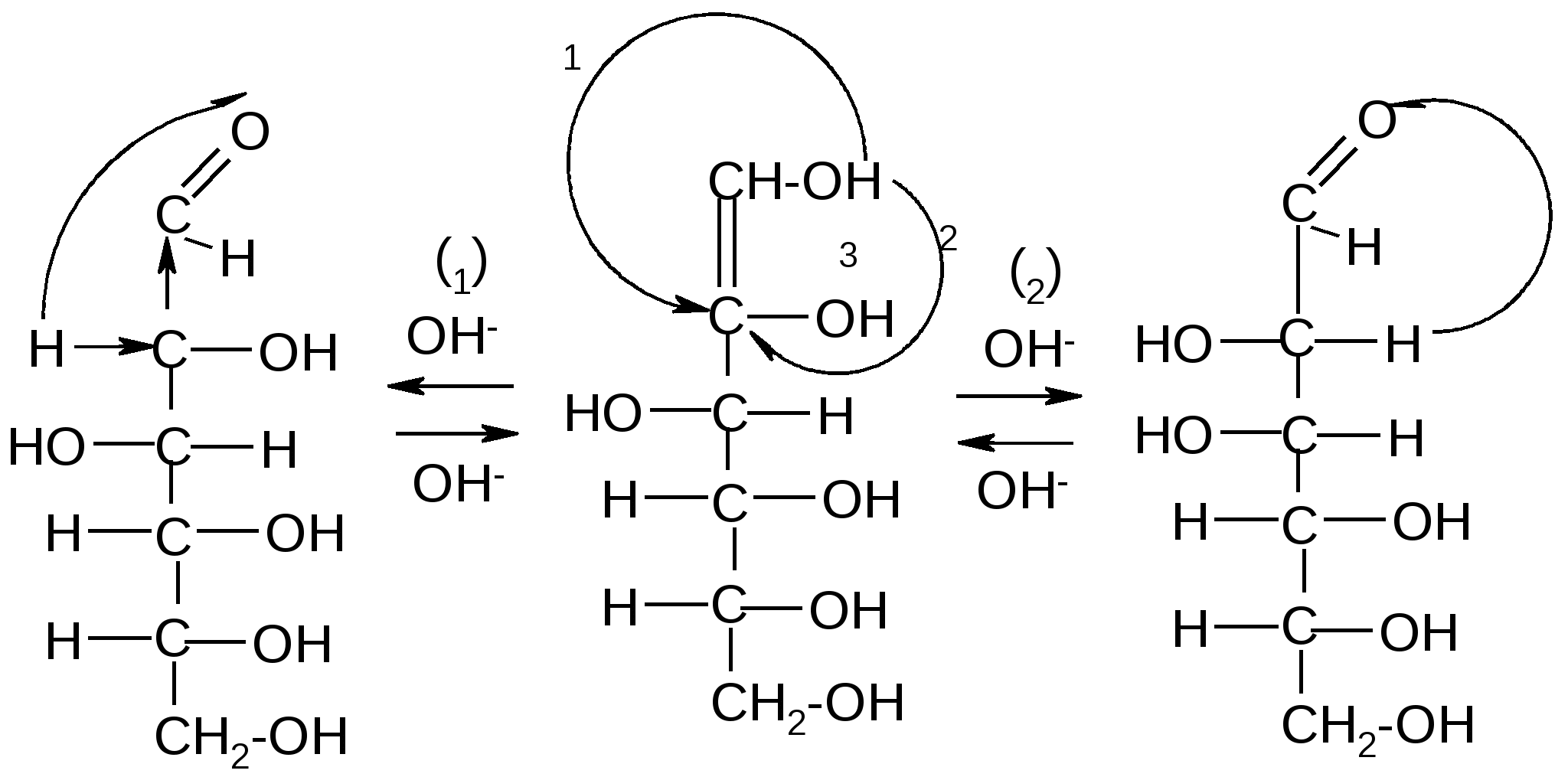
од действием щелочей некоторые моносахариды, отличающиеся конфигурацией одного хирального центра, могут превращаться друг в друга через промежуточное образование общей ендиольной формы:
D-глюкоза ендиол D-манноза
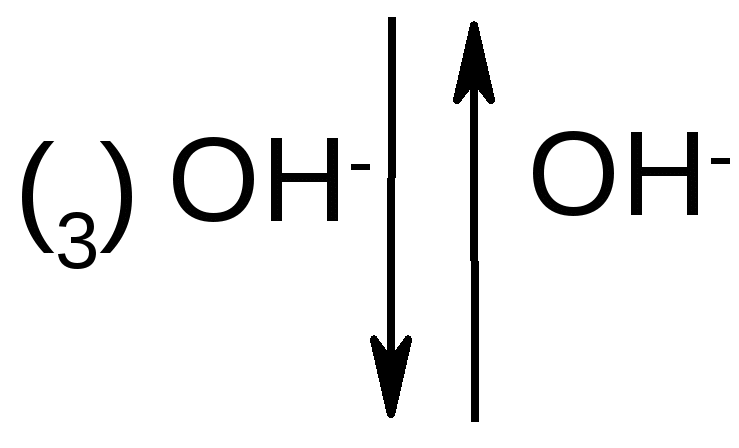
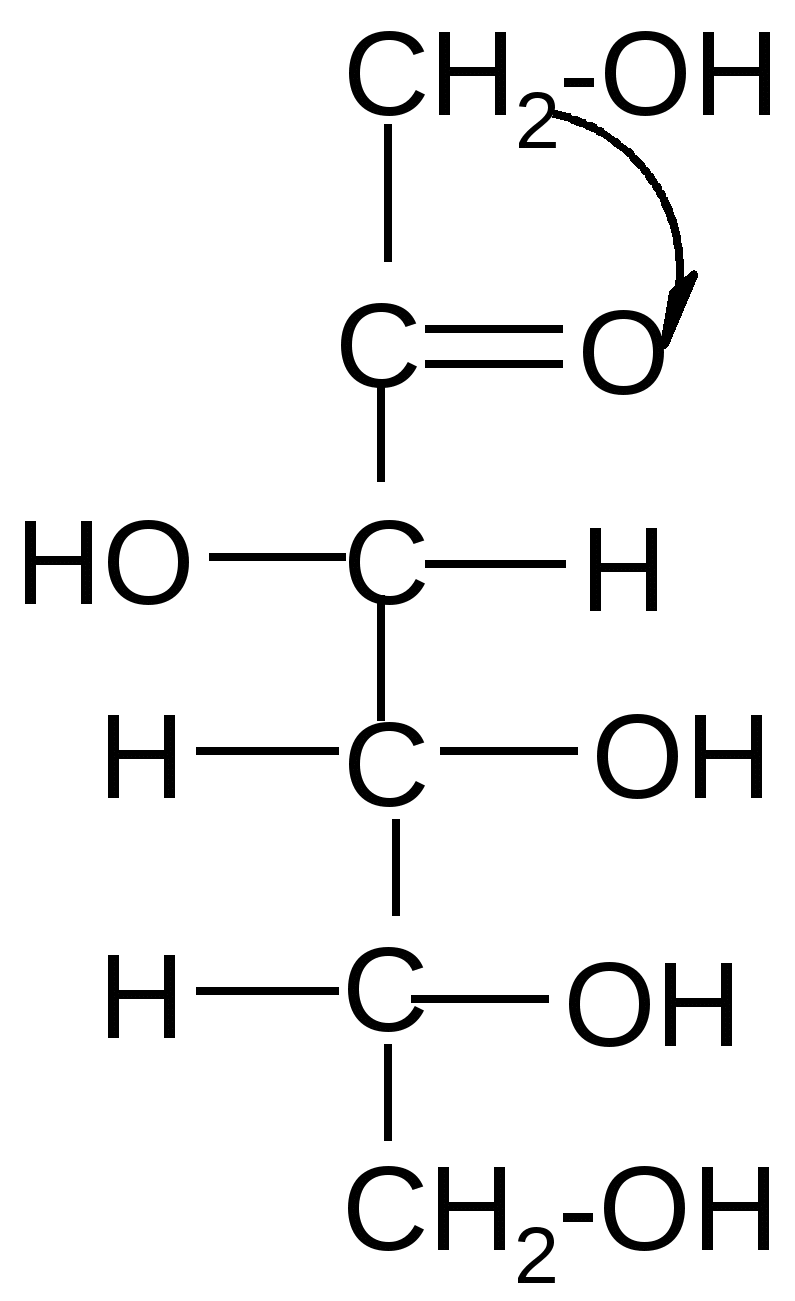
(63,5%) (2,5%)
D-фруктоза
(31%)
Стереоизомеры, отличающиеся конфигурацией одного хирального центра, называются эпимерами, а процесс их взаимного превращения друг в друга в щелочной среде – эпимеризацией.
6. Химические свойства моносахаридов
Реакции, характерные для цепной формы углеводов
1. Окисление
а) мягкое (см. лабораторные работы)
 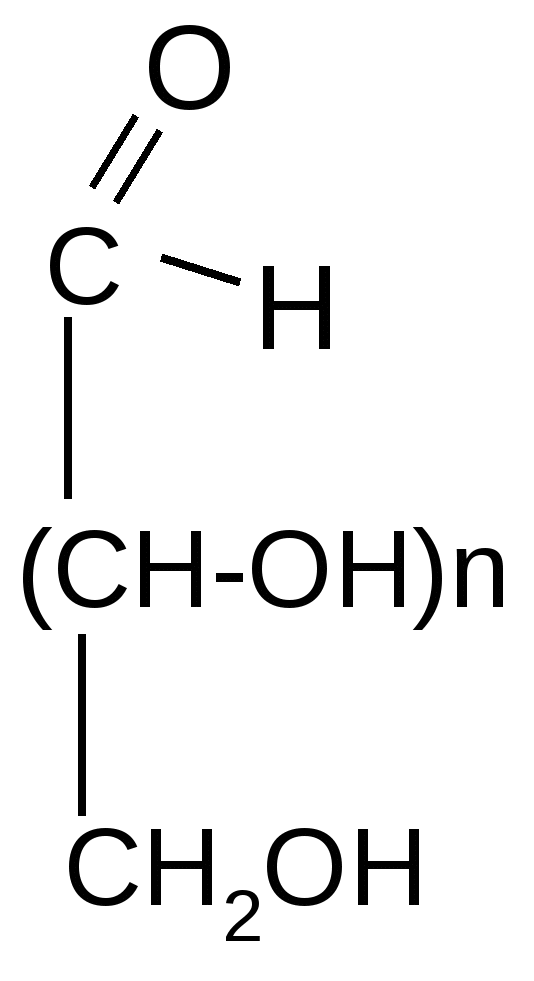 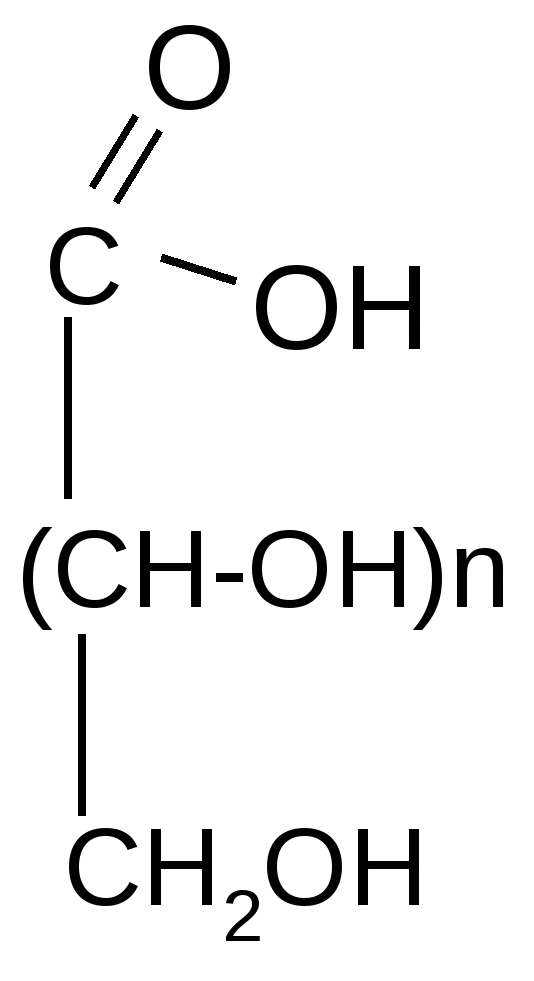
Cu2O

t°
 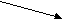 + Сu(OH)2 + CuOH + Сu(OH)2 + CuOH
H2O
 альдоновые кислоты (глюконовая, альдоновые кислоты (глюконовая,
галактоновая и др.)
2Ag(NH3)2 OH
 + 3NH3 + H2O + 2Ag + 3NH3 + H2O + 2Ag
t°
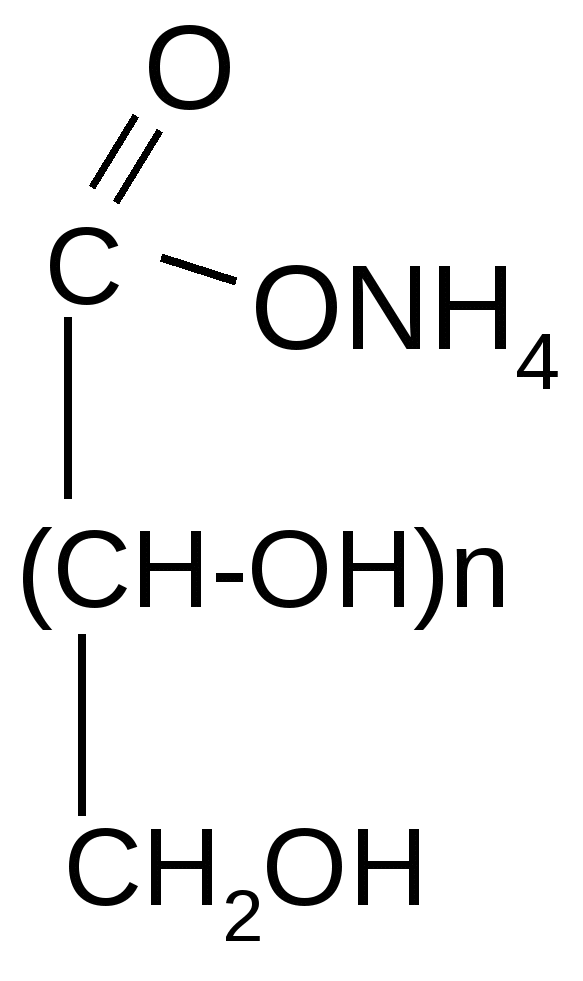
б) жесткое:
альдаровые (глюкаровая,
галактаровая и др.) кислоты
в) ферментативное:
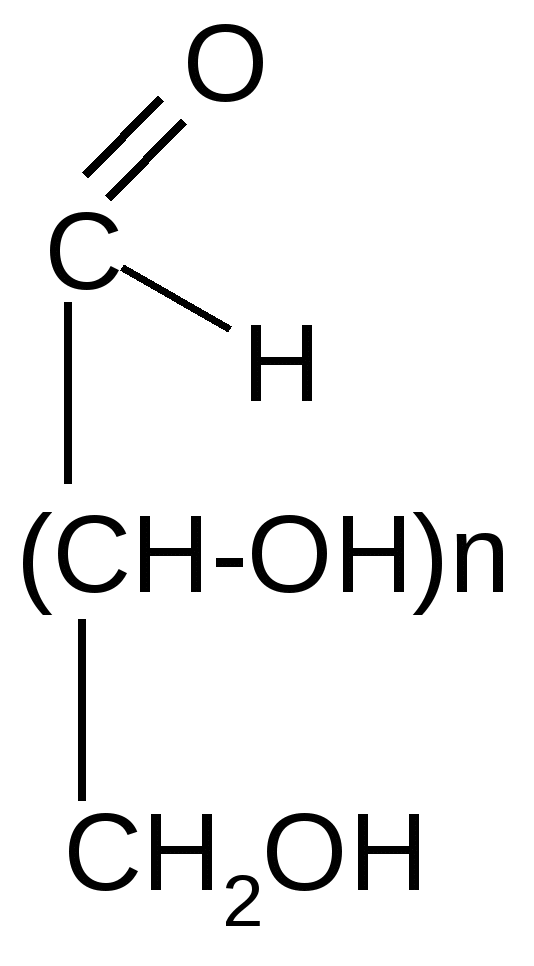 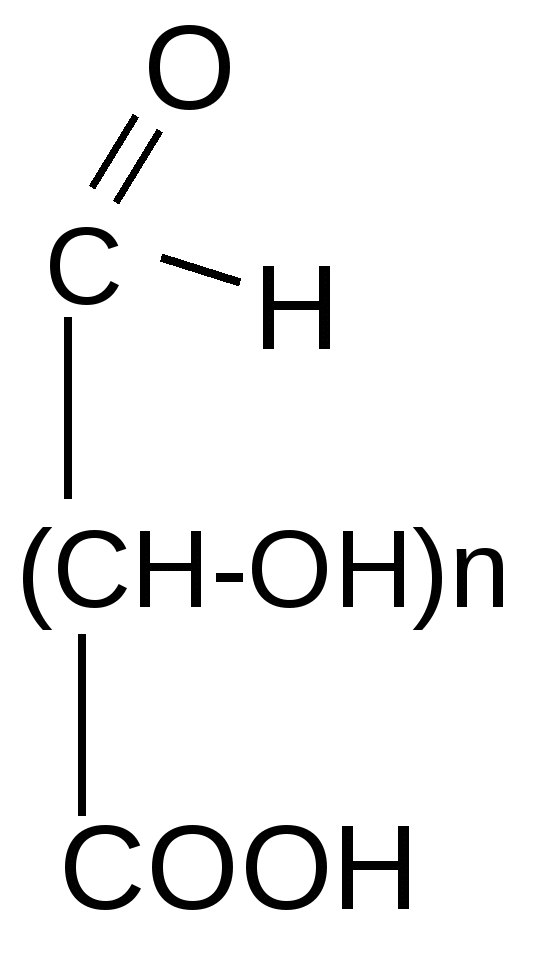

фермент
альдуроновые (глюкуроновая, галактуроновая и др.) кислоты
2. Восстановление моноз проводят под действием водорода в присутствии катализаторов (Pt, Pd, Ni) или гидридов металлов (особенно NaBH4). Если при этом возникает новый хиральный центр, то образуется два многоатомных спирта:
  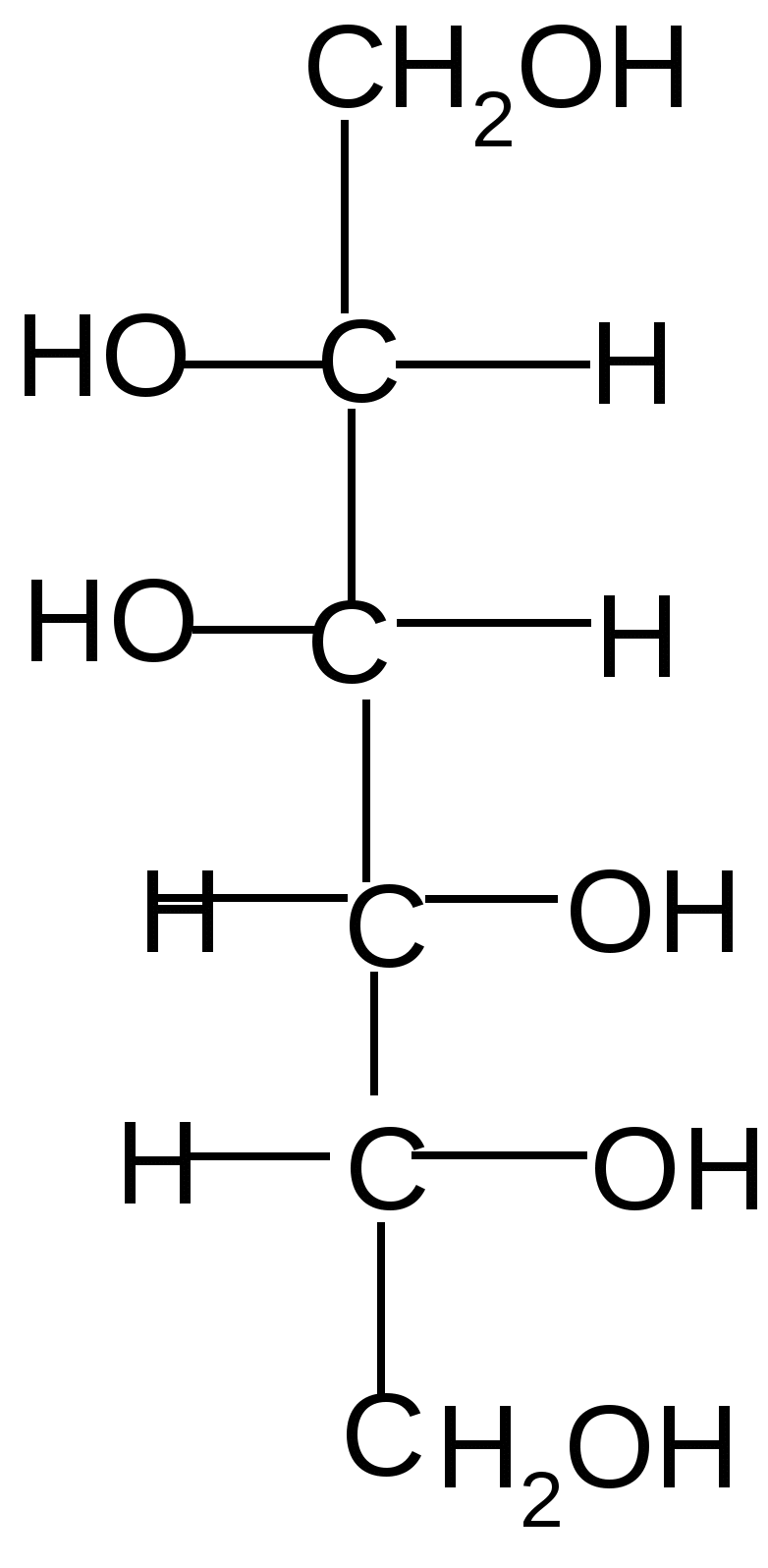
+2H2
 Pt + Pt +
D–фруктоза D-cорбит D –маннит
3. Дегидратация моноз (см. лабораторную работу).
П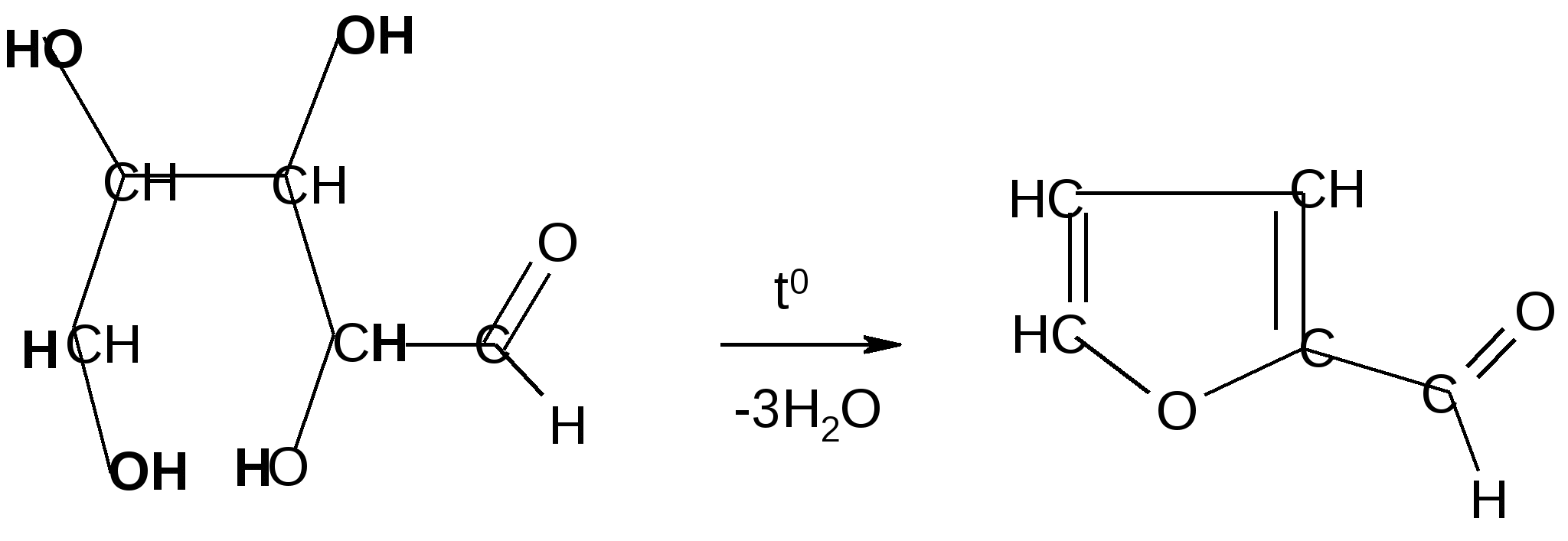
ри действии минеральных кислот на моносахариды (пентозы или гексозы) происходит отщепление воды с образованием фурфурола (из пентоз) или 5-гидроксиметил-фурфурола (из гексоз):
П. Реакции циклических таутомерных форм моносахаридов
Реакции гликозидного (полуацетального) гидроксила.
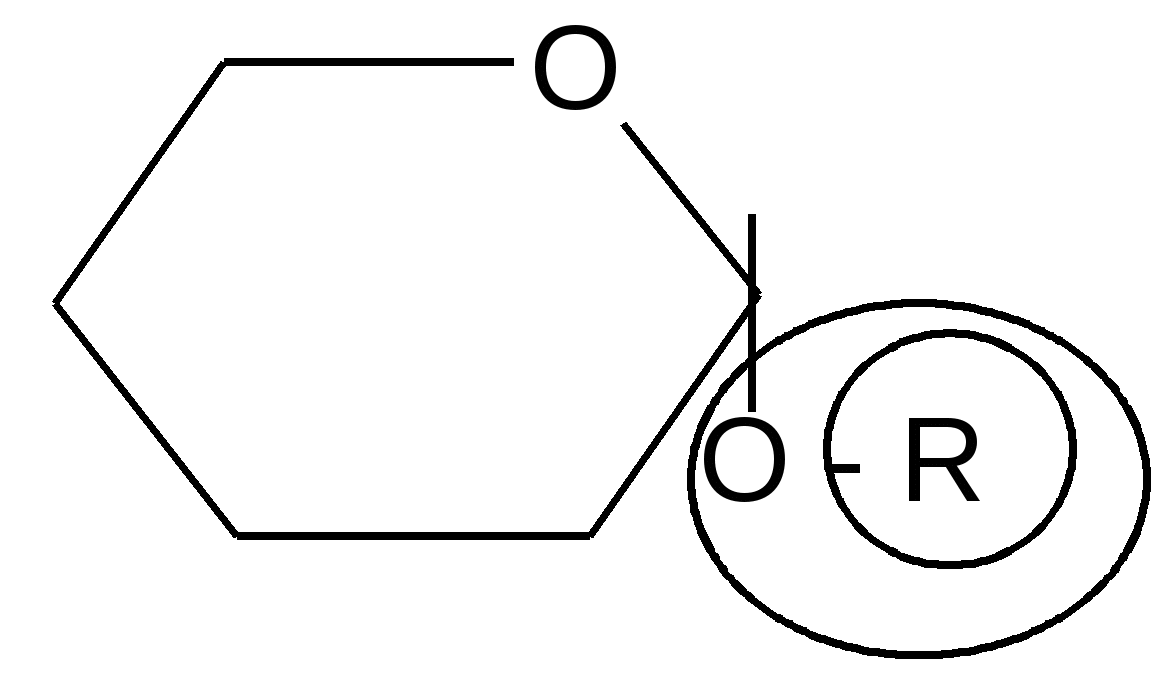
агликон

гликозидная группа
О--гликозид
1.1. Образование О-гликозидов. Как уже отмечалось ранее, полуацетали взаимодействуют со спиртами в безводной среде в присутствии кислотных катализаторов с образованием ацеталей. Полуацетальные циклические формы углеводов в этих условиях также образуют ацетали, называемые О-гликозидами:
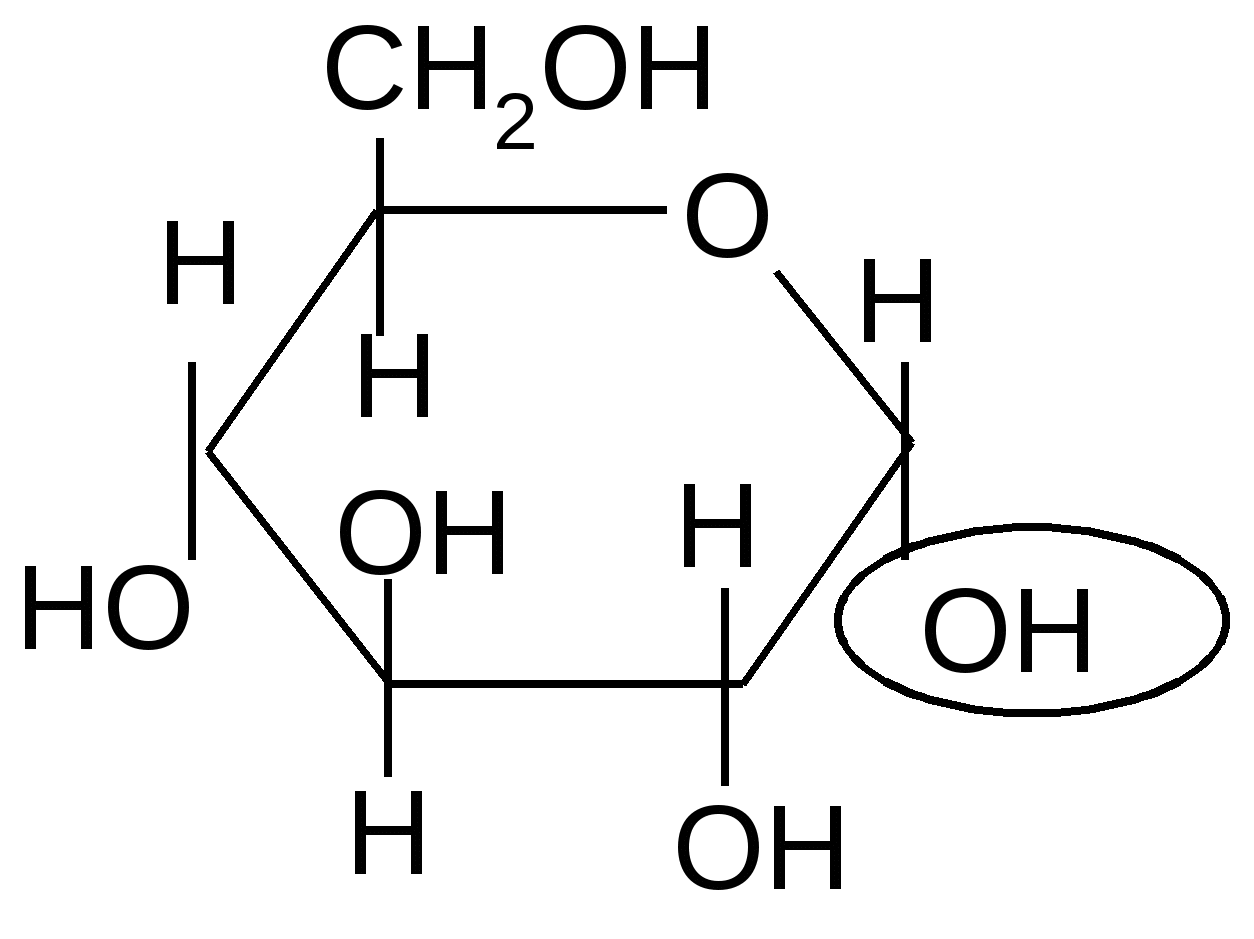 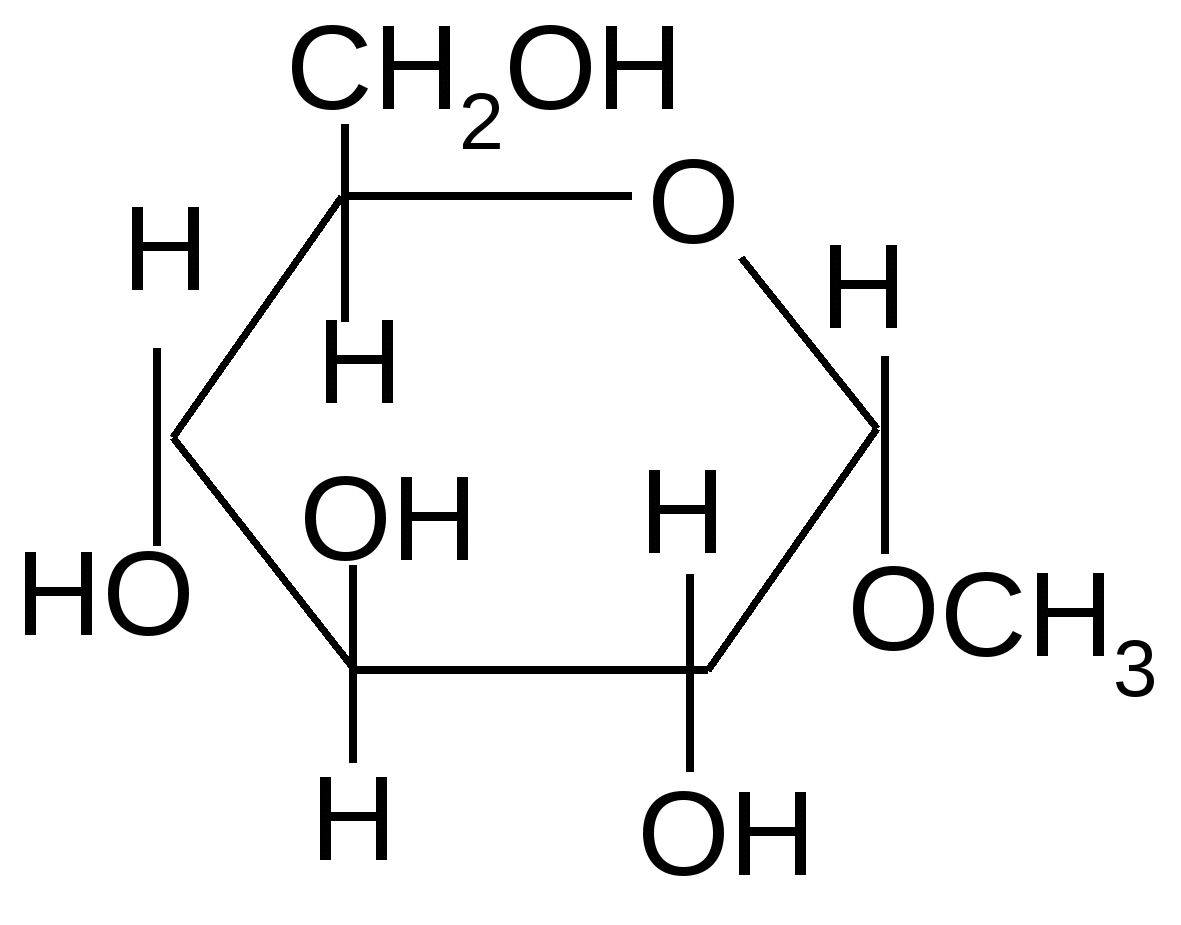
Н+
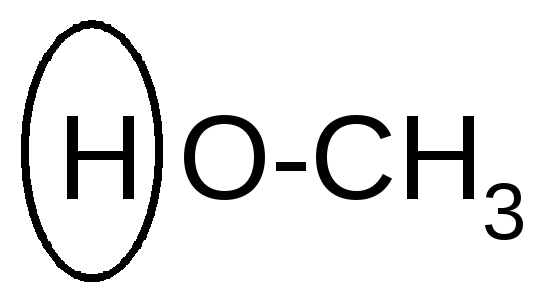   + + H2O + + H2O
Н+
,D-глюкопираноза 1–О-метил-,D–глюкопиранозид
Одновременно с - аномером образуется и -аномер гликозида.
Аналогично протекают реакции моносахаридов с фенолами и другими гидрокси-
производными. В природе (особенно в растительном мире) распространены
О–гликозиды.
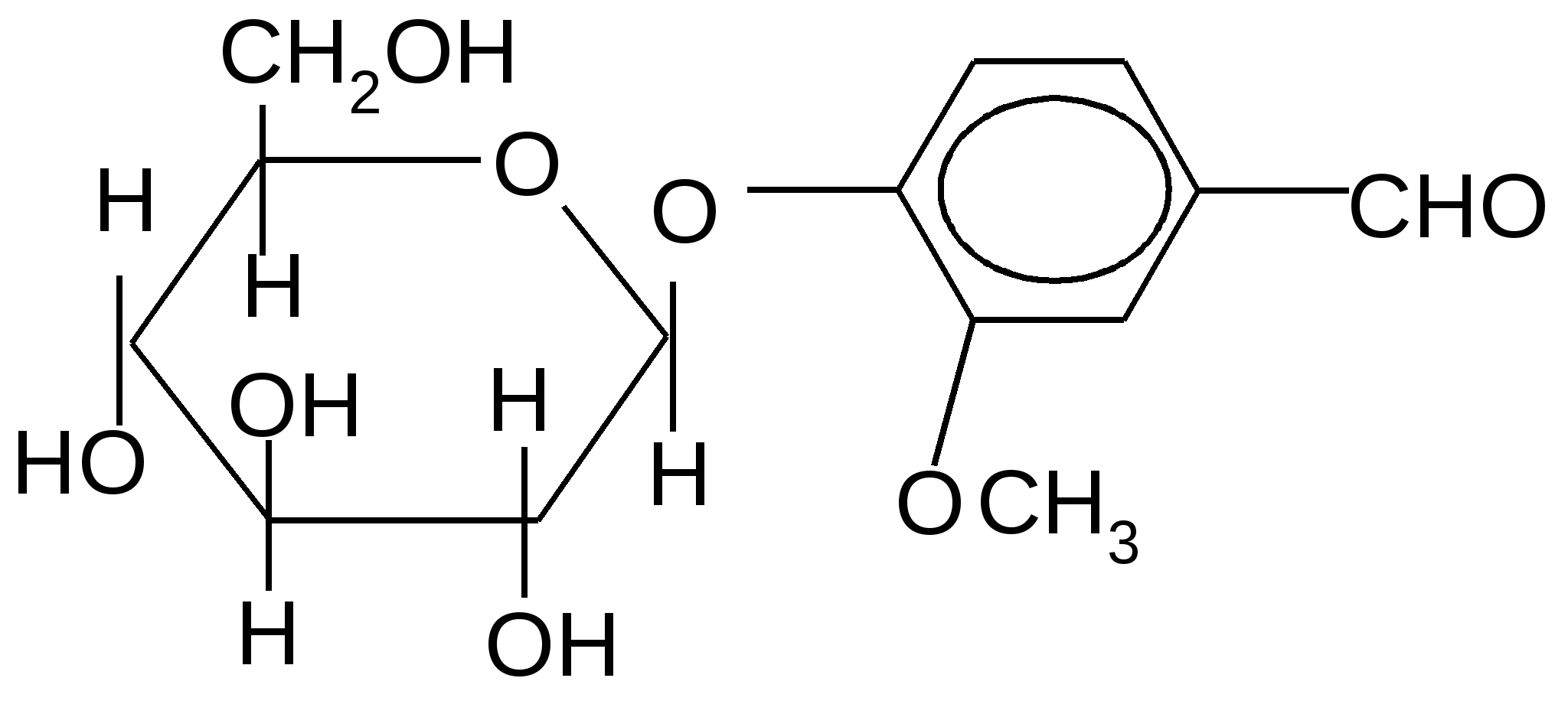
Ванилин-,D–глюкопиранозид
(ваниль)
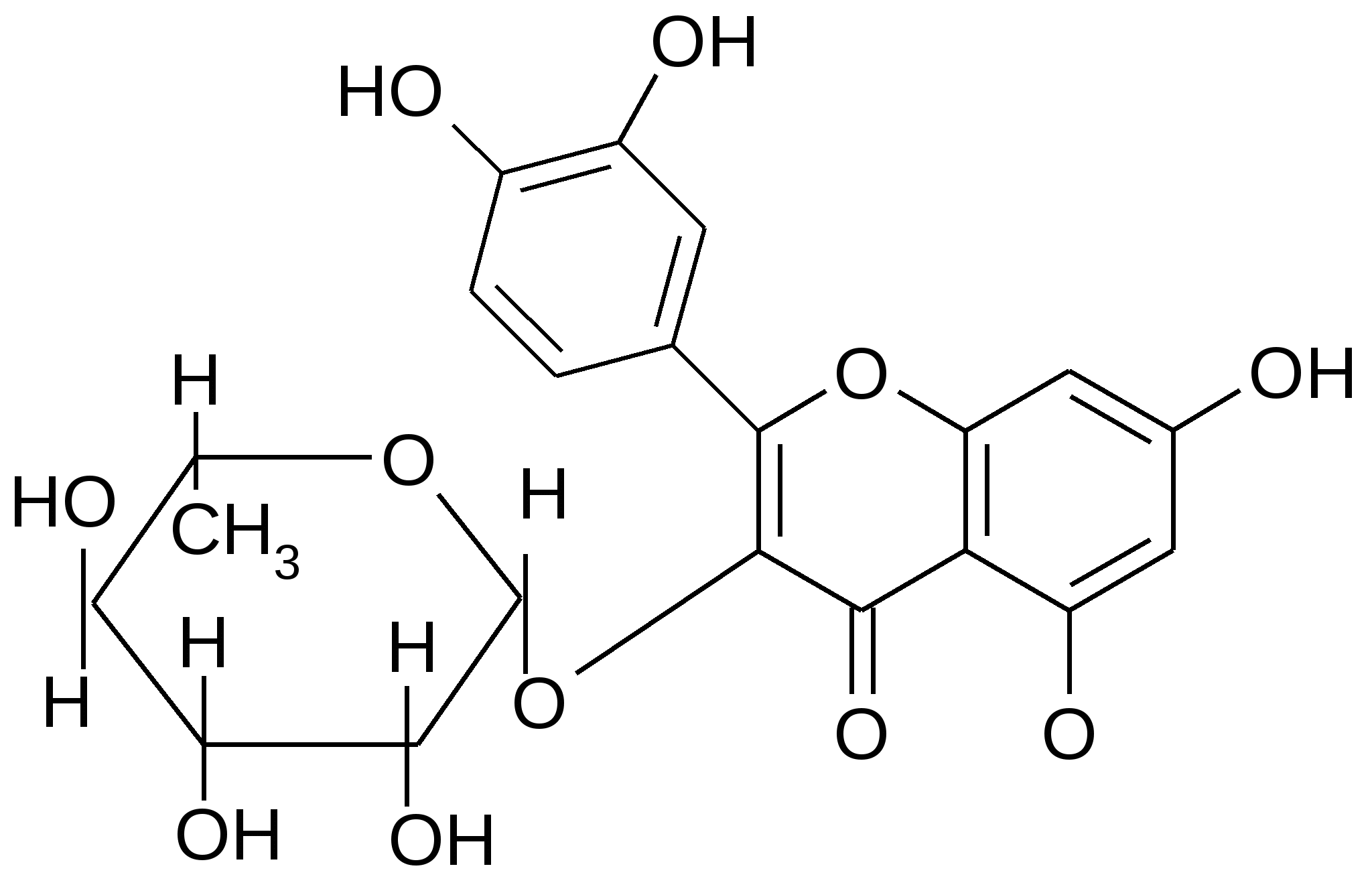
Кверцитрин (анютины глазки,
роза, чай, хмель, дуб) – гликозид
L-рамнозы
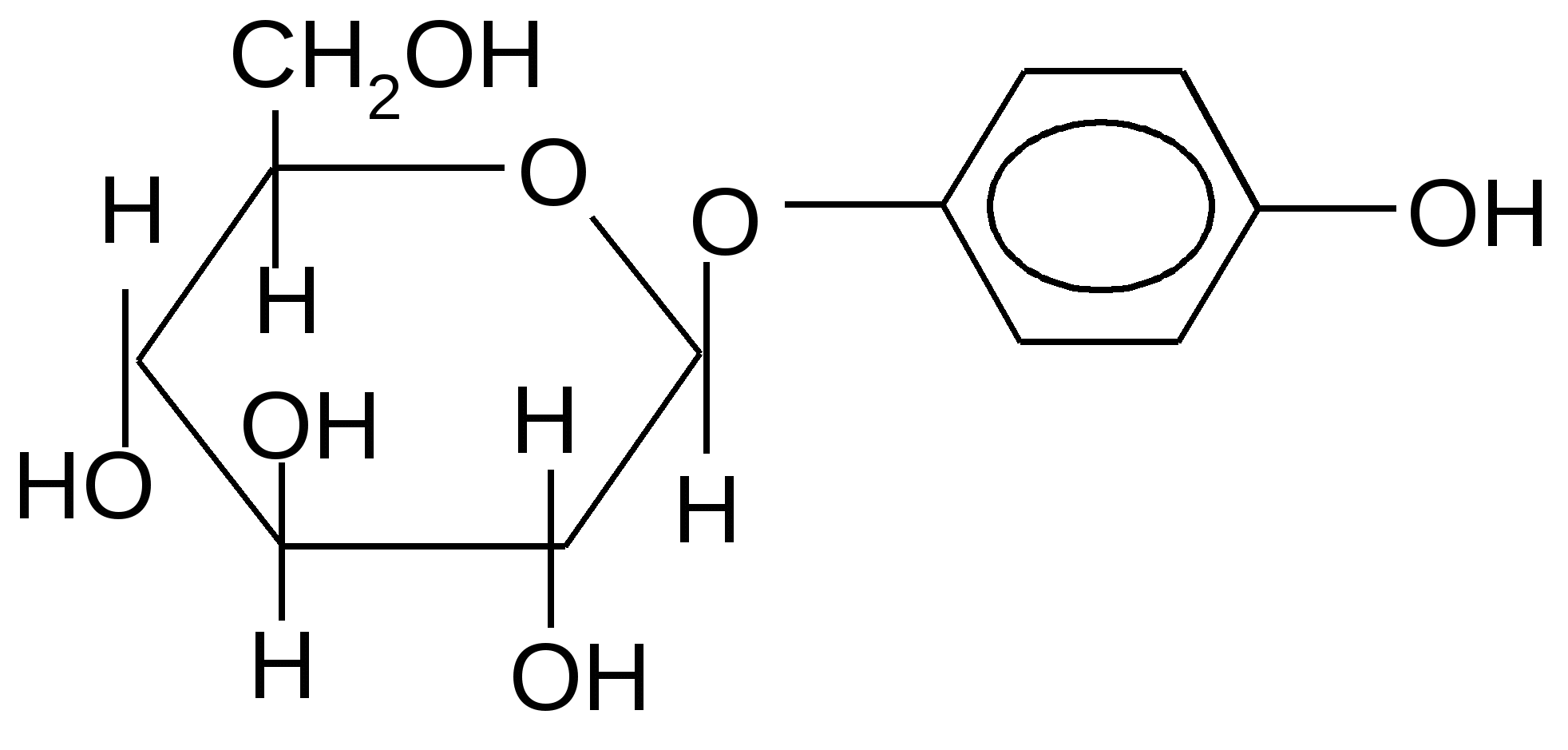
Арбутин (толокнянка,
брусника)
Образование N-гликозидов. Среди N–гликозидов наиболее распространены нуклеозиды, являющиеся компонентами нуклеиновых кислот
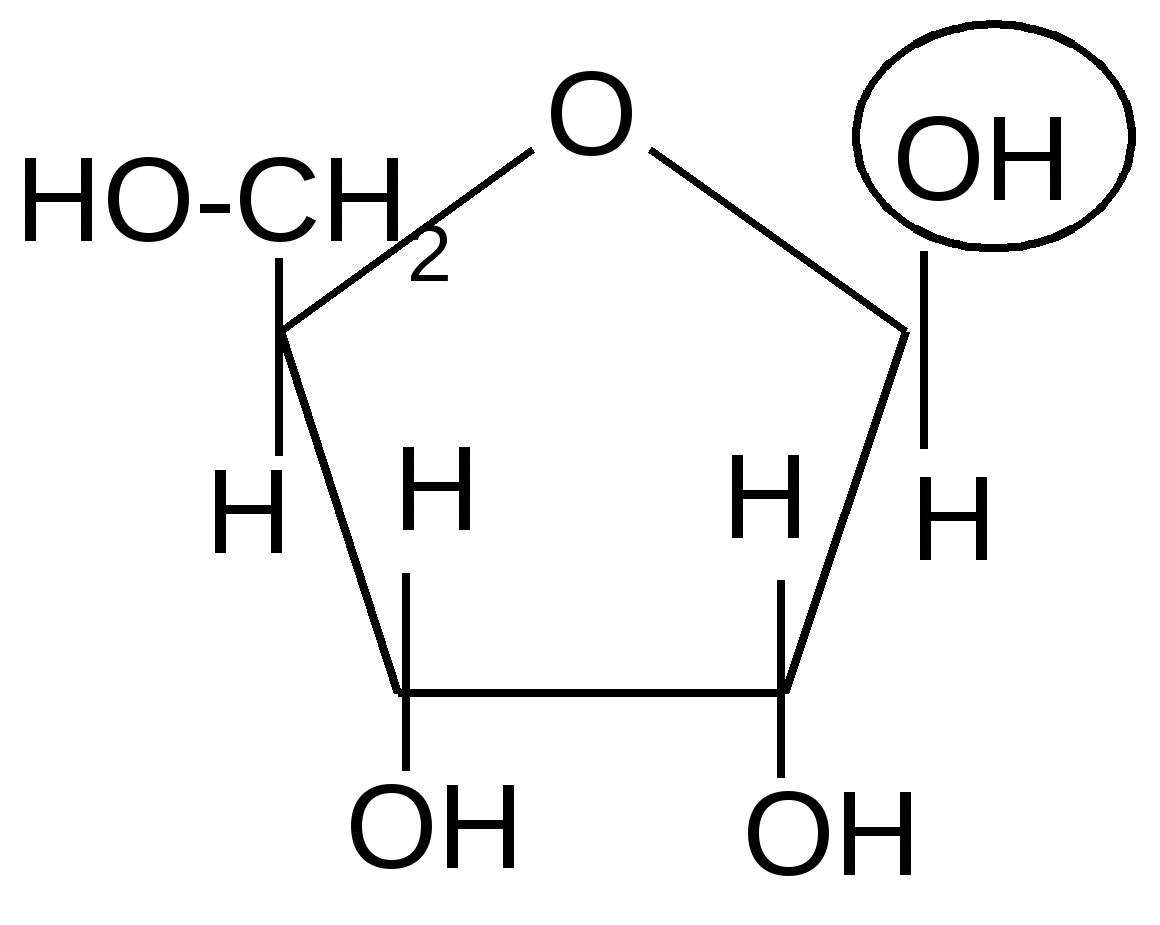 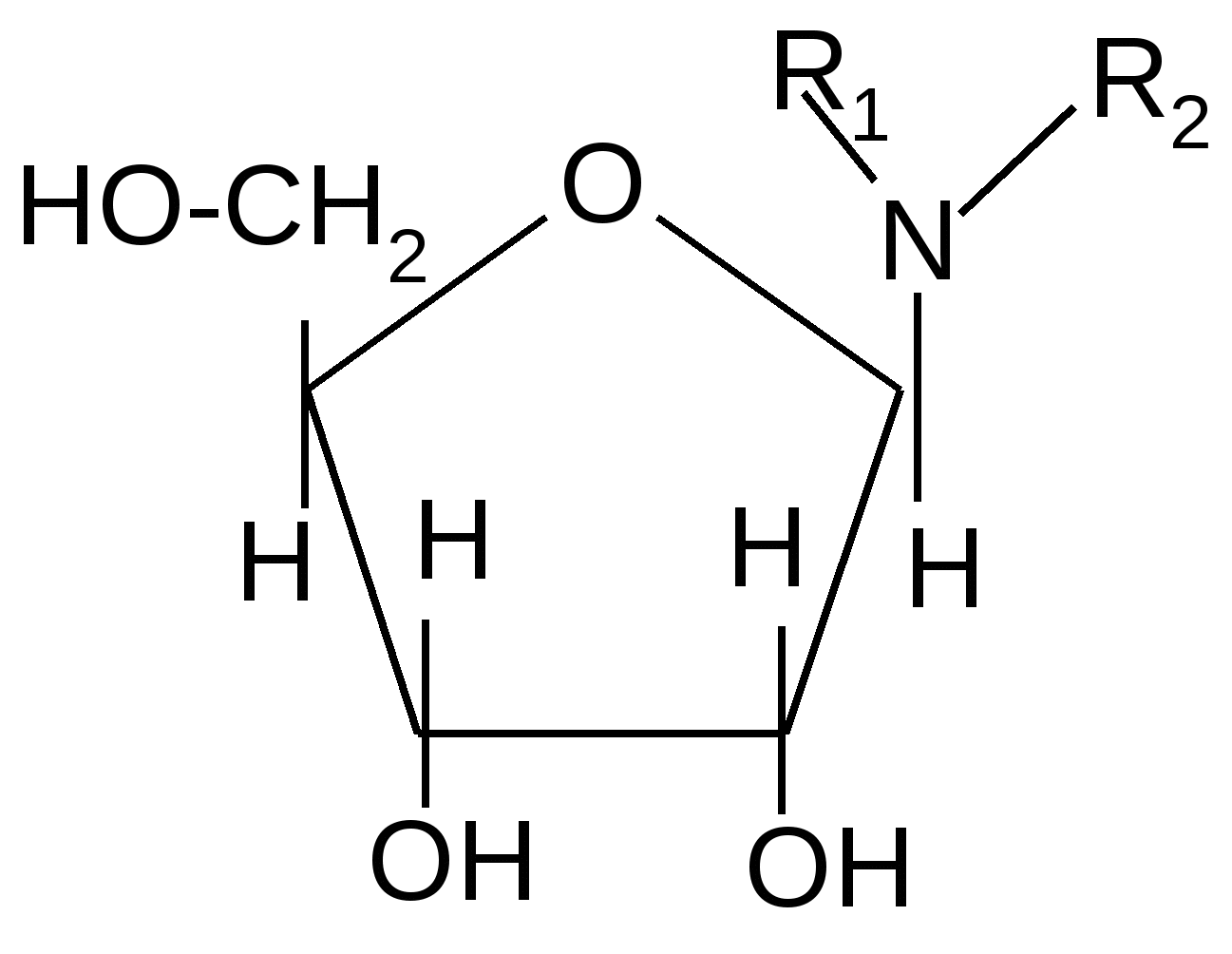

+ -H2O
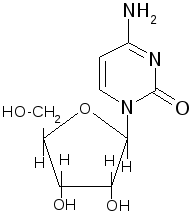
, D-рибофураноза
N-гликозид – цитидин
2. Реакции спиртовых групп.
Алкилирование.
Если спирты способны алкилировать только полуацетальный или полукетальный гидроксил, то более сильные алкилирующие агенты: диметилсульфат или йодистый метил в щелочной среде алкилируют все спиртовые группы углеводов с образованием простых эфиров.
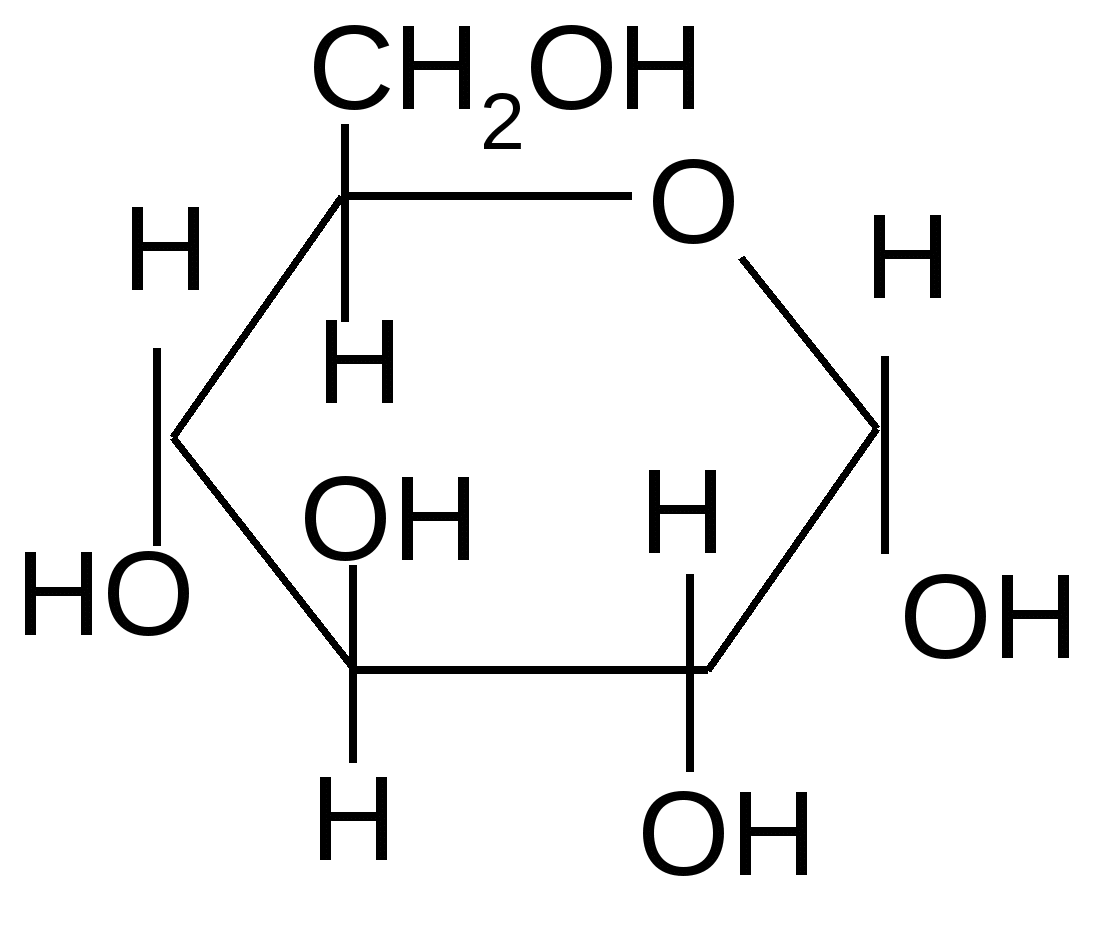 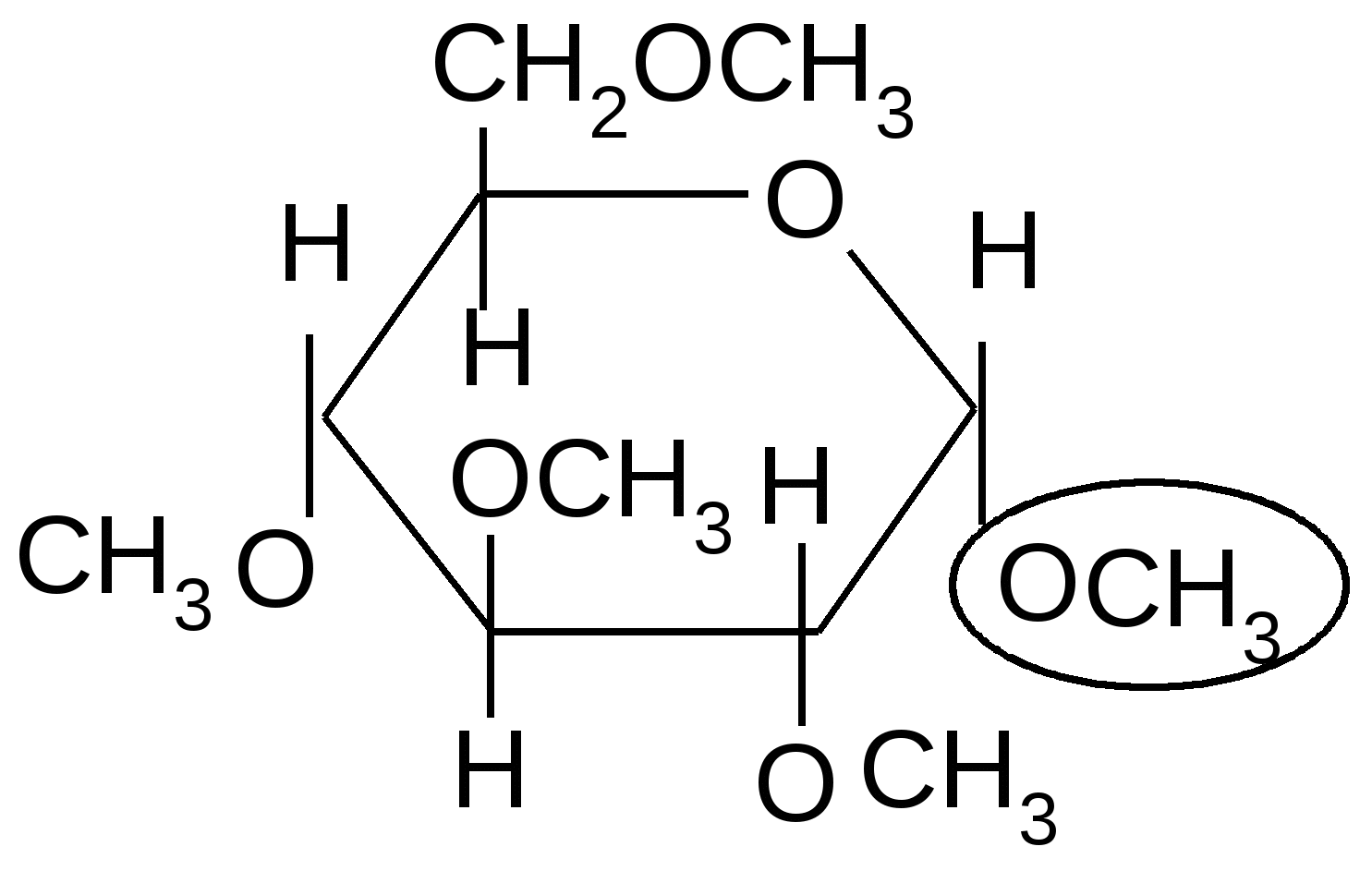
 изб. (СН3)2SO4 изб. (СН3)2SO4

ОН-
1-О-Метил-2,3,4,6-тетра-О-
метил-,D-глюкопиранозид
Особыми свойствами обладает гликозидная группа (ацеталь). Она легко гидролизуется в кислой среде:
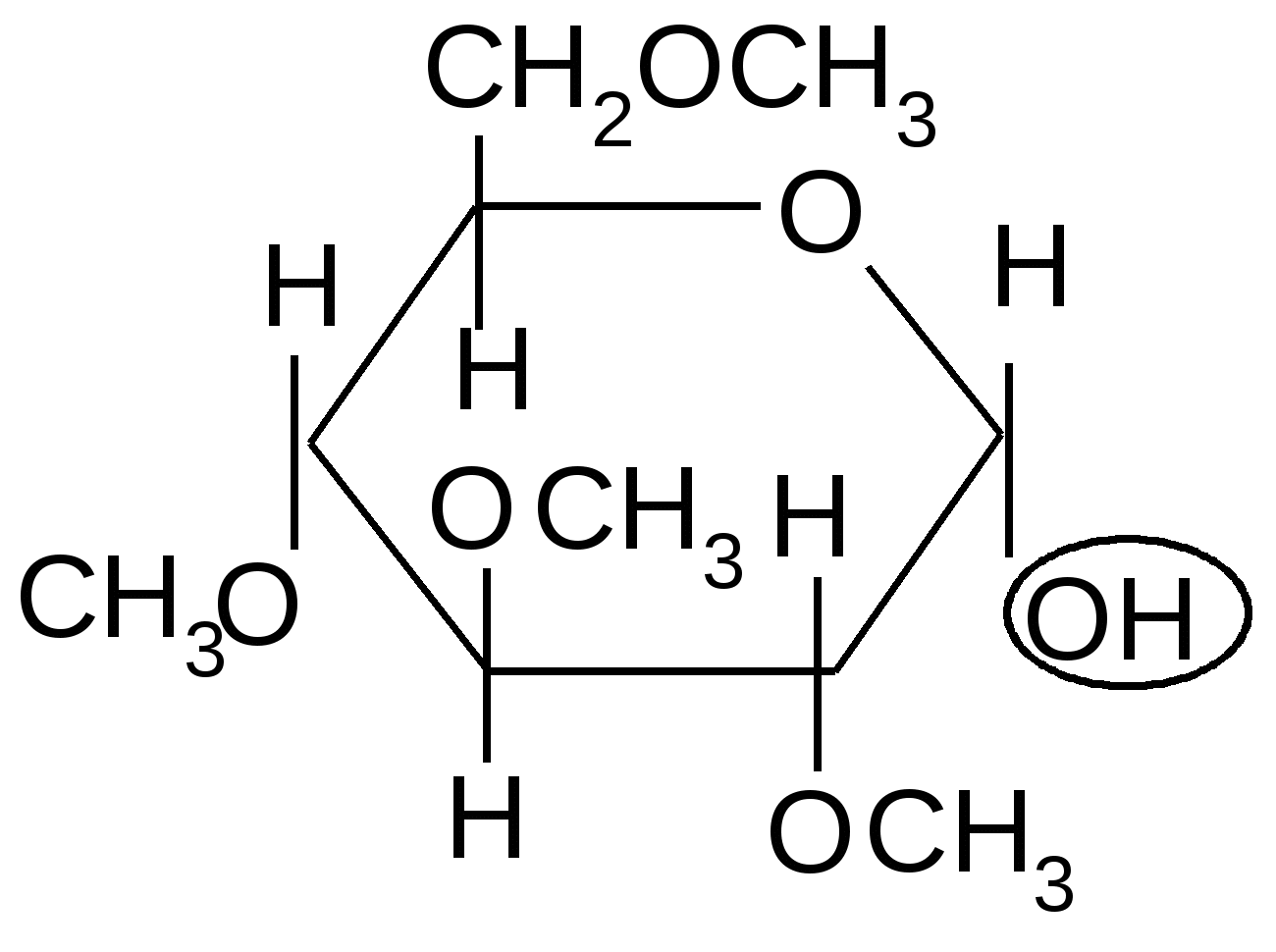
Н2О
 + CH3OH + CH3OH
Н+
2,3,4,6–тетра-О-метил-,D-глюкопираноза
2
.2. Ацилирование.
Моносахариды этерифицируются с образованием сложных эфиров. Наиболее легко вступают в реакцию с кислотами полуацетальная и первичная спиртовая гидроксильная группы, однако, используя более сильные ацилирующие агенты (ангидриды или галогенангидриды кислот), можно получить и полные сложные эфиры сахаров:
 1–ацетил-,D–глюкопираноза 1–ацетил-,D–глюкопираноза
+ 5 (CH3CO)2O
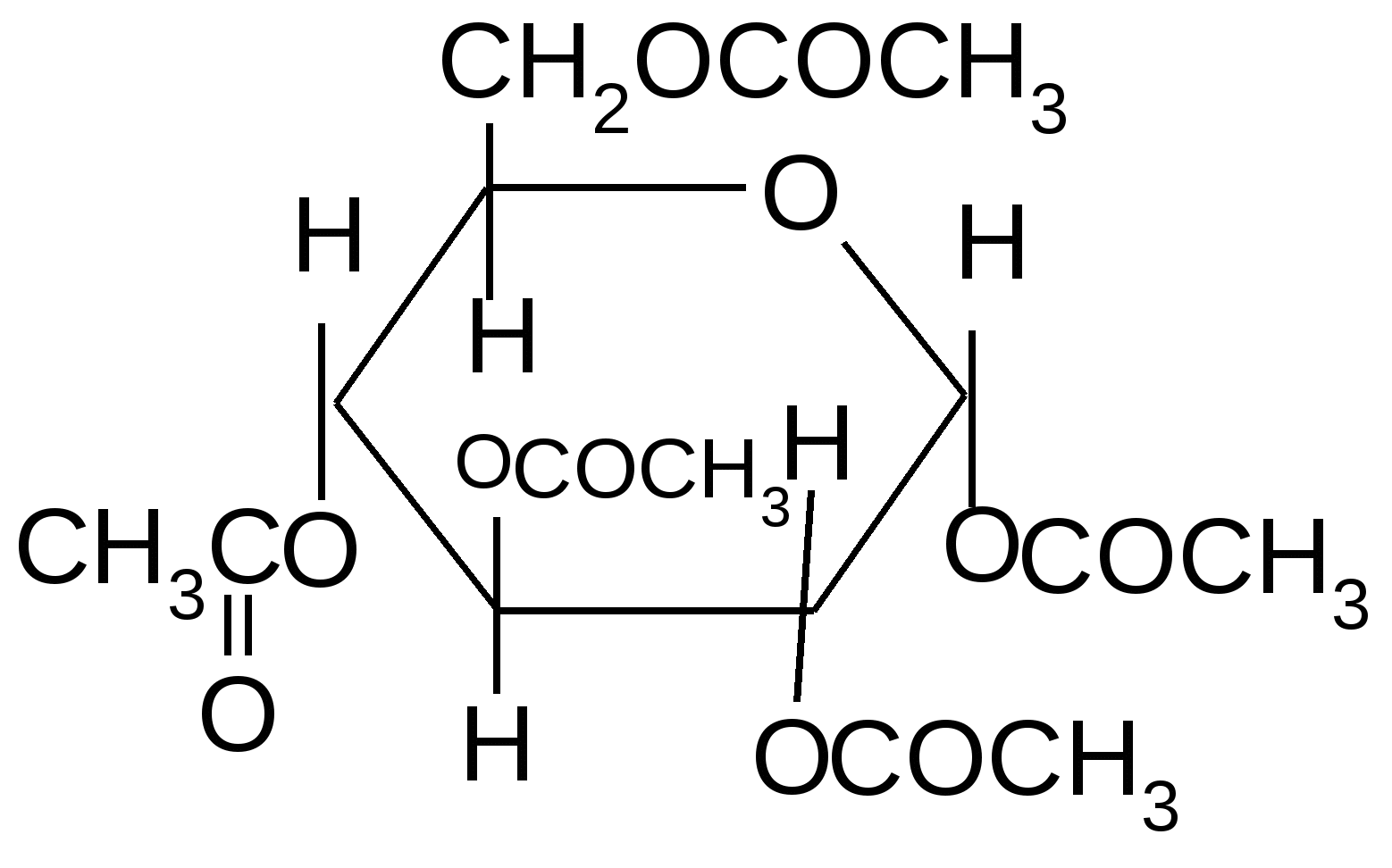
+ 5 CH3–COOH
1,2,3,4,6–пентаацетил-,D–глюкопираноза
Тема 8-2. Ди – и полисахариды
Вопросы для самоподготовки
Олигосахариды. Дисахариды: мальтоза, лактоза, целлобиоза, сахароза. Строение и номенклатура дисахаридов.
Восстанавливающие и невосстанавливающие дисахариды. Доказательство наличия восстанавливающей способности мальтозы, лактозы и целлобиозы.
Кислотный гидролиз дисахаридов.
Строение гомополисахаридов: целлюлозы, крахмала, гликогена. Виды связей между моносахаридными звеньями.
Взаимосвязь пространственного строения и биологической функции полисахаридов.
Дисахариды
Дисахариды (биозы) состоят из двух моносахаридных звеньев, соединенных, как правило, гликозидной связью.
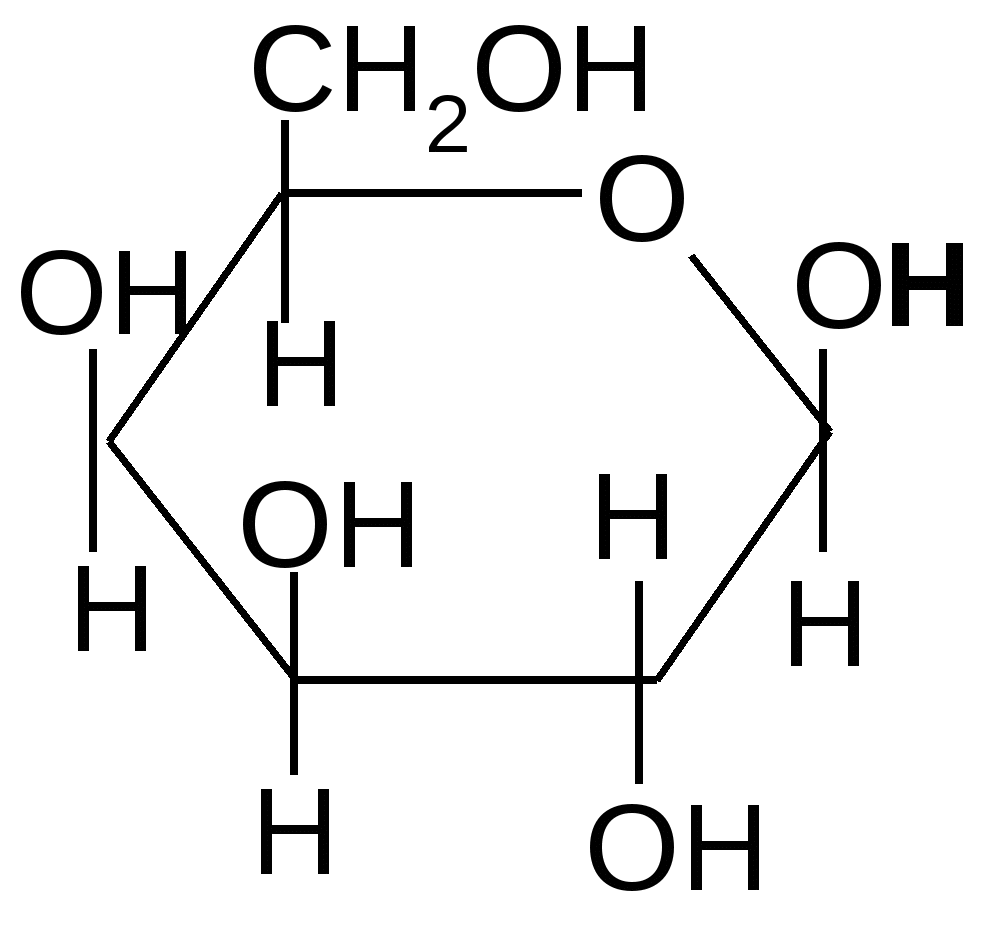
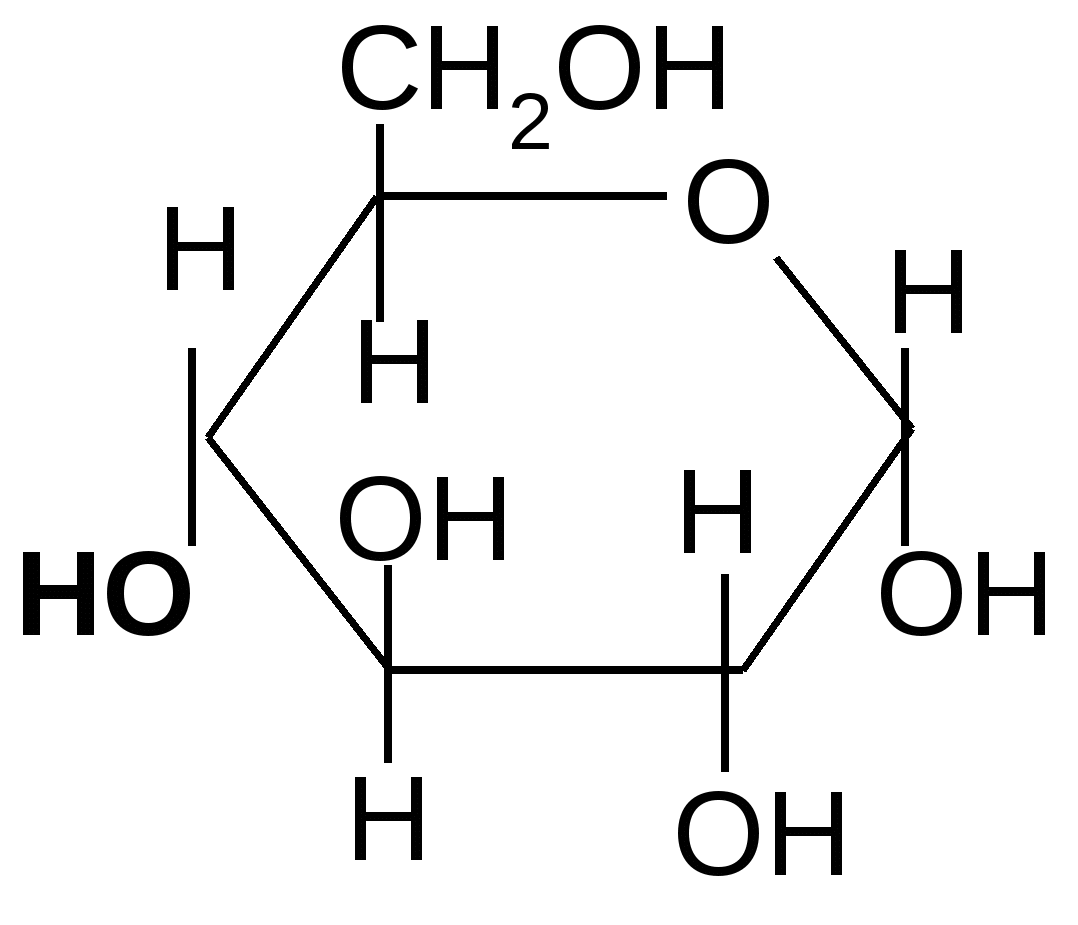
Так, например, лактоза (молочный сахар) состоит из остатков
,D–галактопиранозы и (или ),D–глюкопиранозы, соединенных между собой -1,4 гликозидной связью:
+H2O/H+
 
+ - Н2О
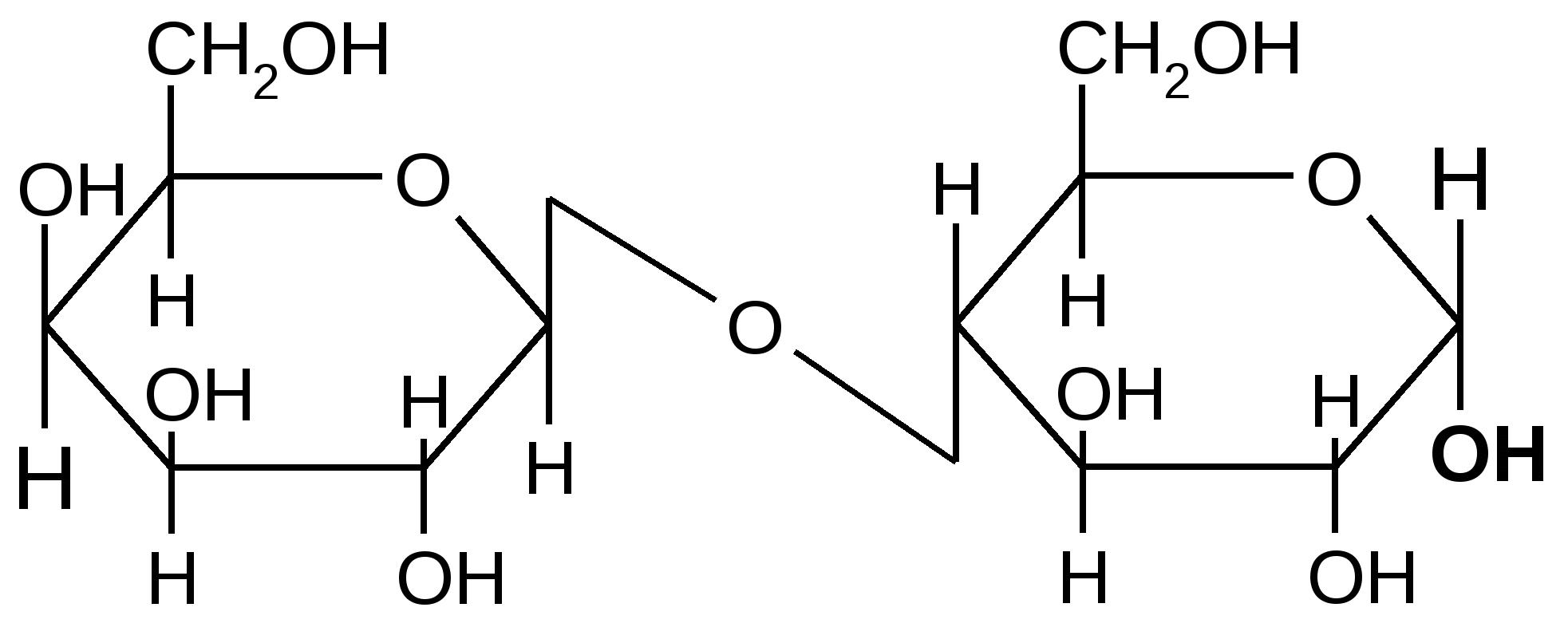
,D–галактопираноза ,D– глюкопираноза
 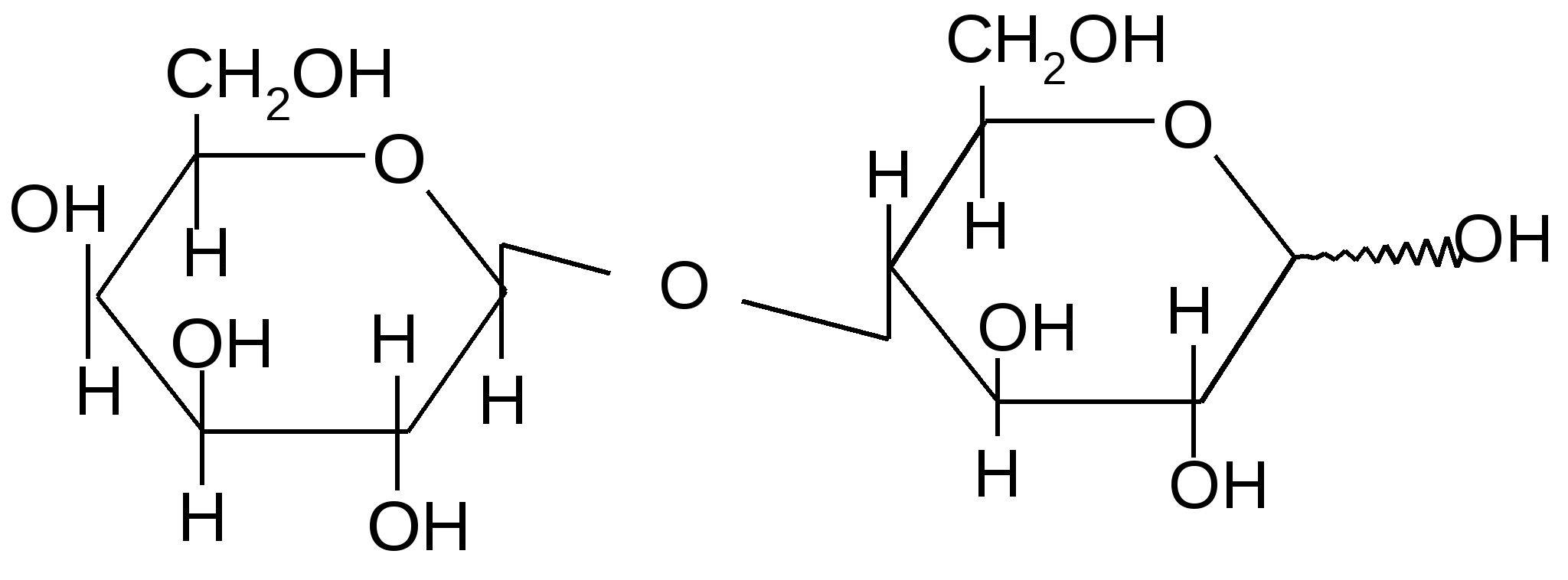  ,D–галактопиранозил–1,4-,D–глюкопираноза ,D–галактопиранозил–1,4-,D–глюкопираноза
Дисахариды, содержащие свободный полуацетальный гидроксил, подобно моносахаридам, способны к равновесным превращениям - и - аномеров через открытую форму. Для них характерно явление мутаротации в свежеприготовленных растворах.
Цикло-цепная таутомерия дисахаридов
Рассмотрим явление цикло-цепной таутомерии на примере целлобиозы.
Этот дисахарид образуется при неполном гидролизе целлюлозы. Состоит из двух ,D–глюкопиранозных остатков, соединенных между собой -1,4-гликозидной связью. Во втором остатке содержит свободную полуацетальную (гликозидную) группу; в водном растворе переходит в открытую таутомерную форму:
  
-целлобиоза
   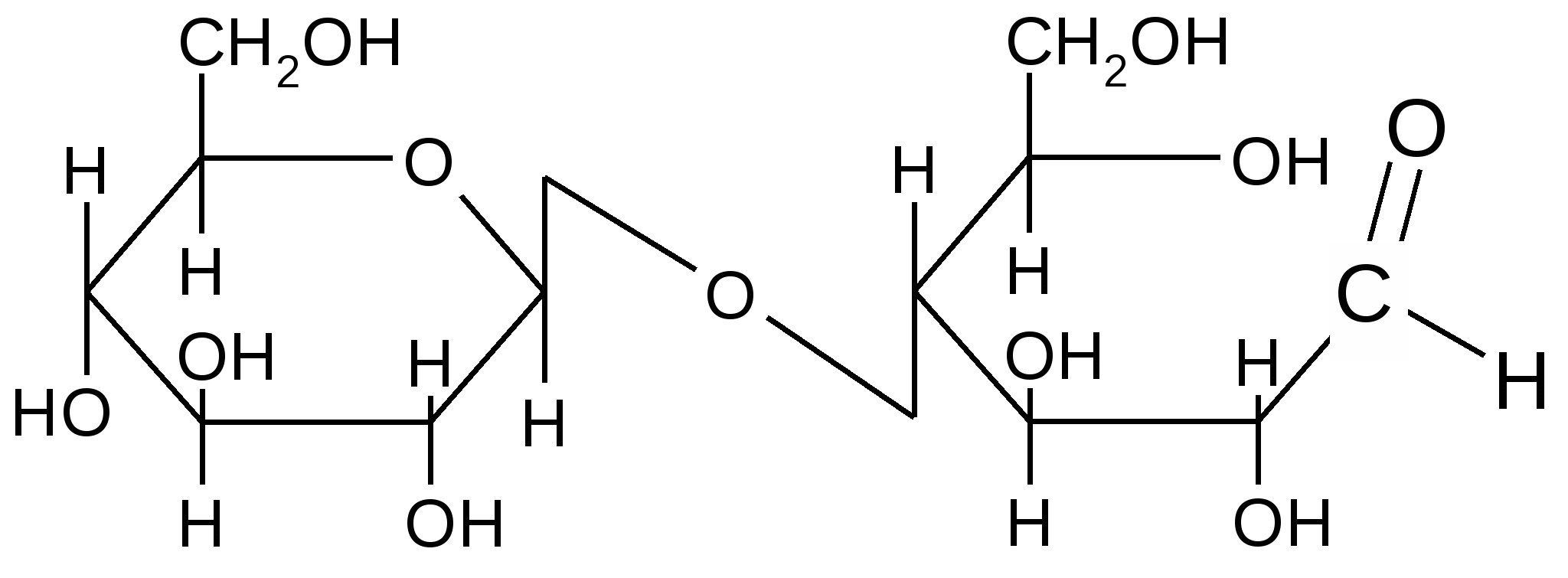
 Открытая форма целлобиозы Открытая форма целлобиозы
(, D–глюкопиранозил–1,4–D–глюкоза)
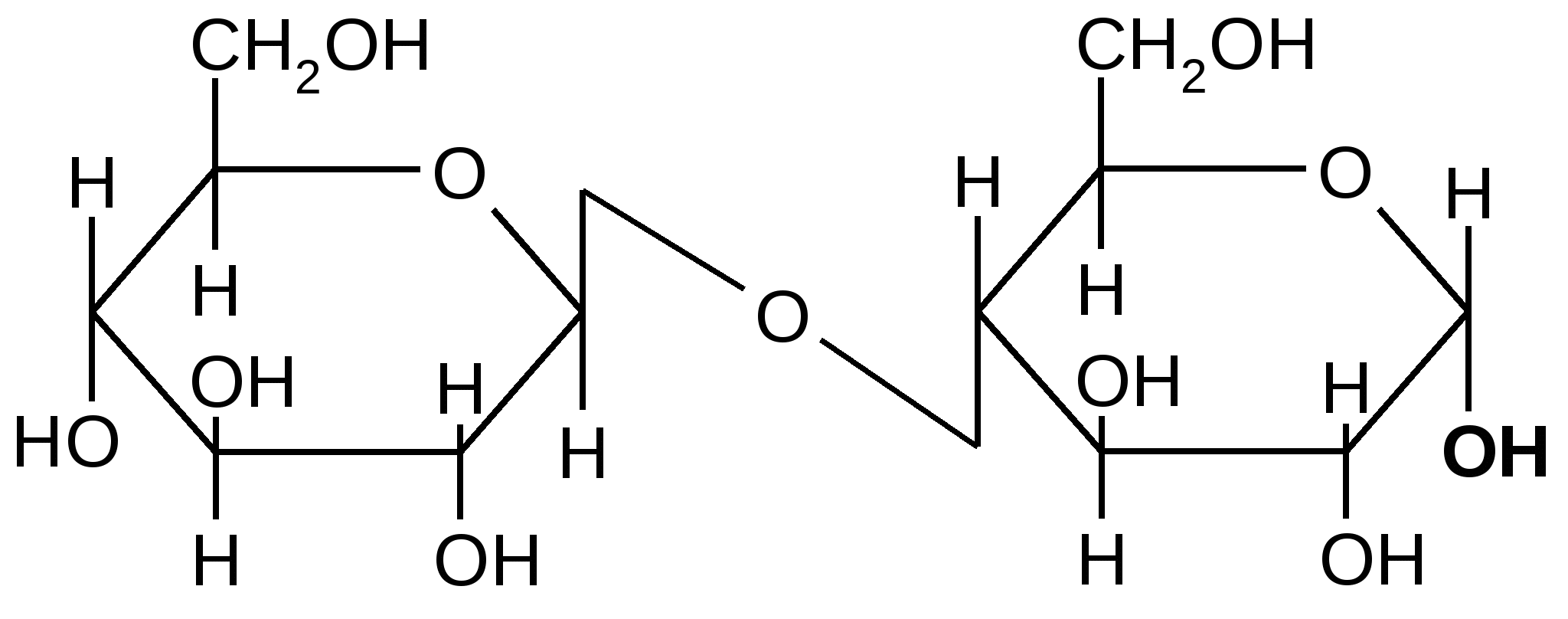
  -целлобиоза -целлобиоза
Химические свойства дисахаридов
По химическим свойствам дисахариды классифицируются на восстанавливающие (мальтоза, лактоза, целлобиоза) и невосстанавливающие (сахароза).
Молекулы восстанавливающих дисахаридов при участии свободного полуацетального гидроксила способны к образованию открытой формы, альдегидная группа которой восстанавливает ионы металлов: Ag+, Cu2+. Для доказательства восстанавливающей способности сахаров можно использовать реакции «серебряного зеркала», Троммера или реакцию с реактивом Феллинга (см. лабораторную работу).
Реакция «серебряного зеркала»:
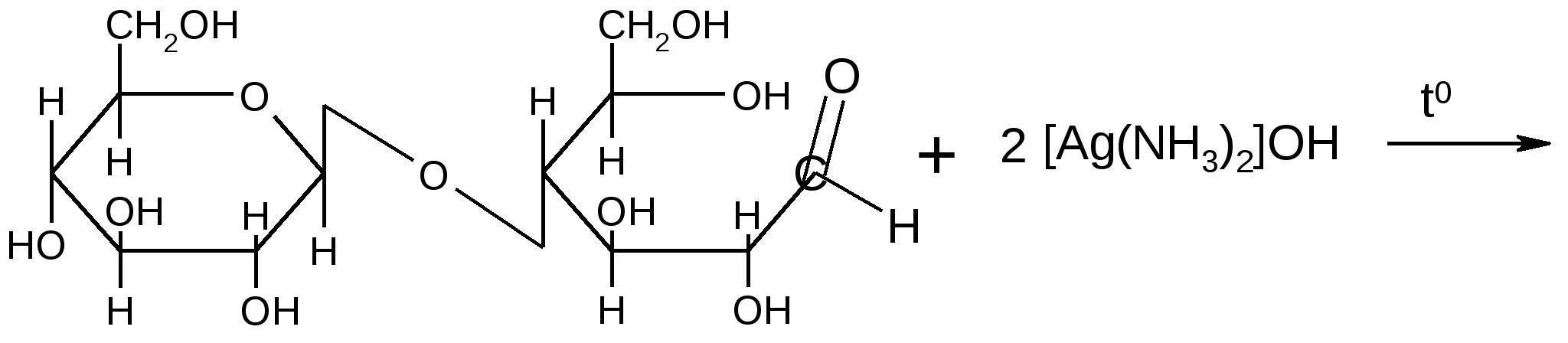
Открытая форма целлобиозы
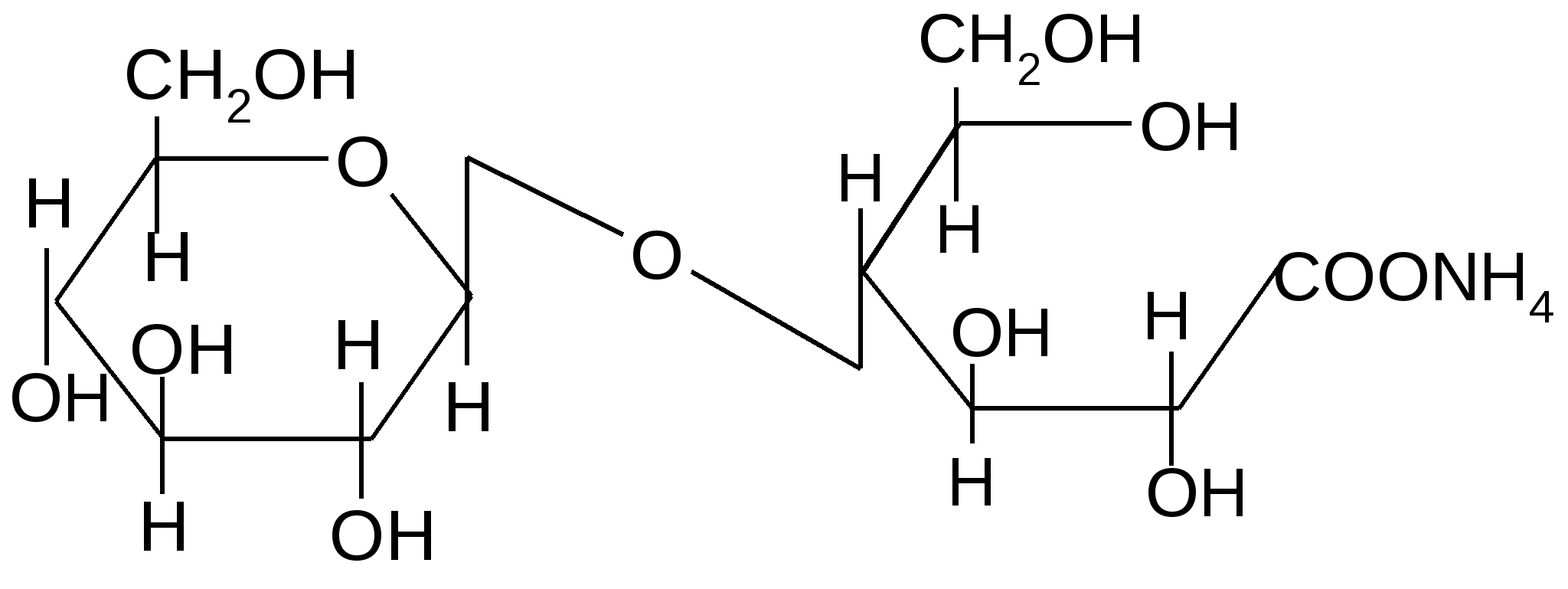
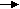 2Ag + 3NH3 + H2O + 2Ag + 3NH3 + H2O +
Целлобионовой кислоты соль аммония
(,D–глюкопиранозил–1,4–D–глюконат аммония)
Для невосстанавливающих дисахаридов такие реакции неосуществимы, так как в их структуре отсутствует свободный полуацетальный гидроксил; они не способны переходить в открытую таутомерную форму; не мутаротируют в свежеприготовленных водных растворах.
Н
апример, сахароза – содержится в сахарном тростнике (до 20 %), сахарной свекле (16–21 %), различных фруктах, ягодах, овощах. Молекула сахарозы образована из остатков ,D–глюкопиранозы и ,D–фруктофуранозы, соединенных между собой 1,2–гликозидо-гликозидной связью:
,D– глюкопираноза ,D–фруктофураноза
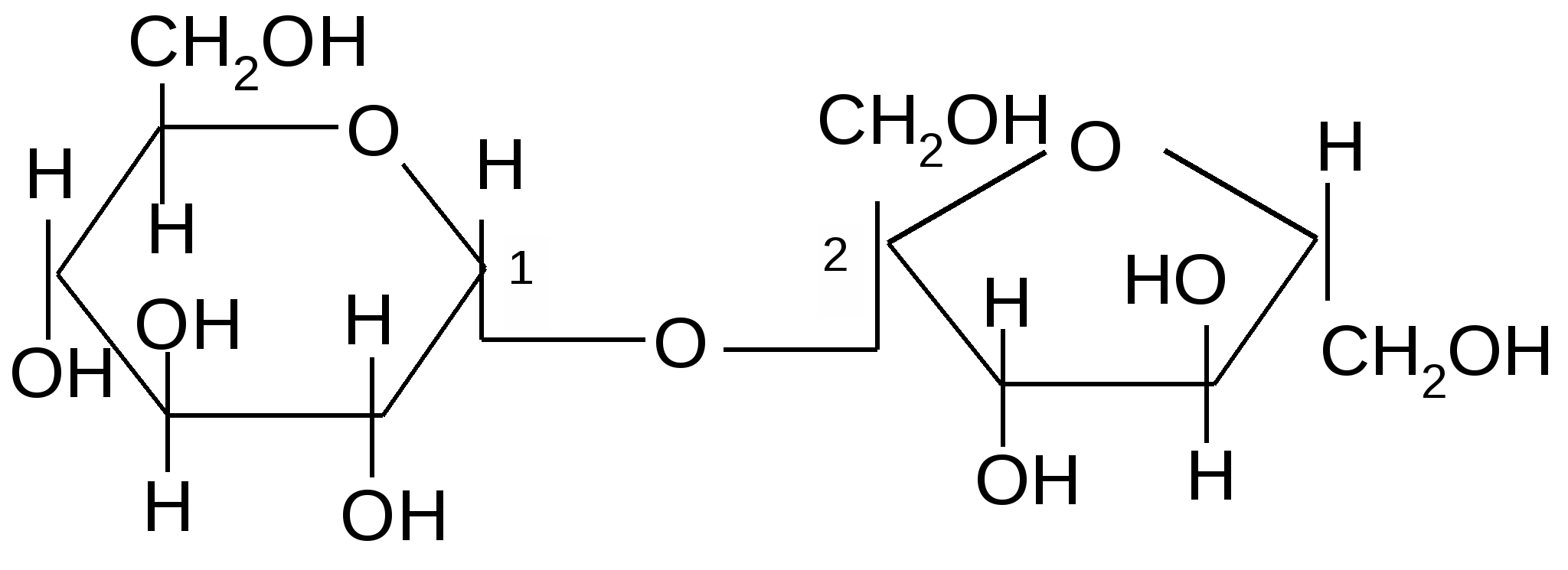
 
,D–глюкопиранозил-1,2-,D-фруктофуранозид
В молекуле сахарозы оба гликозидных гидроксила моносахаридных звеньев участвуют в образовании 1,2–гликозидо-гликозидной связи. Таким образом, сахароза не способна к цикло-цепной таутомерии; растворы сахарозы не мутаротируют. Сахароза – невосстанавливающий дисахарид.
Как гликозид сахароза способна к кислотному гидролизу с образованием D–глюкозы и D–фруктозы (см. лабораторную работу). В результате кислотного гидролиза удельное вращение раствора сахарозы (+66,6°) меняет свой знак на противоположный (отрицательный) из-за относительно большей величины удельного вращения фруктозы:
D20 = + 52,5° для D-глюкозы; – 92,0° для D–фруктозы.
Смесь продуктов гидролиза сахарозы называется инвертным сахаром (от лат. inversia – переворачивание); содержится в искусственном меде. Натуральный пчелиный мед также содержит свободную D-глюкозу и D-фруктозу (до 37%), но состав меда несравненно более разнообразный. Мед содержит еще и мальтозу, сахарозу, белки (в том числе и ферменты), органические кислоты (яблочную, лимонную, глюконовую), витамины и микроэлементы, алкалоиды и красящие вещества.
|
 Скачать 1.67 Mb.
Скачать 1.67 Mb.