Тема Соединения со смешанными функциями Гидроксиальдегиды и гидроксикетоны. Гидрокси и оксокислоты Цель занятия
 Скачать 1.67 Mb. Скачать 1.67 Mb.
|
ЭнантиомерыОтносительная и абсолютная конфигурация. Определение абсолютной конфигурации стало возможным только с появлением современных физико-химических методов (рентгеноструктурного анализа) в 50-х годах. Однако нет необходимости устанавливать ее для каждого соединения. Можно охарактеризовать их путем сравнения конфигураций с абсолютной конфигурацией эталонных (ключевых) соединений, т. е. определить их относительную конфигурацию. За такой эталон условно принят глицериновый альдегид, предложенный в 1906 г. Н.А. Розановым:  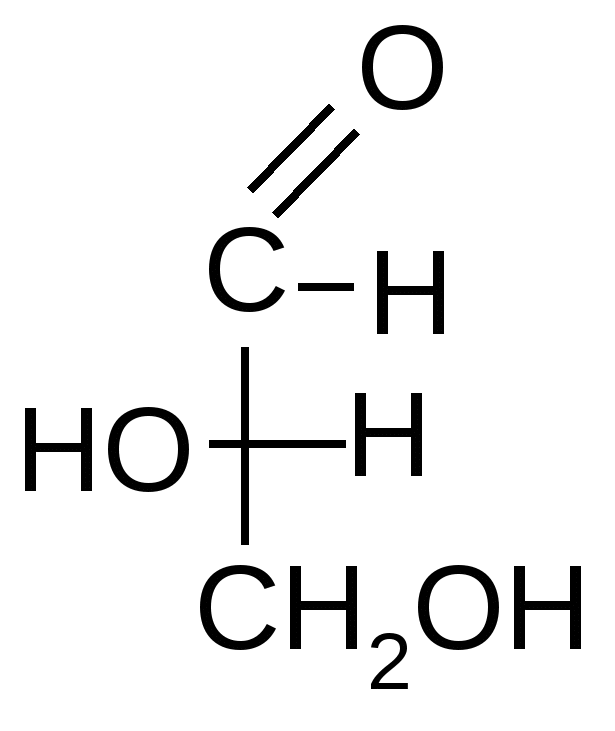 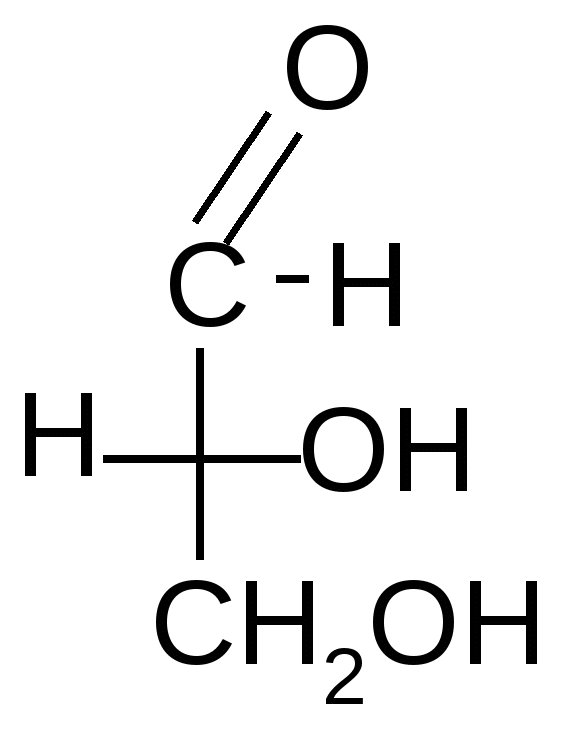 D- глицериновый L-глицериновый альдегид альдегид Считается, что все вещества, родственные глицериновому альдегиду по конфигурации хирального центра, т.е. с расположением групп – ОН, -NH2 , - Hal справа, относятся к D–ряду, слева – к L– ряду. Например: 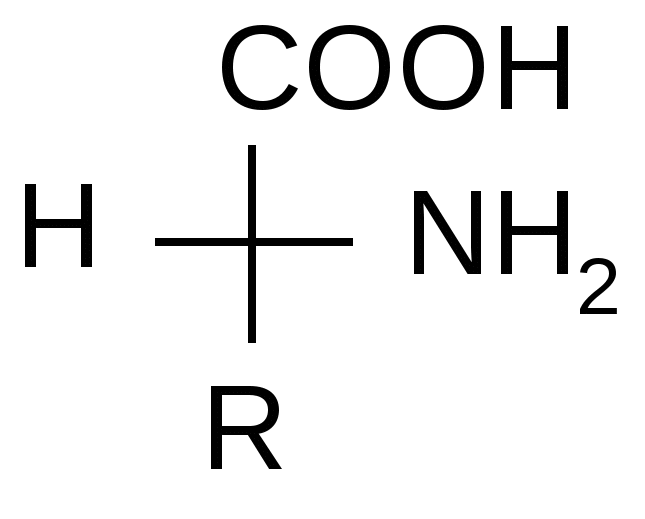 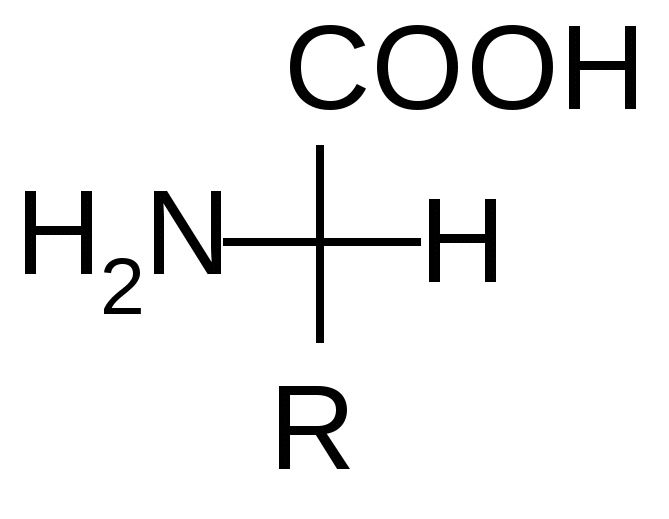 D - аминокислота L – аминокислота Запомним, что D и L указывают на относительную конфигурацию молекулы. Познакомимся с некоторыми свойствами подобных молекул. Хиральным соединениям свойственна способность вращать плоскость поляризованного света вправо (+) или влево (-), что называется оптической активностью. Отсюда и другое название энантиомеров – оптические изомеры. Условиями оптической активности являются:
Мерой оптической активности является D - удельное вращения; характеризует угол и направление вращения плоскости поляризованного света. Знак вращения (+) или (-) не связан с конфигурацией D и L и определяется только инструментально на приборе – поляриметре или сахариметре (для сахаров). Например, 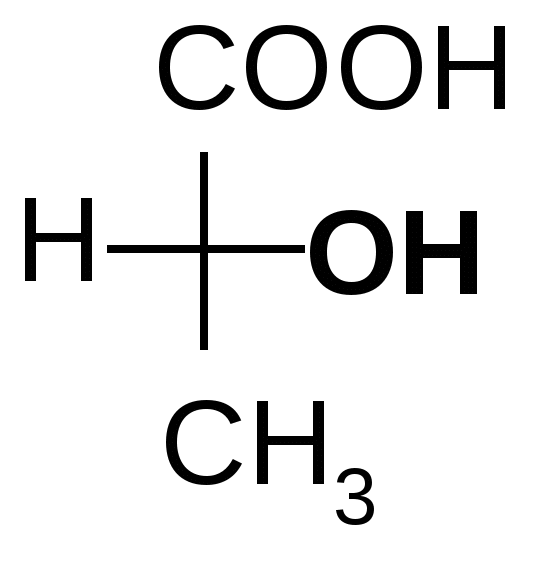 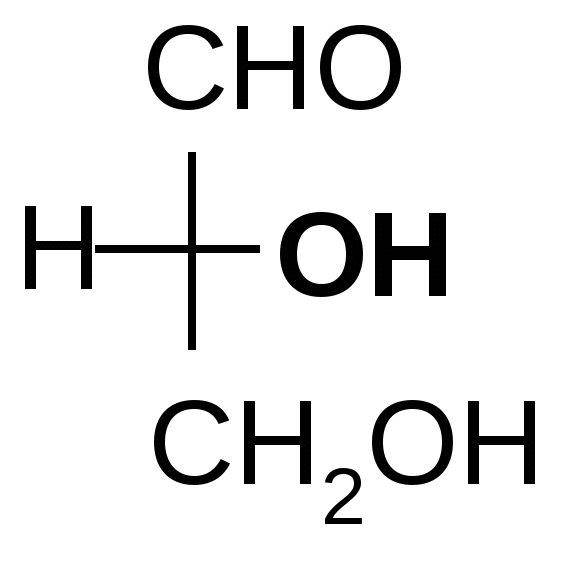 D(-) –молочная D(+)- глицериновый кислота альдегид Многие биологически важные вещества содержат в молекуле более одного центра хиральности. Подсчет числа стереоизомеров производится по формуле N= 2n, где n – число хиральных центров. Представителем соединений с двумя центрами хиральности служит винная кислота. Рассмотрим этот пример подробнее. У винной кислоты n=2, т.е. N= 22 = 4. 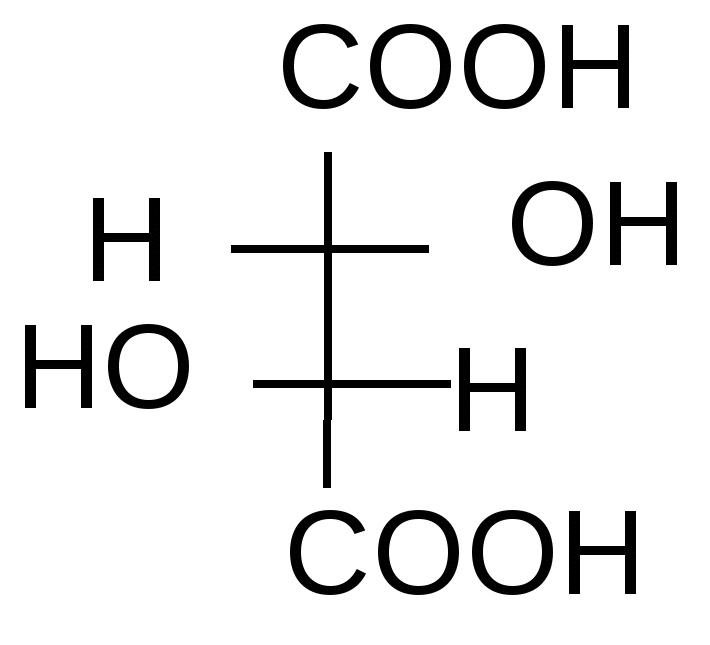 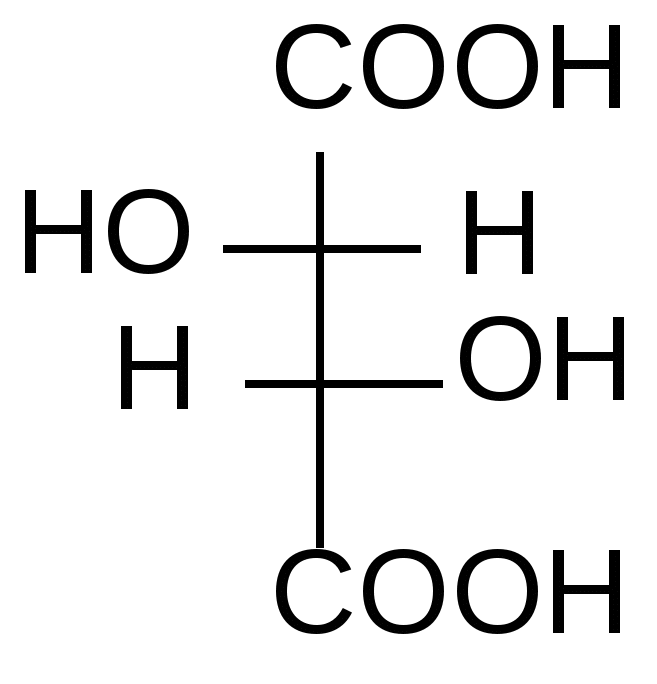 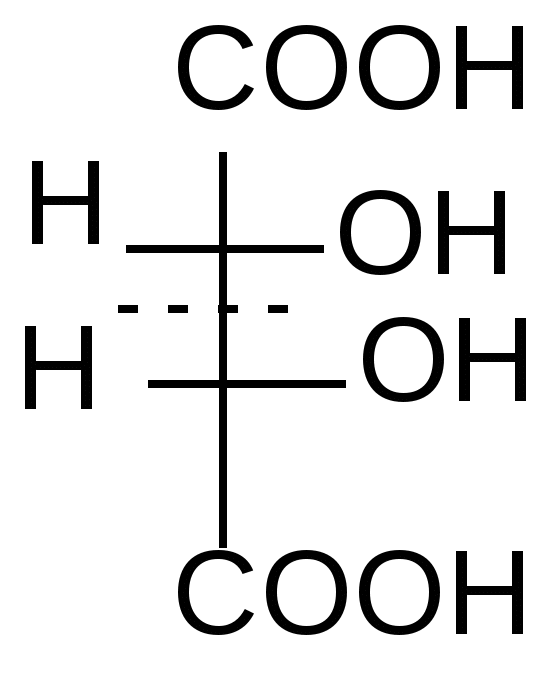 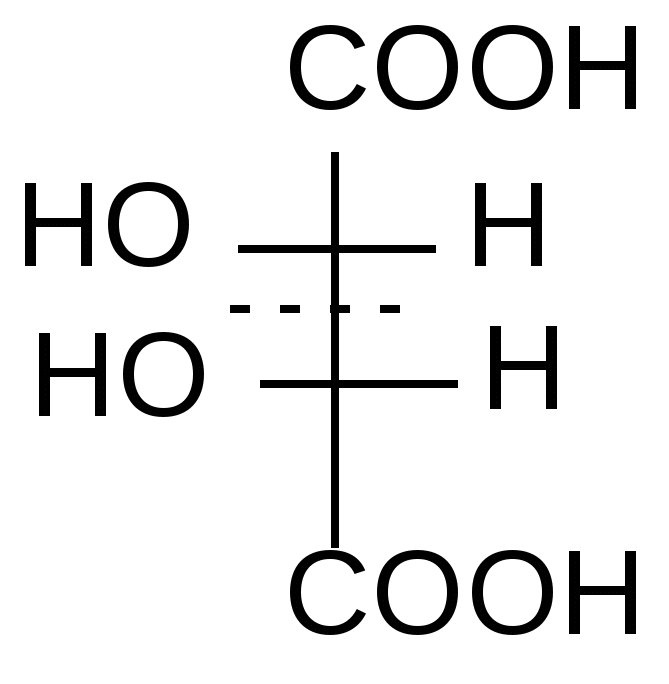 1 2 3 4
1 и 2 – это энантиомеры (D и L). Они отличаются не по физическим и химическим свойствам, а только знаком вращения плоскости поляризованного света. Формулы 3 и 4 являются идентичными. Формулы 1 и 3, 2 и 3 являются пространственными изомерами, но не зеркальными, это диастереомеры. Они отличаются по физическим и химическим свойствам. При отнесении энантиомеров к D– или L-ряду пользуются «оксикислотным ключом», т.е. сравнивают со стандартом тот хиральный центр, который остался без изменения при переходе от него. В данном случае это верхний хиральный центр (приведите путь превращения глицеринового альдегида в винную кислоту). D– и L- энантиомеры проявляют оптическую активность. Мезовинная кислота – типичный пример молекулы, содержащей центры хиральности, но в целом являющейся ахиральной из-за наличия плоскости симметрии и потому не проявляющей оптическую активность. Рацемат– это смесь равных количеств энантиомеров. Оптической активностью не обладает, вследствие компенсации вращения. Таким образом, у винной кислоты существуют 4 формы: 2 энантиомера (D- и L-), 1 мезо-форма и 1 рацемическая смесь. Рацемические смеси получаются синтетическим путем. Поскольку природные источники не могут удовлетворить потребности современной биоорганической и биологической химии в разнообразных оптически активных соединениях, то либо расщепляют рацематы, либо ведут асимметрический синтез. Существует несколько способов расщепления рацематов: а) механический отбор кристаллов по их форме – исторически первый метод, примененный Луи Пастером; б) биохимический (ферментативный) метод; в) химический – через диастереомеры; г) хроматографический на оптически активных сорбентах. Глоссарий Лактон – внутренний циклический сложный эфир, образующийся при нагревании - и -гидроксикислот . Лактид – циклический сложный диэфир, образующийся при нагревании - гидроксикислот; имеет две сложноэфирные связи. Ацетоуксусный эфир – этиловый эфир ацетоуксусной кислоты. Таутомерия – явление существования в растворе равновесных изомерных форм, способных переходить в друг в друга; равновесная динамическая изомерия. Кето-енольная таутомерия – равновесие между кетонной и енольной формами Стереоизомеры – это изомеры, отличающиеся пространственным расположением атомов в молекуле. Плоскость симметрии – это воображаемая плоскость, проходящая через молекулу или атом углерода с его заместителями и делящая молекулу на две симметричные части. Оптическая активность – способность вещества вращать плоскость поляризованного света вправо или влево. Хиральность – отсутствие плоскости симметрии, несовместимость со своим зеркальным изображением. Энантиомеры – это стереоизомеры, молекулы которых относятся между собой как предмет и несовместимое с ним зеркальное изображение. Диастереомеры – стереоизомеры, не являющиеся зеркальным отражением друг друга, обладающие различными физико-химическими свойствами. Рацемическая смесь (рацемат) – эквимолярная смесь энантиомеров (1:1) Тема 6. АМИНОКИСЛОТЫ. ПЕРВИЧНАЯ СТРУКТУРА БЕЛКОВ И ПЕПТИДОВ Цель занятия:сформировать представление о стереохимии и реакционной способности аминокислот на основе их строения; научиться составлять первичную структуру пептидов и характеризовать их физико-химические свойства в зависимости от аминокислотного состава. Конкретные задачи 1. Студент должен знать: основы стереохимии - аминокислот; структурные формулы и тривиальные названия 20 протеиногенных аминокислот; классификацию аминокислот на основе физико-химических свойств их радикалов; общие и специфические свойства - аминокислот. 2. Студент должен уметь: определять стереохимический ряд аминокислот, писать формулы Фишера для энантиомеров L - и D – ряда; составлять ди-, три-, тетрапептиды и фрагменты первичной структуры белков; изображать пространственное и электронное строение пептидной связи; давать физико-химическую характеристику пептидов на основе свойств радикалов аминокислот, входящих в их состав. Мотивация. Знание темы необходимо для изучения в курсе биохимии промежуточного обмена аминокислот, структурной организации белковых молекул, а также для понимания взаимосвязи структуры, физико-химических свойств и биологических функций белков. Вопросы для самоподготовки 1. Напишите общую формулу - аминокислот. 2. Объясните, почему - аминокислоты обладают оптической активностью. Напишите проекционные формулы L- и D – аланина. 3. Дайте классификацию - аминокислот на основе физико- химических свойств их радикалов. Выучить формулы всех 20 аминокислот. 4. Опишите химические свойства - аминокислот: амфотерность, изоэлектрическая точка аминокислот на примере аланина, лизина, глутаминовой кислоты; реакции аминокислот с азотистой кислотой и формальдегидом; реакции декарбоксилирования на примере гистидина, триптофана, глутаминовой кислоты; способность к образованию комплексных солей с катионами Cu2+. 5. Напишите схему реакции образования трипептида: Лиз – Ала – Сер. Охарактеризуйте его свойства. Этапы занятия и контроль усвоения знаний.
1-ый этап. Проверка преподавателем письменного выполнения домашнего задания по теме занятия и оценка его. 2-ой этап. Написание тест-контроля по предложенным билетам и оценка его результатов ( 0, 5, 10 баллов). 3-й этап. Устный опрос у доски. Написание общей формулы -амино- кислот. Обсуждение их физико-химических свойств (оптическая активность и оптическая изомерия, классификация на основе растворимости в воде боковых радикалов, заряд, изоэлектрическая точка). Рассмотрение основных биологически важных химических свойств - аминокислот (амфотерность, способность к образованию биполярных ионов и комплексных солей, декарбоксилирование, пути дезаминирования, образование пептидов). Составление пептидов и характеристика их свойств. Рассмотрение электронного и пространственного строения пептидной связи, значения ее транс-конфигурации для образования вторичной структуры белка. 4-й этап. Самостоятельное изучение студентами принципа метода и этапов выполнения лабораторных работ. Выполнение лабораторных работ по теме 5-й этап. Оформление протоколов в виде таблицы, данной в рабочих тетрадях. 6-й этап.. Проверка преподавателем написания уравнений проделанных реакций, наблюдений, выводов. Обсуждение практической значимости каждой работы, оценка практических навыков, приобретенных студентами. ____________________________ Теория Аминокислотами называются органические соединения, содержащие карбоксильную и аминогруппу: (NH2)m-R –(COOH)n Классификация: 1) по количеству СООН- и NH2-групп аминокислоты делятся на моноаминокарбоновые, диаминокарбоновые, моноаминодикарбоновые и т.д. 2) по взаимному расположению двух функциональных групп: , , - и т.д. аминокислоты. Изомерия: 1) по строению углеродного скелета; 2) оптическая (стерео) изомерия. Формула Название Биологическая роль NH2-CH-COOH* - аланин Входит в состав пеп- ( - аминопро- тидов, белков СН3 пионовая кислота) H2N-CH2-CH2-COOH -Аланин Входит в состав (-аминопро- пантотеновой кислоты пионовая кислота) (витамина В3) H2N-CH2-CH2- СН2 –COOH -Аминомасляная Природный транкви- кислота (ГАМК) лизатор Примечание: * - оптически активна С биологической точки зрения огромное значение имеют - аминокислоты. Это «кирпичики», из которых построены молекулы белка –протеиногенные аминокислоты. Основным источником - аминокислот для живого организма служат белки пищи. Большинство - аминокислот синтезируются в организме, но некоторые, необходимые для синтеза белков, не синтезируются в организме или синтезируются в недостаточном количестве и должны поступать извне. Такие аминокислоты называются незаменимыми, это: Валин, лейцин, изолейцин, фенилаланин, метионин, триптофан, треонин, лизин, гистидин, аргинин. Классификация -аминокислот. Общая структурная формула протеиногенных аминокислот:
R Различаются они только боковыми цепями (R-группами), которые у разных аминокислот неодинаковы по структуре, суммарному заряду (полярности) и растворимости в воде (гидрофильности или гидрофобности). Поэтому целесообразно классифицировать протеиногенные кислоты на основе физико-химических свойств их R- групп. Для краткого обозначения протеиногенных аминокислот используют трехбуквенные сокращения их тривиальных названий. I. Аминокислоты с неполярными (гидрофобными) R-группами (8): 1. Аланин (Ала): 2. Валин (Вал):  NH2-CH-COOH NH2-CH-COOH NH2-CH-COOH NH2-CH-COOH   CH3 CH3-CH CH3  3. Изолейцин (Иле) 4. Лейцин (Лей) NH2-CH-COOH NH2-CH-COOH    | | | |    СH-CH3 CH2 СH-CH3 CH2 CH2 CH-CH3 CH3 CH3   5. Метионин (Мет) 6. Фенилаланин (Фен) 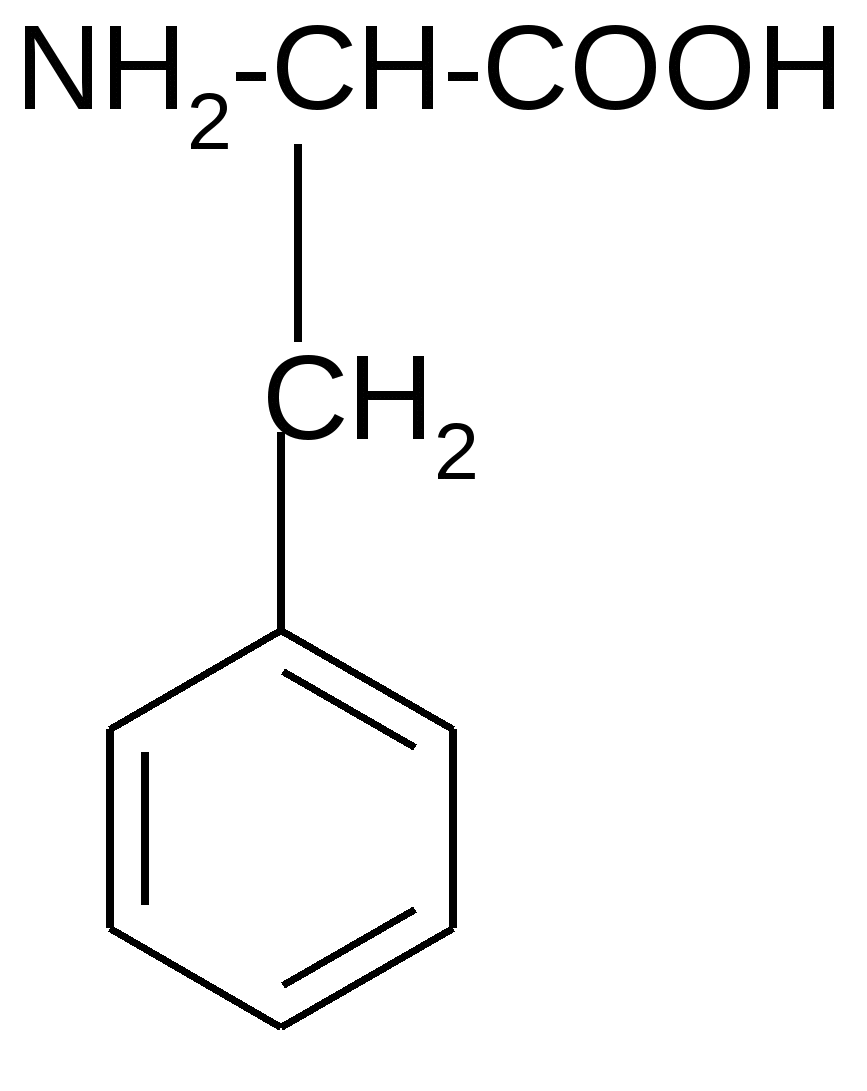 NH2-CH-COOH       (СН2)2 S CH3   7. Триптофан (Три) 8. Пролин (Про) 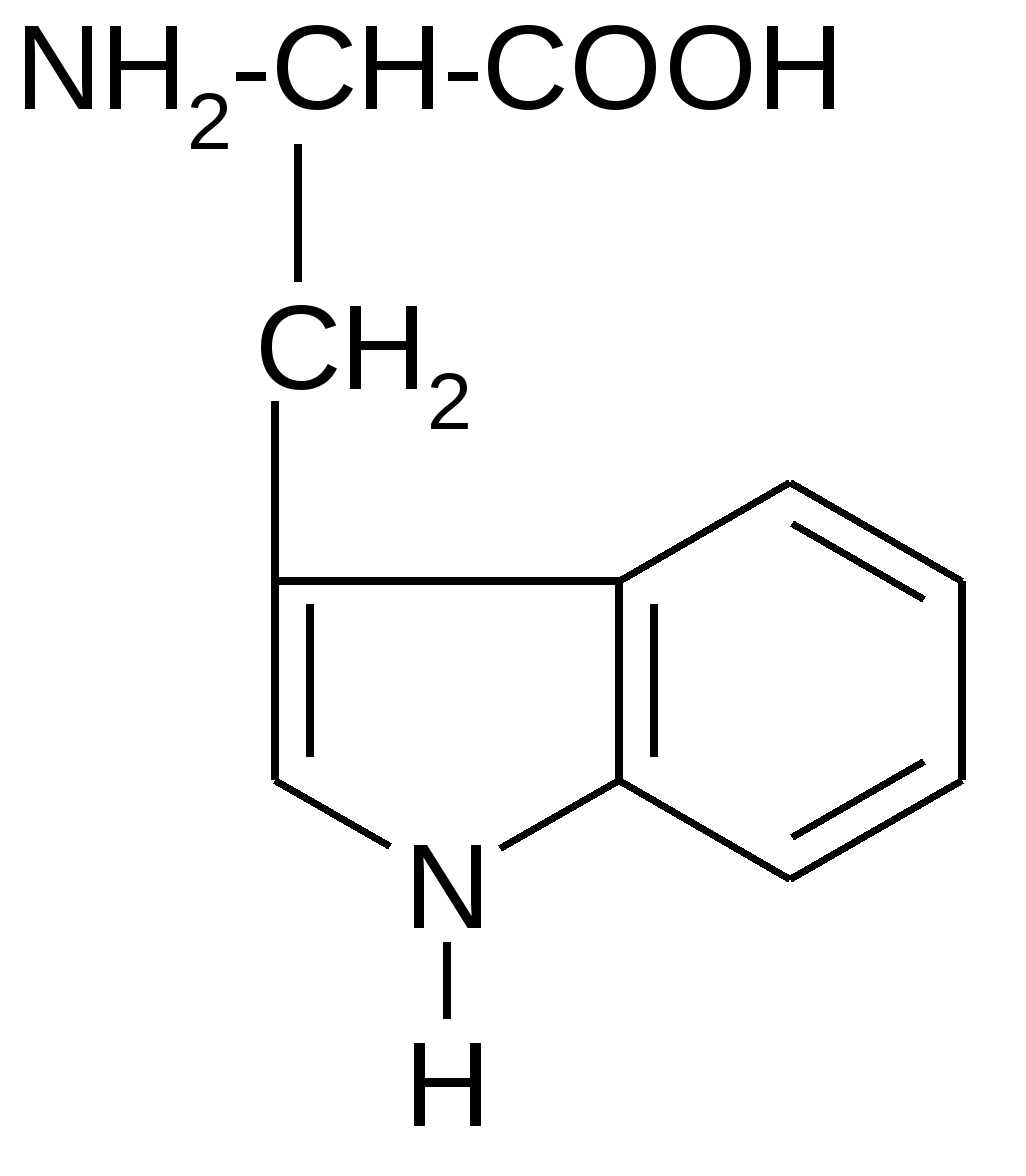 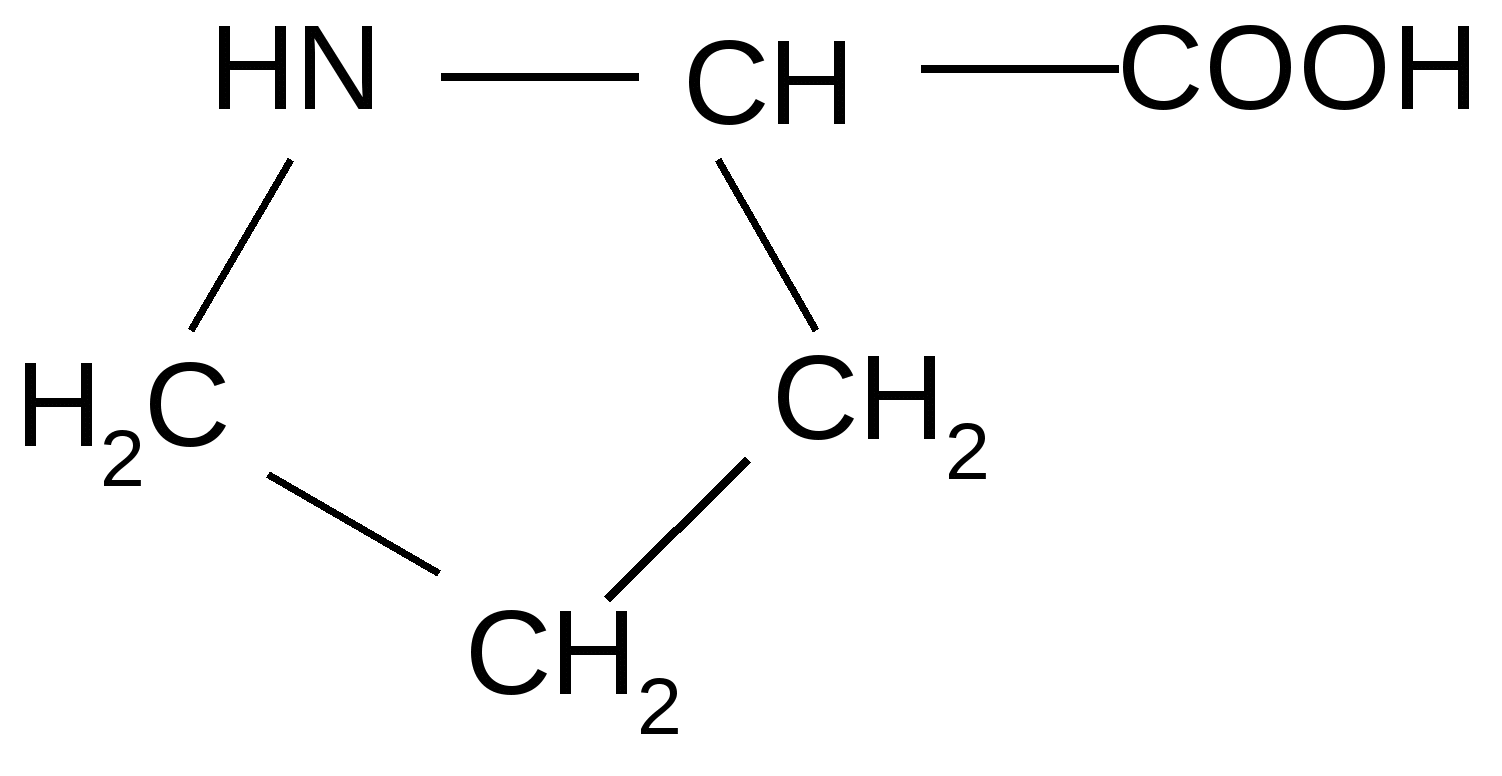         II. Аминокислоты с полярными (гидрофильными) незаряженными радикалами (7): 1. Глицин (Гли): Не содержит радикала (R=H). NH2-CH2-COOH НО-содержащие аминокислоты: 2. Серин (Сер): 3. Треонин (Тре): 4. Тирозин (Тир): NH2-CH-COOH NH2-CH-COOH 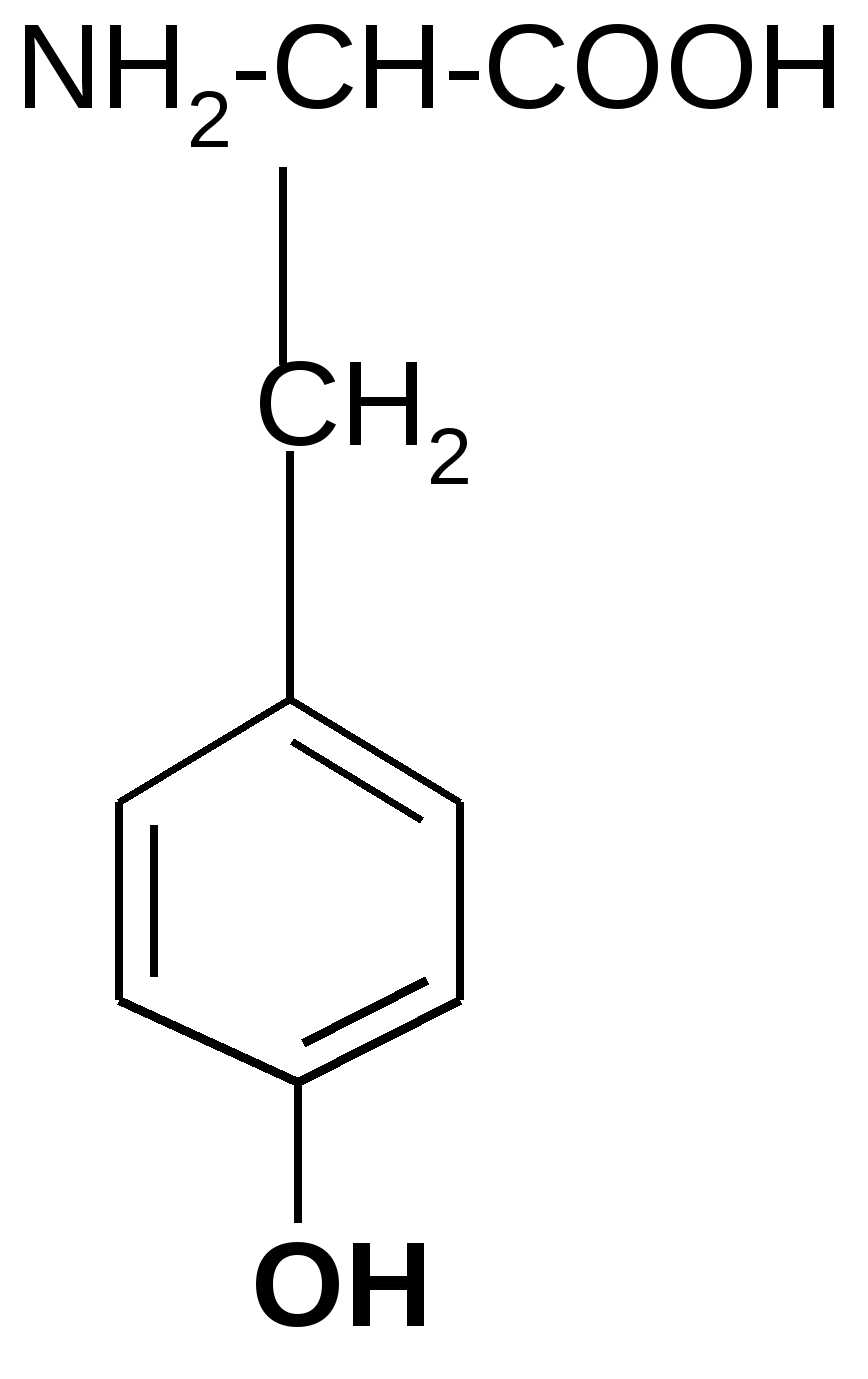 CH2 CH-CH3 OH OH SH-содержащие аминокислоты: 5. NH2-CH-COOH CH2 SH цистеин (Цис) Cледует отметить, что спиртовые и фенольные ОН-группы и тиоловая SH-группа проявляют в воде очень слабую кислотность по сравнению с карбоксильной –СООН-группой, поэтому их кислотными свойствами можно пренебречь. Амиды аминокислот, содержащие группу –С=О: NH2
NH2-СH-СOOH NH2-CH-COOH CH2 (CH2)2 C=O C=O NH2 NH2 Амидная группа проявляет, в отличие от аминов, очень слабые основные свойства в силу того, что неподеленная электронная пара азота включена в р, - сопряжение. О 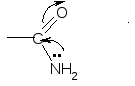 сновностью этой группы тоже можно пренебречь. сновностью этой группы тоже можно пренебречь. III. Аминокислоты с полярными (гидрофильными) положительно заряженными радикалами (3): 1. Лизин (Лиз): : NH2-CH-COOH +NH3-CH-COO + OH +H2O (CH2)4 (CH2)4 : NH2 +NH3 2. Аргинин (Арг): NH2-CH-COOH + H2O +NH3-CH-COO- + -OH (CH2)3 (CH2)3 : NH NH C=NH C=+NH2 :NH2 NH2 В этом случае протонируется атом азота при двойной связи, так как его неподеленная электронная пара не включена в сопряжение. 3. Гистидин (Гис): 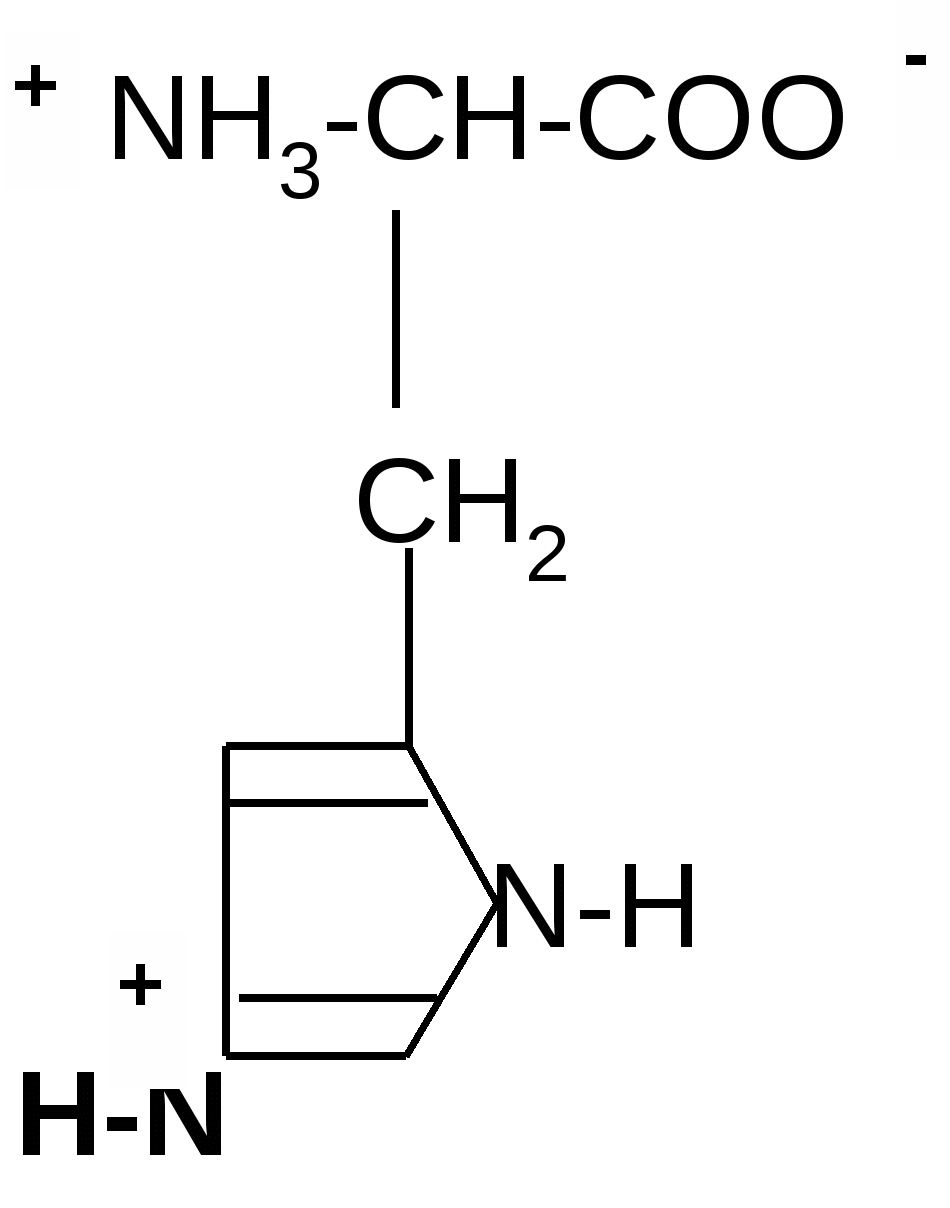 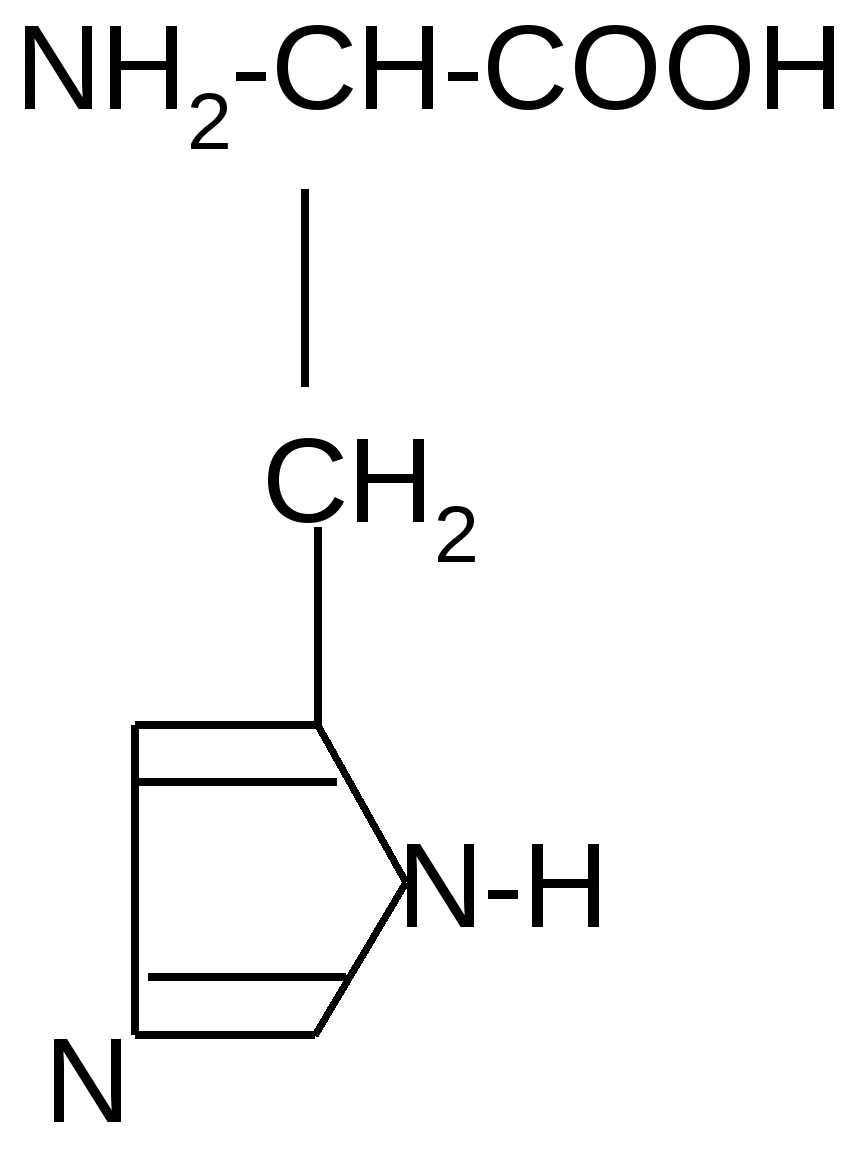 ˉ ˉ + H2O + -OH IV. Аминокислоты с полярными (гидрофильными) отрицательно заряженными радикалами (2):
NH2-CH-COOH +NH3-CH-COO + H+ CH2 CH2 COOH COO
NH2-CH-COOH +NH3-CH-COO + H+ (CH2)2 (CH2)2 COOH COO Во всех - -аминокислотах, за исключением глицина, - атом углерода связан с четырьмя различными замещающими группами и, следовательно, является асимметрическим, или хиральным. Такие молекулы встречаются в двух стереоизомерных формах и проявляют оптическую активность. Все аминокислоты, входящие в состав молекул белков, являются L-стереоизомерами. Химические свойства аминокислот I. Общие (неспецифические) свойства. 1. Все свойства карбоновых кислот (см. тему № 4). 2. Все свойства аминов. Свойства аминов Аминами называются органические производные аммиака, в которых один, два или три атома водорода замещены на углеводородные радикалы (первичные, вторичные и третичные амины). Все протеиногенные -аминокислоты – за исключением пролина – содержат первичную аминогруппу. а) Основные свойства ( способность образовывать соли с кислотами) -: обусловлены наличием неподеленной электронной пары на внешнем электронном уровне атома азота: + - (СH3)3N + HCl (CH3)3NHCl триметиламин триметиламмоний хлорид б) Нуклеофильные свойства проявляются в реакциях: - алкилирования аминов (получение аминов из аммиака и алкилгалогенидов): ·· + - + NH3 N   H3 + CH3 - CH2Cl C2H5NH3Cl H3 + CH3 - CH2Cl C2H5NH3Clэтиламмоний -NH4Cl хлорид  C2H5NH2 C2H5NH2Этиламин Дальнейшее алкилирование приведет ко вторичному амину, затем к третичному амину, который можно превратить в соль четвертичного аммониевого основания (реакция Гофмана). - ацилирования аминов, например: С  H3-CH2-NH2 + CH3-C=O CH3-C=O + HCl H3-CH2-NH2 + CH3-C=O CH3-C=O + HCl Cl NH2 Эти реакции встречаются в организме. Переносчиком ацетильной группы на нуклеофильные субстраты in vivo служит ацетилкофермент А. 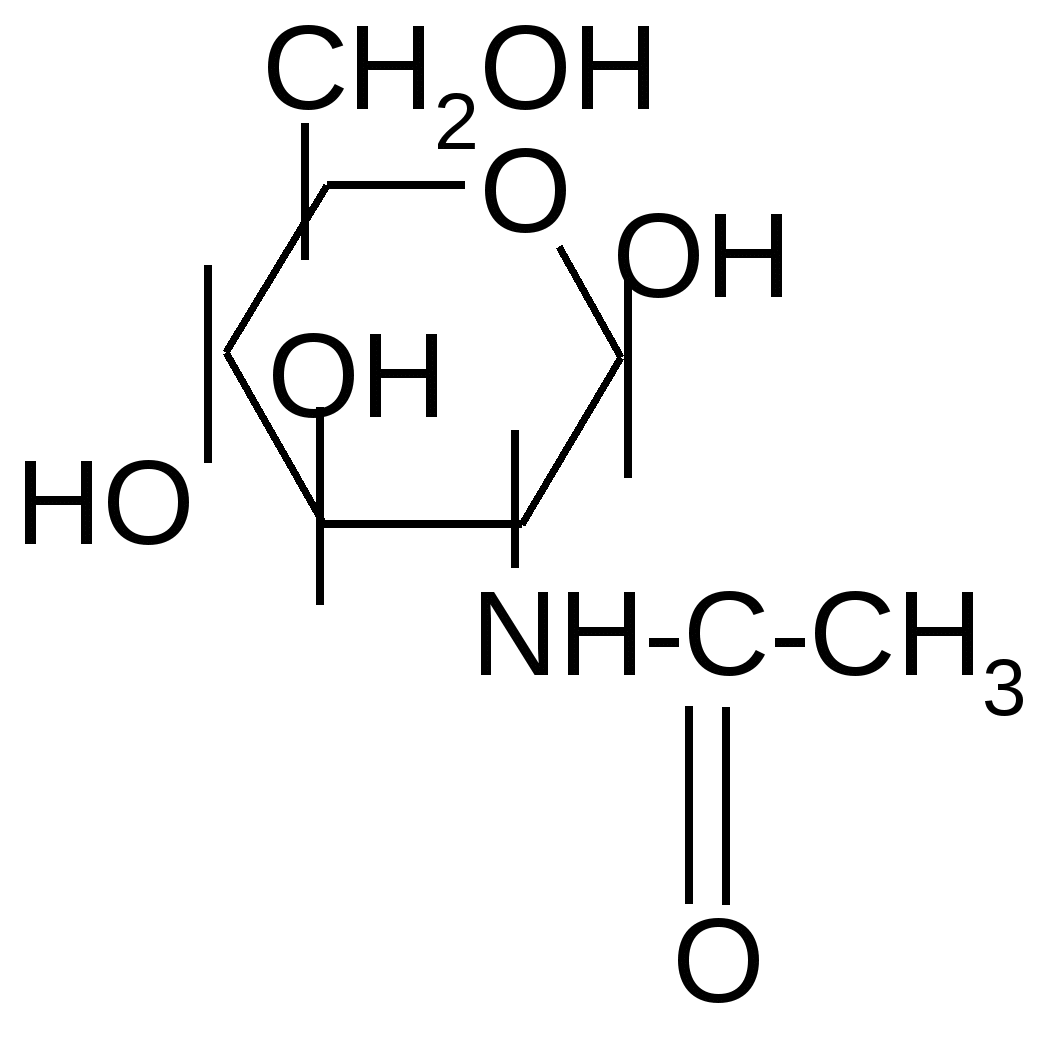 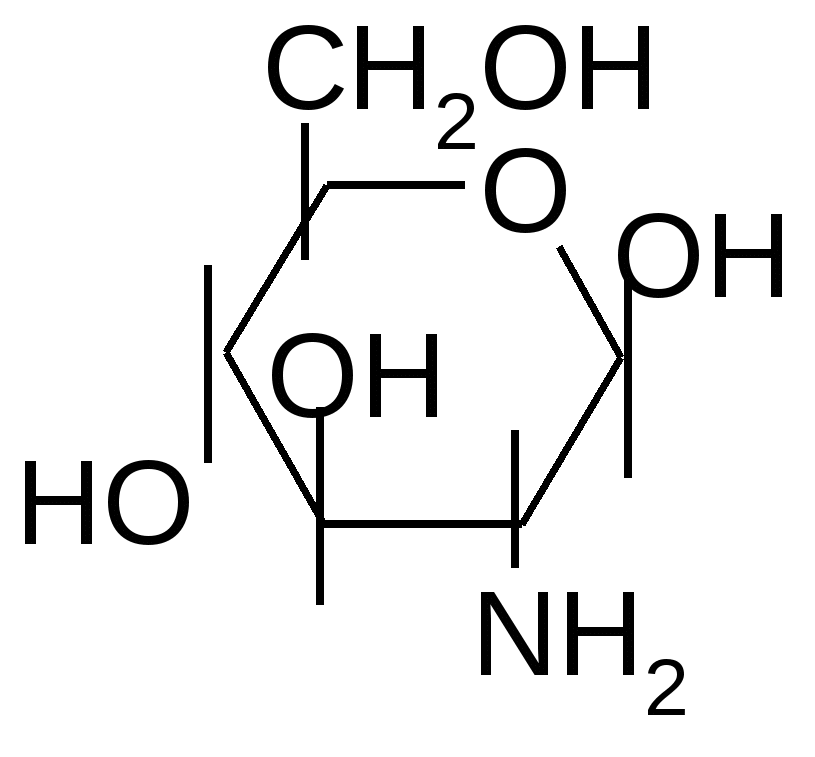  + СН3-С=О + KoA-SH + СН3-С=О + KoA-SH SKoA мономер хитина N-ацетилглюкозамин - взаимодействия аминов с альдегидами и кетонами (обсуждались в теме № 3). в) Реакция с азотистой кислотой – качественная реакция на класс аминов.  СH3-CH2-NH2 + H-O-N=O N2 + H2O + C2H5OH СH3-CH2-NH2 + H-O-N=O N2 + H2O + C2H5OHпервичный амин + -   (С2H5)2NH + HONO (C2H5)2NH2ONO (C2H5)2N-N=O (С2H5)2NH + HONO (C2H5)2NH2ONO (C2H5)2N-N=Oвторичный амин -H2O N–нитрозо- диэтиламин (желтый раствор) Третичные амины с азотистой кислотой не реагируют. Первичные ароматические амины дают очень реакционноспособные соли диазония (реакция диазотирования), которые дальше вступают в различные превращения (в том числе реакция азосочетания, например, с -нафтолом).
NH 2 – R – COOH + HCI == [ N+H3 – R – COOH] CI так и основные свойства: NH 2 – R – COOH + NaOH === NH 2 – R – COONa + H2O Амфотерность аминокислот проявляется и внутримолекулярно – в водном растворе все аминокислоты образуют внутренние соли: NH 2 – R – COOH === + NH 3 – R – COO- II. Специфические свойства обусловлены взаимным влиянием двух функциональных групп. -, - и - Аминокислоты при нагревании вступают в реакции, аналогичные реакциям соответствующих оксикислот.
Реакция идет межмолекулярно через промежуточное образование дипептидов: дипептидов: 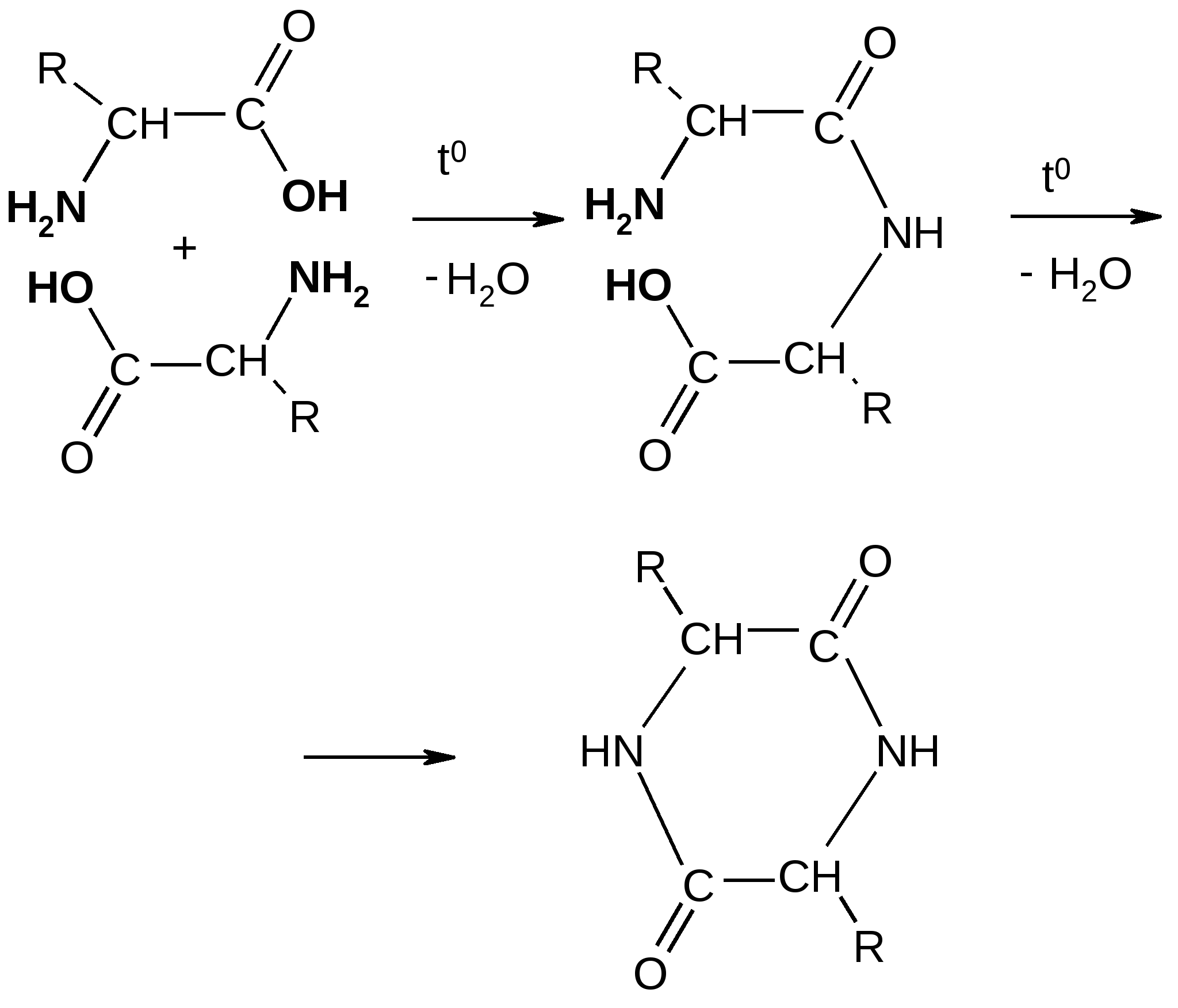 Дикетопиперазин 2. -Аминокислоты образуют непредельные кислоты: t° R  -CH-CH2-C=O R-CH=CH-C=O -CH-CH2-C=O R-CH=CH-C=O -NH3 NH2 OH OH 3. - и -Аминокислоты образуют циклические амиды, называемые - и - лактамами. Для них характерно таутомерное превращение (лактам лактим): t°  R-CH-CH2-CH2-C=O R-CH-CH2-CH2-C=O 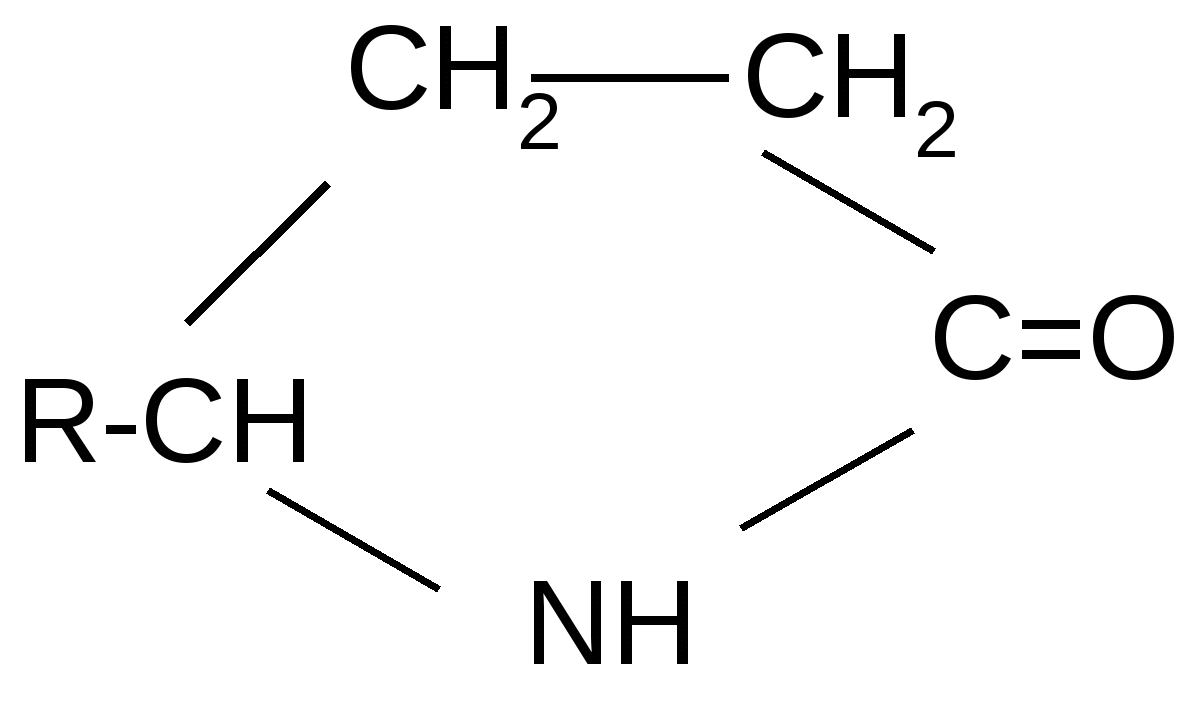 -H2O NH2 OH лактам 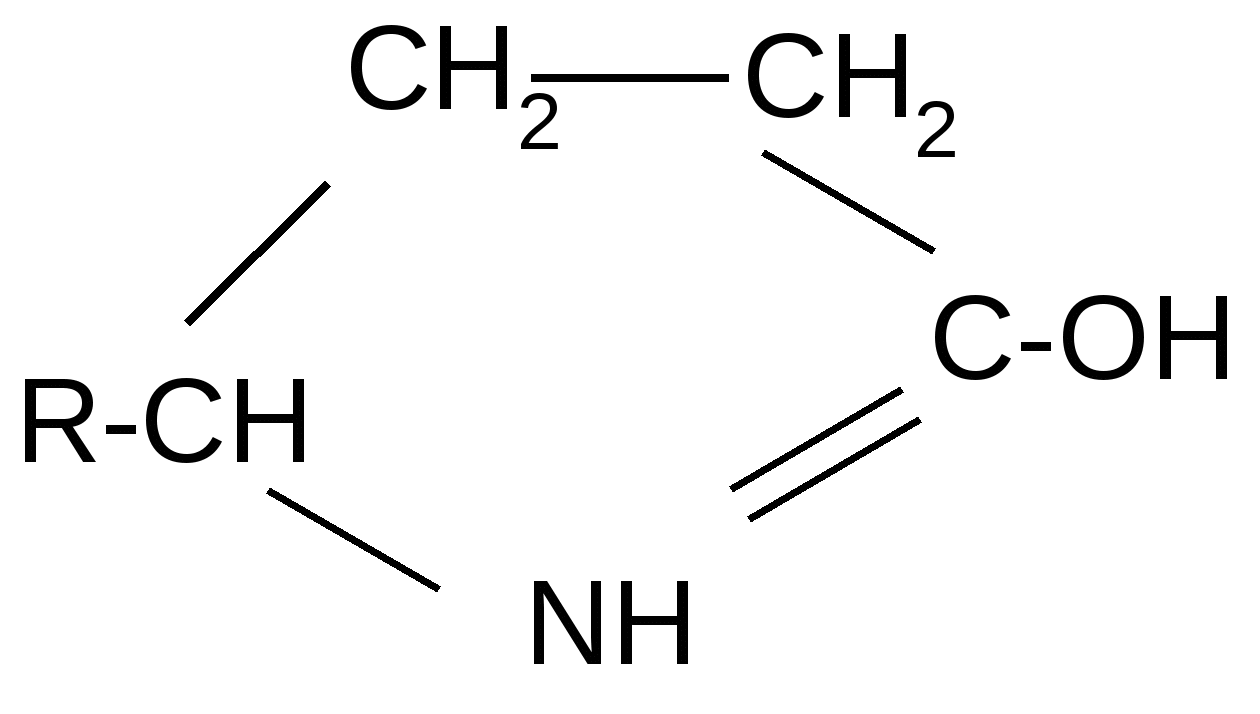 лактим III. Биологически важные реакции - аминокислот 1. Способность к образованию внутренних солей (биполярных, или «цвиттер» – ионов). Карбоксильная группа проявляет кислотные свойства, диссоциирует с отщеплением протона. Амино-группа, которая проявляет основные свойства, способна протонироваться по неподеленной электронной паре атома азота. В результате в водных растворах и в кристаллическом состоянии аминокислоты существуют в виде внутренних солей:     + +NH2-CH-COOH NH3-CH-COO- R R Суммарный заряд молекулы зависит от строения радикала R и рН среды: а) моноаминомонокарбоновая кислота: OH- + H+ + NH2-CH2-COO- -1 NH3-CH2-COO -0 NH3-CH2-COOH+1 б) моноаминодикарбоновая кислота:       + + + +NH2-CH-COO- -2 NH3-CH-COO- -1 NH3-CH-COO- ° HO- Н+ CH2 CH2 CH2 COO- COO- COOН  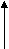 2Н+   + +NH3-CH-COOH +1 CH2 СOOH в) диаминомонокарбоновая кислота:       NH2-CH-COO- ° + NH3-CH-COO- +1 + NH3-CH-COOH +2 HO- Н+ (CH2 )4 ( CH2 )4 (CH2)4 - + NH3 +NH3 +NH3 2НО-   NH2-CH-COO- -1 (CH2)4 NH2 Свойство аминокислот изменять заряд при определенном значении рН, а следовательно, двигаться в электрическом поле к разным электродам лежит в основе метода электрофореза, который используется для разделения смесей аминокислот и белков. Значение рН среды, при котором суммарный заряд молекулы равен нулю, называется изоэлектрической точкой (ИЭТ, или рНi , или pI). В ИЭТ молекула теряет электрофоретическую подвижность, снижается растворимость белка в воде, он может выпадать в осадок. 2. Реакция декарбоксилирования: 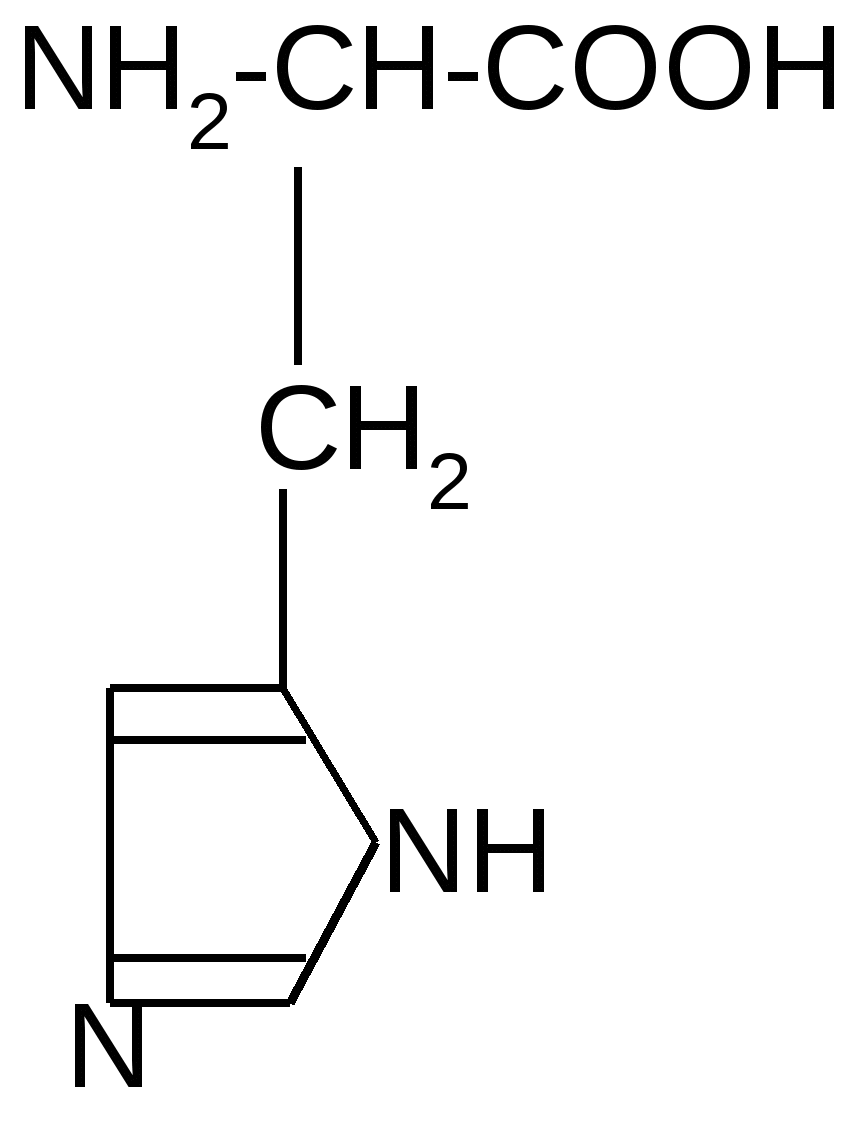 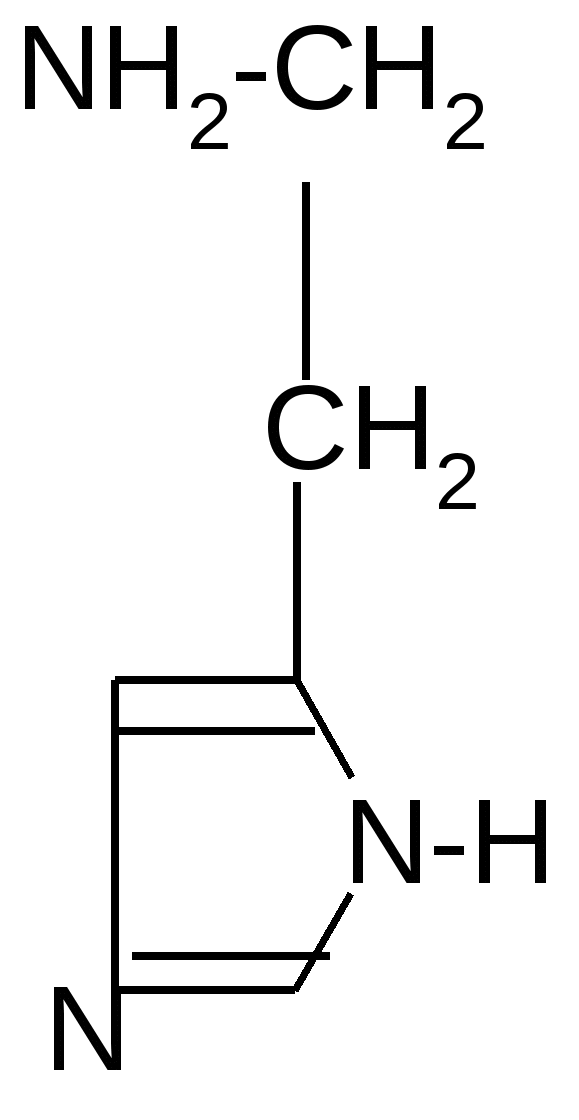 in vivo in vivo  декарбоксилаза CO2 +  in vitro in vitro t°, Ba(OH)2 гистидин гистамин 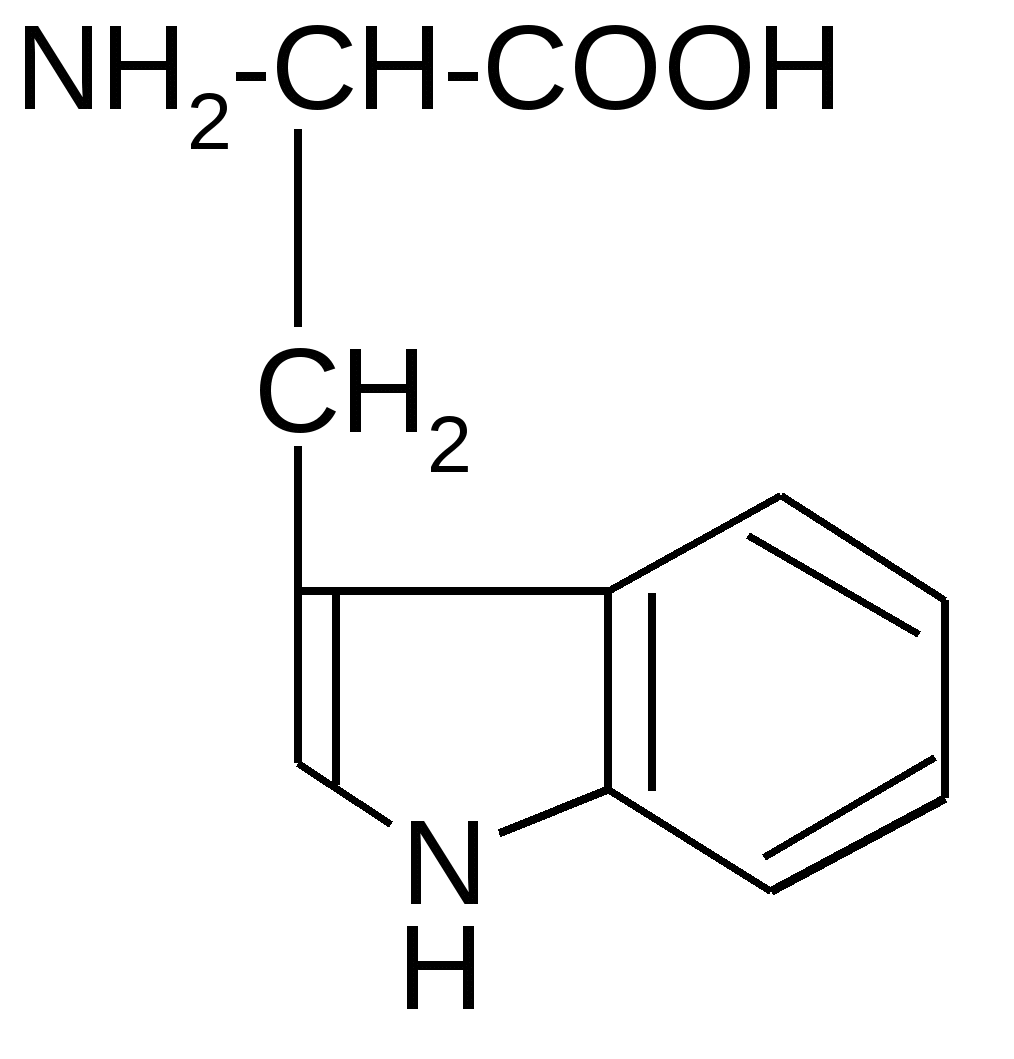 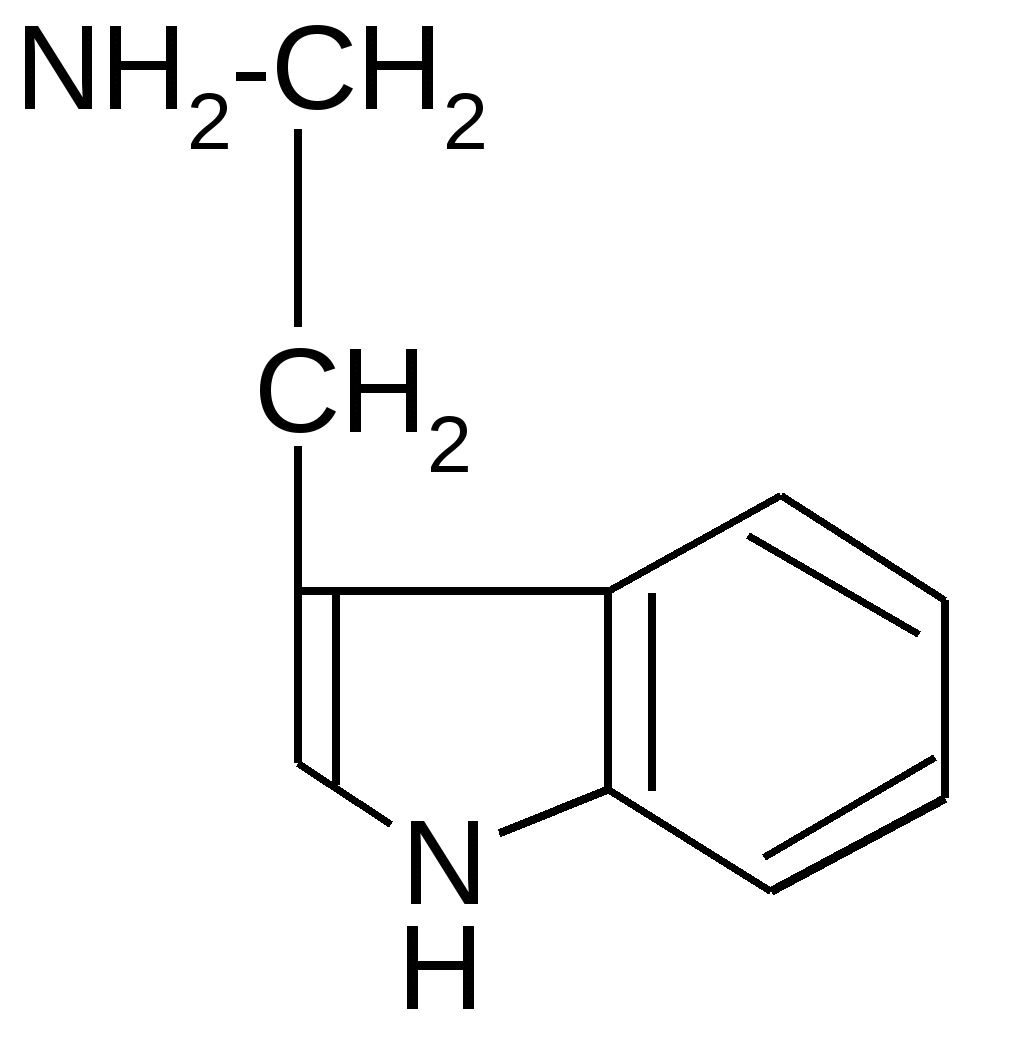  СО2 + СО2 + триптофан триптамин В результате реакции декарбоксилирования - аминокислот образуются биогенные амины, обладающие сильной физиологической активностью, многие из них являются аллергенами, большинство обладает сосудосуживающими свойствами (исключение – гистамин), участвуют в регуляции жизненно важных функций организма. 3. Реакции дезаминирования: а) дезаминирование по Ван-Слайку in vitro: N  H2-CH2-COOH + HONO N2 + HO-CH2-COOH + H2O H2-CH2-COOH + HONO N2 + HO-CH2-COOH + H2Oглицин гликолевая кислота По объему выделяющегося газообразного азота судят о количестве аминокислоты в растворе. б) неокислительное дезаминирование in vivo протекает у низших организмов (бактерий, грибов): -NH3 H  OOCCH-CH2COOH HOOC –CH=CH-COOH OOCCH-CH2COOH HOOC –CH=CH-COOH фумаровая кислота NH2 аспарагиновая кислота в) окислительное дезаминирование in vivo: фермент, НАД+ H     OOC – (CH2)2 – CH _ COOH HOOC-(CH2)2-C-COOH OOC – (CH2)2 – CH _ COOH HOOC-(CH2)2-C-COOH -НАД.H;-H+ NH2 NH глутаминовая кислота H2O  HOOC-(CH2)2-C-COOH HOOC-(CH2)2-C-COOH -   NH3 NH3 O - кетоглутаровая кислота Реакция протекает под действием фермента глутаматдегидрогеназы и кофермента НАД+. 4. Реакция трансаминирования (переаминирования) in vivo: фермент трансфераза 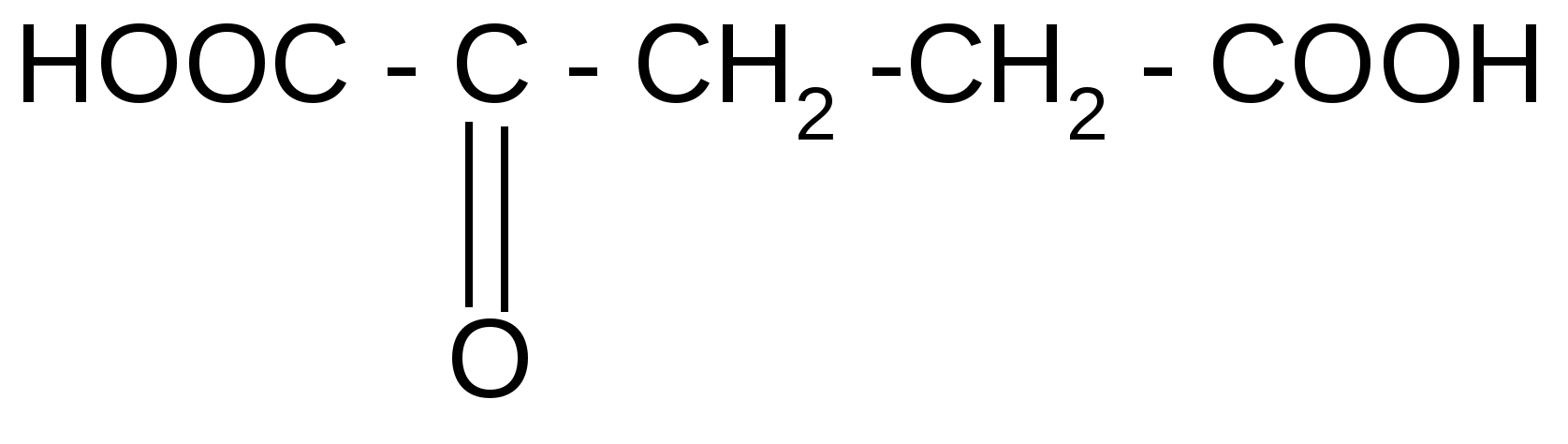  NH2-CH-COOH + NH2-CH-COOH + пиридоксальфосфат CH3 (вит. В6) аланин - кетоглутаровая кислота  О=С-СOOH + НООС-СH-(СH2)2-СOOH О=С-СOOH + НООС-СH-(СH2)2-СOOH CH3 NH2 пировиноградная глутаминовая кислота кислота 5 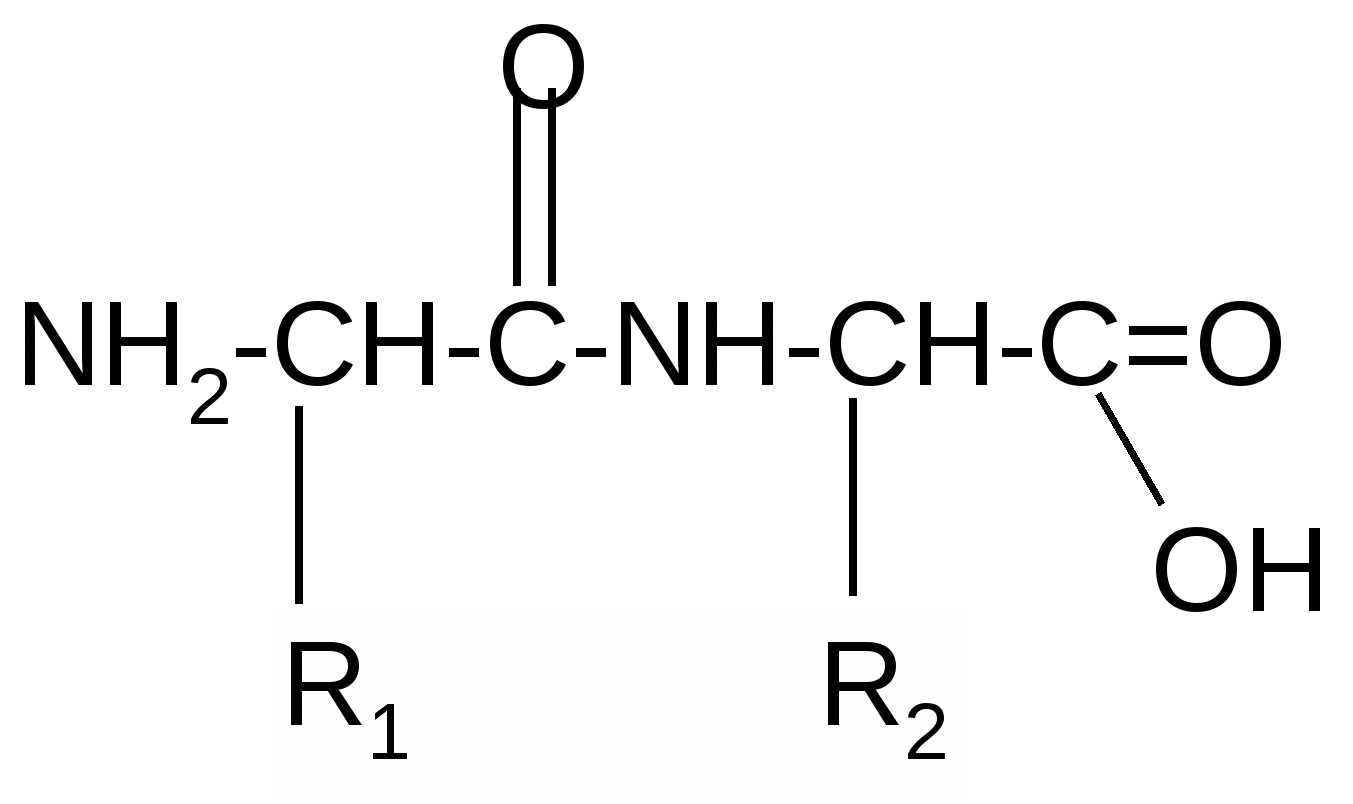 . Способность к образованию полипептидов. Карбоксильная группа одной аминокислоты может реагировать с аминогруппой другой аминокислоты с образованием пептидной связи: . Способность к образованию полипептидов. Карбоксильная группа одной аминокислоты может реагировать с аминогруппой другой аминокислоты с образованием пептидной связи: -H2O  NH2-CH-C=O + H-NH-CH-C=O NH2-CH-C=O + H-NH-CH-C=O R 1 OH R2 OH Дипептид Последовательность аминокислот, соединенных между собой пептидными связями, является первичной структурой белков. Процесс, обратный образованию пептида, называется гидролизом. Существуют три вида гидролиза белка: кислотный, щелочной и ферментативный. Результатом является образование смеси аминокислот, которые могут быть разделены и идентифицированы методами хроматографии или электрофореза. Таким образом определяют аминокислотный состав белка. Рассмотрим пример: Составить трипептид Глу-Асн-Про и дать ему полную характеристику. 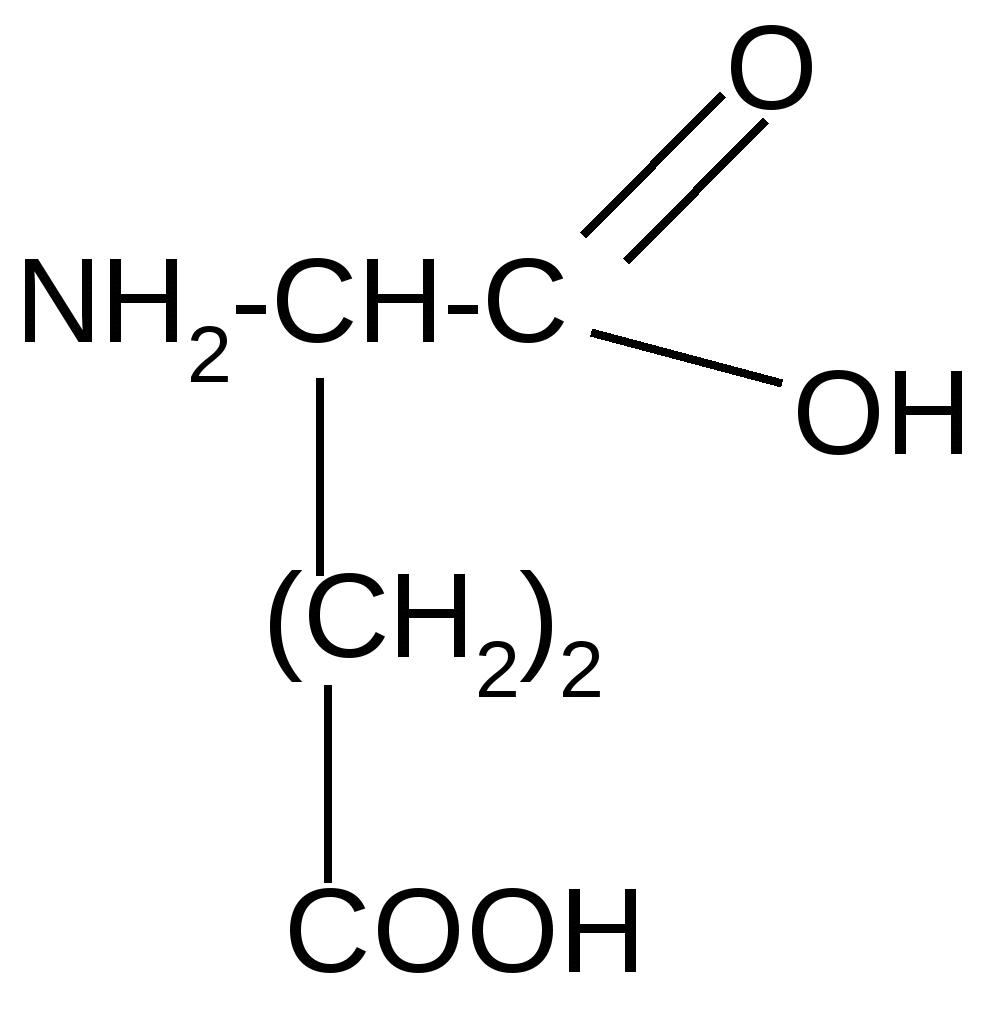 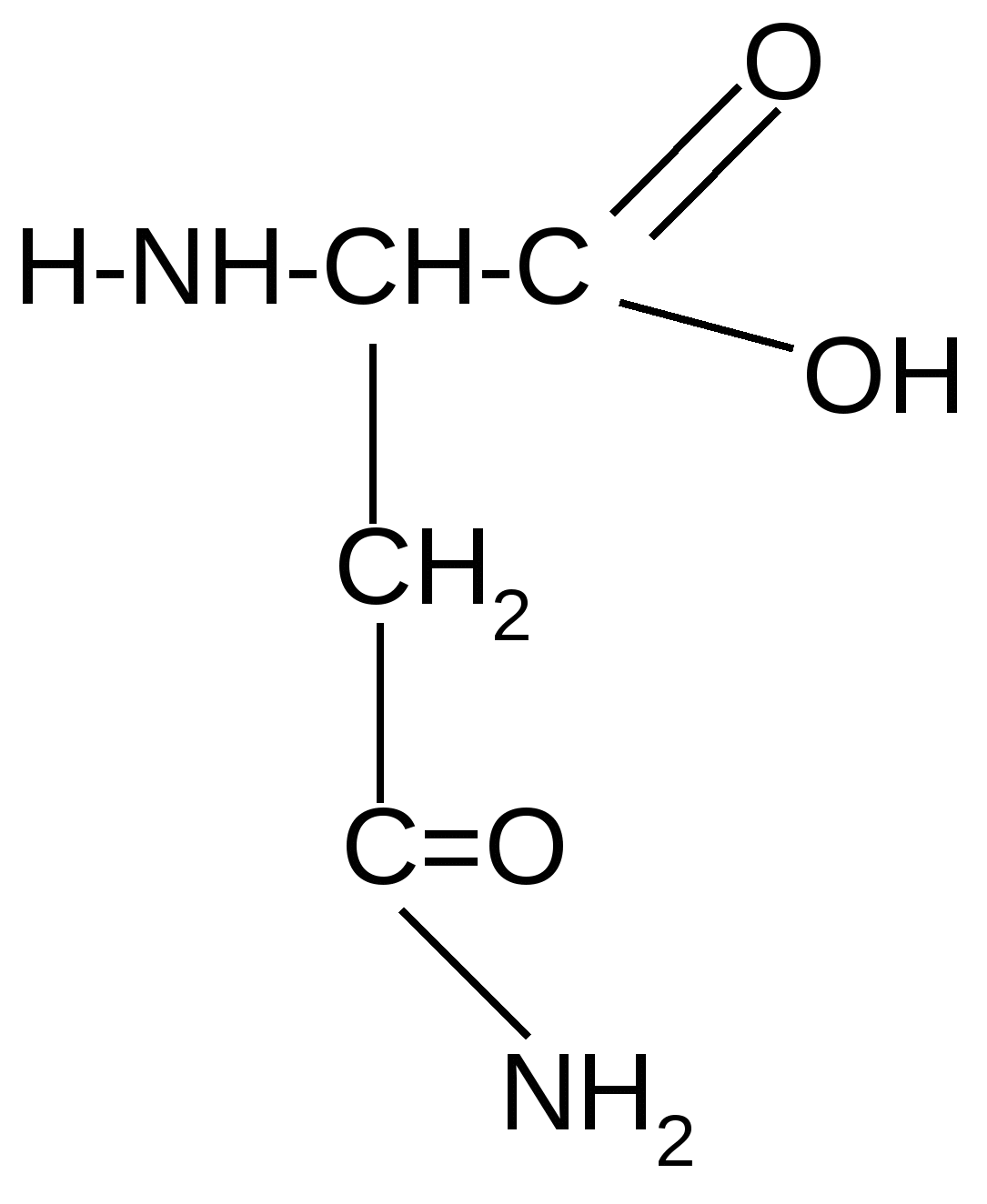 -2H2O -2H2O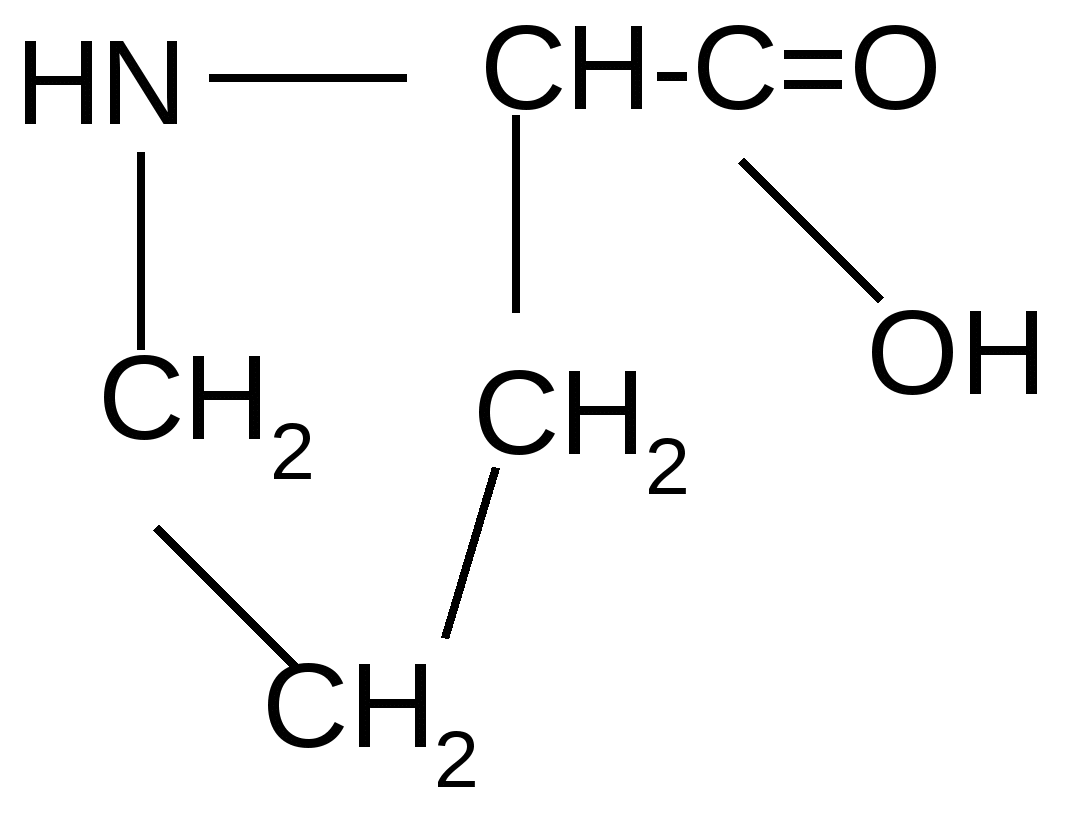  + + + +  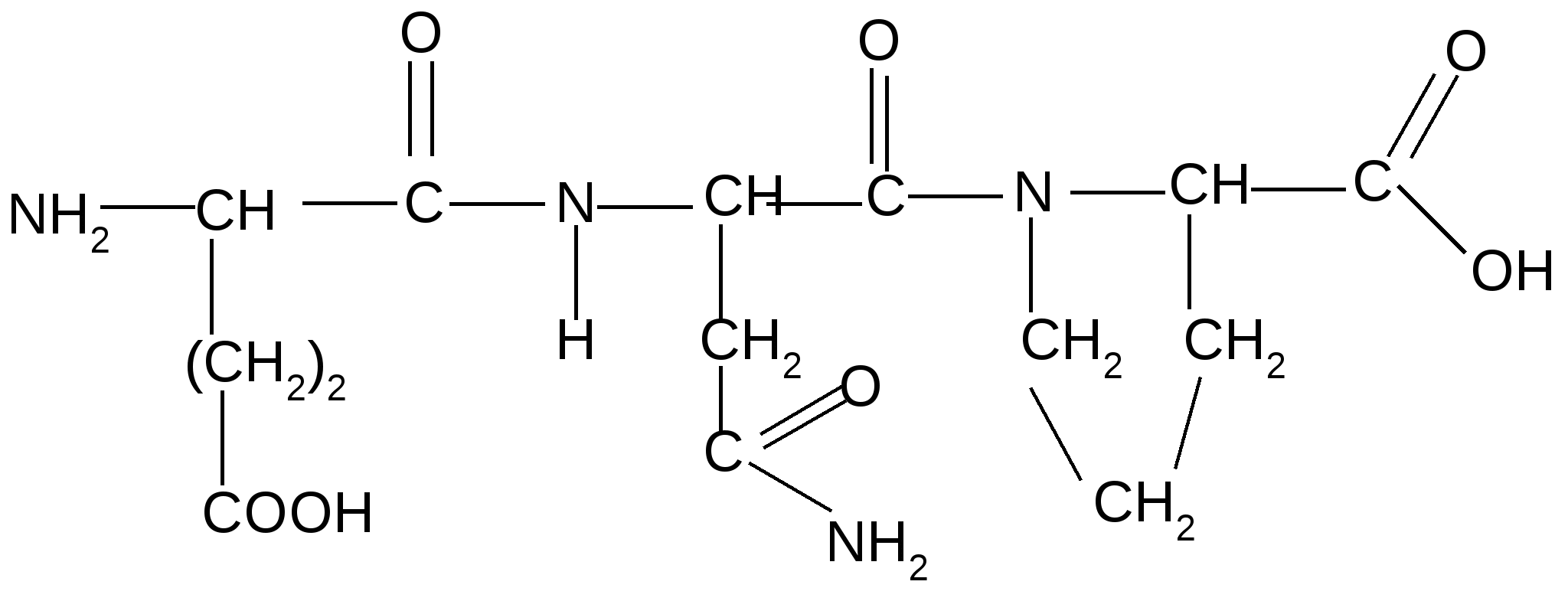   глутамил-аспарагинил-пролин В названии пептида окончания аминокислот меняются на «ил», кроме последней аминокислоты. Характеристика пептида. 1. Реакция пептида на индикатор – кислотная, так как в пептиде две кислотные группы – СOOH и одна основная –NH2 (группа – С=О не проявляет основных свойств – см. классификацию) NH2 2. Суммарный заряд пептида в водной среде: 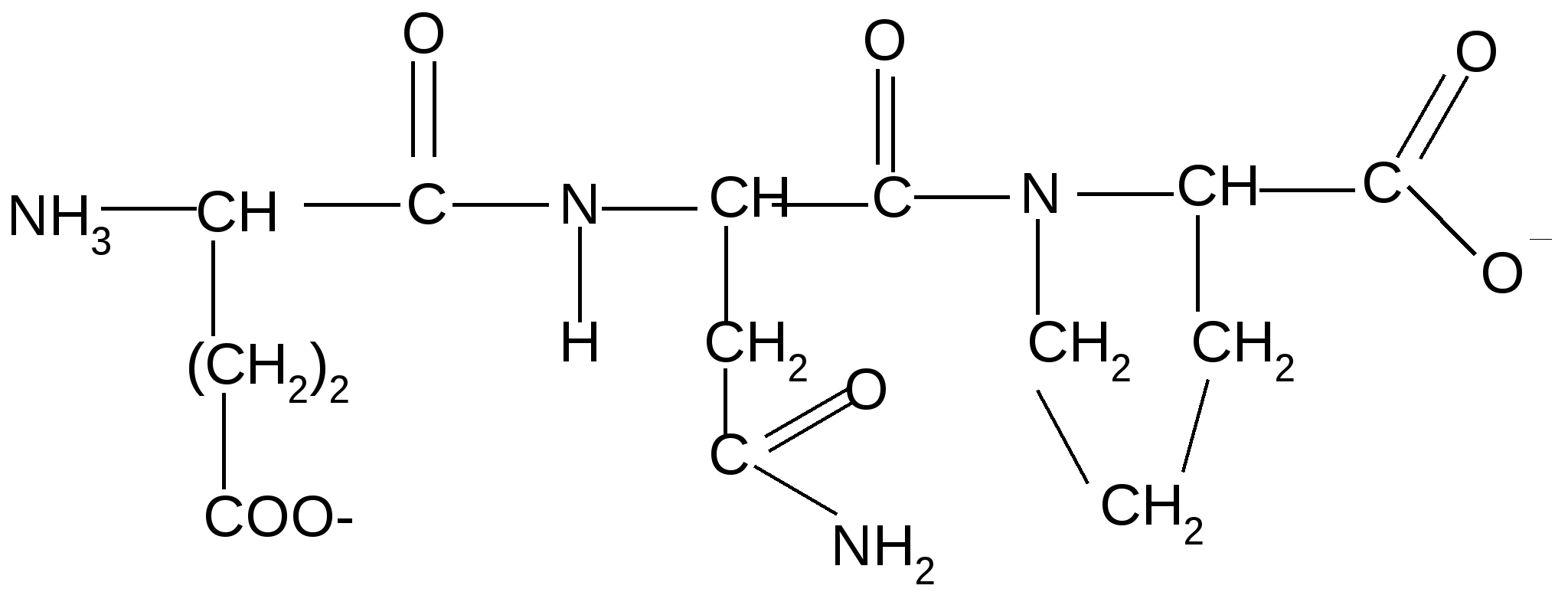   -1 -1+ 3   . Изменение суммарного заряда с изменением рН среды. Запишем пептид в упрощенном виде, выделив лишь заряженные группы и обозначив остальную часть пептида радикалом R: + . Изменение суммарного заряда с изменением рН среды. Запишем пептид в упрощенном виде, выделив лишь заряженные группы и обозначив остальную часть пептида радикалом R: +   0 +1 0 +1 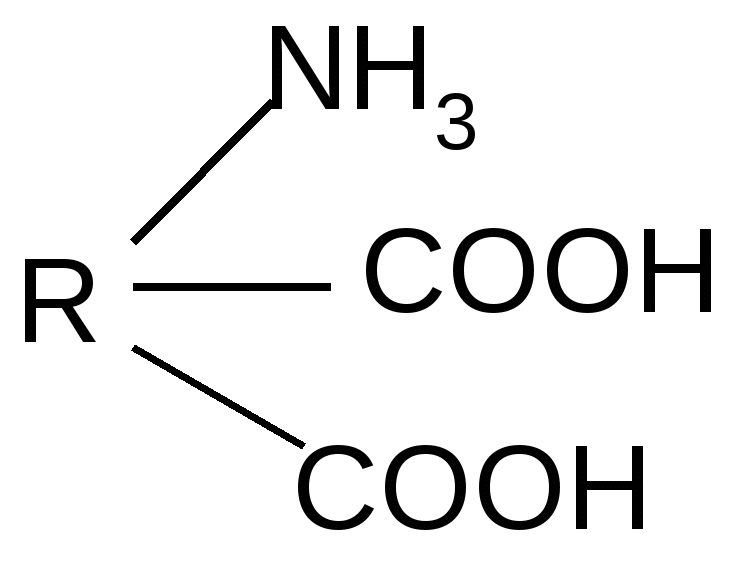   -1 H+ + H+ -1 H+ + H+ 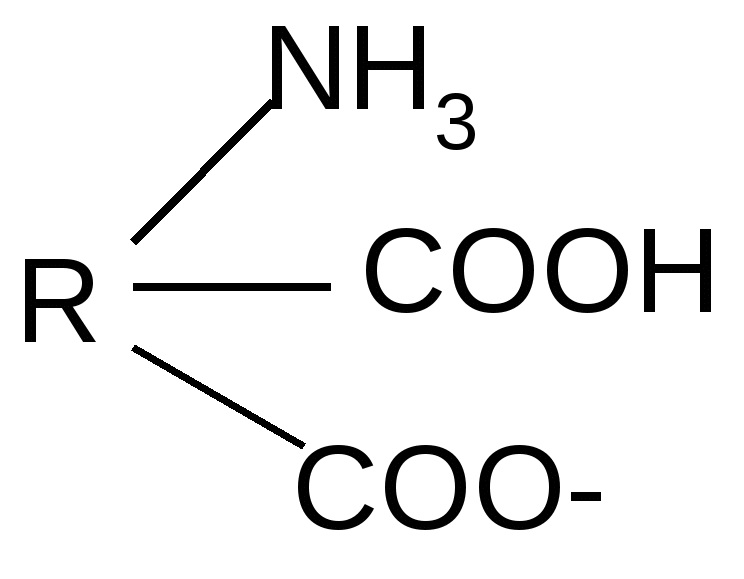 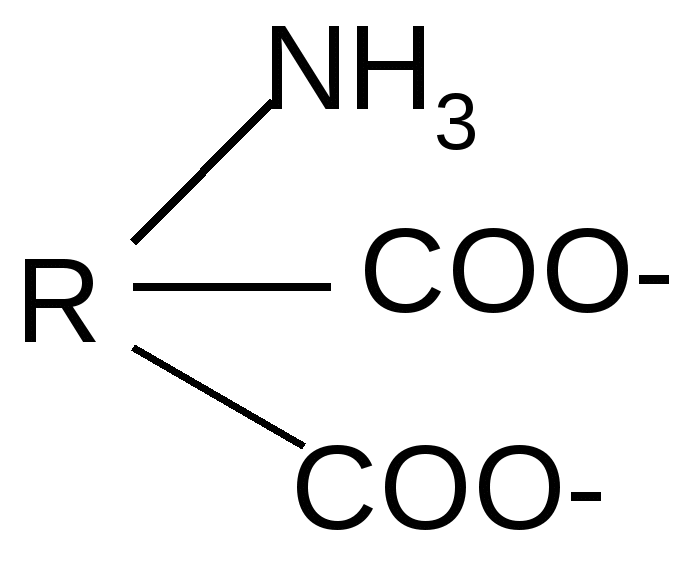   + +  OH- OH- 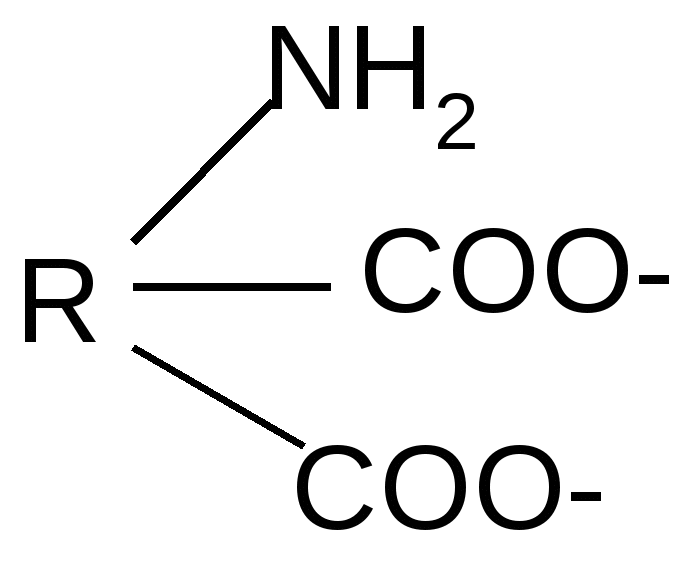   -2 -2 4. Изоэлектрическая точка пептида (определение см. выше) лежит в слабокислой среде. 5. Поверхностные свойства пептида зависят от соотношения гидрофильных и гидрофобных боковых радикалов и концевых групп. В пептиде содержатся 4 гидрофильные группы: 2-СOOH, -C=O, +NH3 и одна гидрофобная: радикал пролина NH2 Гидрофильных групп больше, поэтому поверхность пептида гидрофильна, он растворим в воде. Пептиды являются продуктом частичного гидролиза белков. Но многие пептиды присутствуют в свободном состоянии в клетках и тканях и выполняют специфические биологические функции. К ним относятся гормоны, антибиотики и другие соединения, обладающие высокой биологической активностью. Самостоятельное значение пептидов в процессах жизнедеятельности человеческого организма велико. В нервной ткани выделены нейропептиды, влияющие на функции нервной системы: энкефалины, эндорфины – «опиоидные» пептиды, аналогично морфину подавляющие боль; пептиды, действующие на сон; пептиды памяти и др. Известны гормоны пептидной природы: окситоцин, вазопрессин (гормоны задней доли гипофиза), меланоцитстимулирующий гормон (выделяется средней долей гипофиза), адренокортикотропный гормон (АКТГ) (передней доли гипофиза), глюкагон (поджелудочной железы), гормоны желудочно-кишечного тракта и др. К пептидам относятся токсины, выделенные из бледной поганки, токсины яда пчел, змей, скорпионов, морских позвоночных. В медицине используются пептиды-антибиотики: грамицидин S, актиномицин и др.; пептиды-регуляторы иммунитета: тафцин; пептиды – заменители сахара: аспартам и т.д. Строение пептидной связи N H А 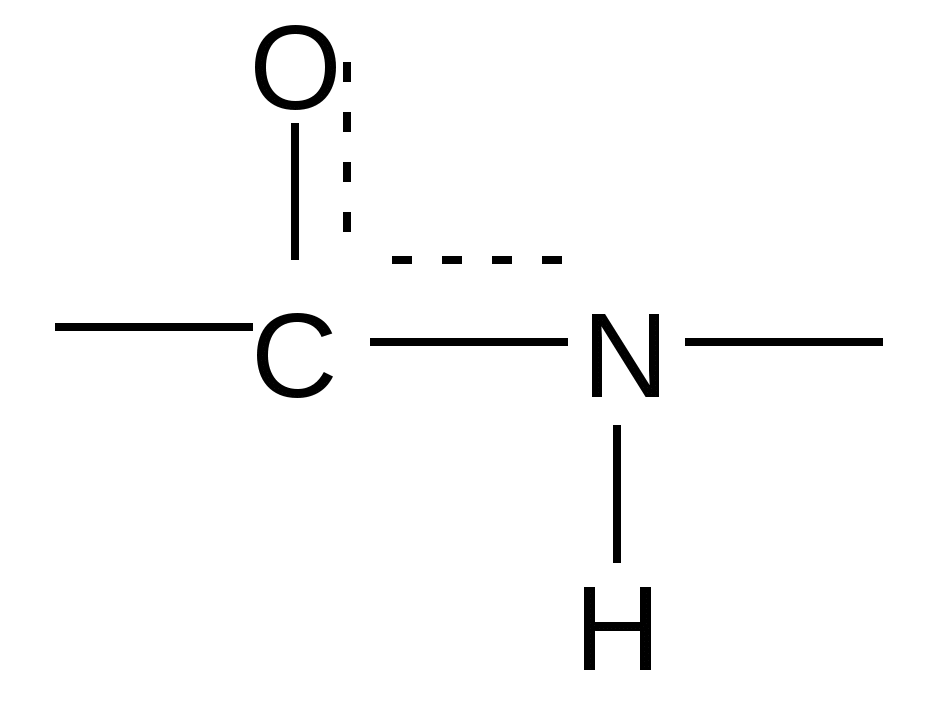 В результате связь C-N приобретает характер двоесвязанности, становится «полуторной». Вращение вокруг этой связи затруднено. В большинстве природных белков и пептидов имеет место транс-конфигурация пептидной связи, что важно для стабилизации вторичной структуры. Д  ля пептидной связи характерно явление лактам-лактимной таутомерии: ля пептидной связи характерно явление лактам-лактимной таутомерии:   N C = N N C = N H лактам лактим За счет лактимной формы пептиды дают качественную цветную реакцию с ионами Сu2+ аналогично биурету – веществу, получаемому из 2 молекул мочевины: 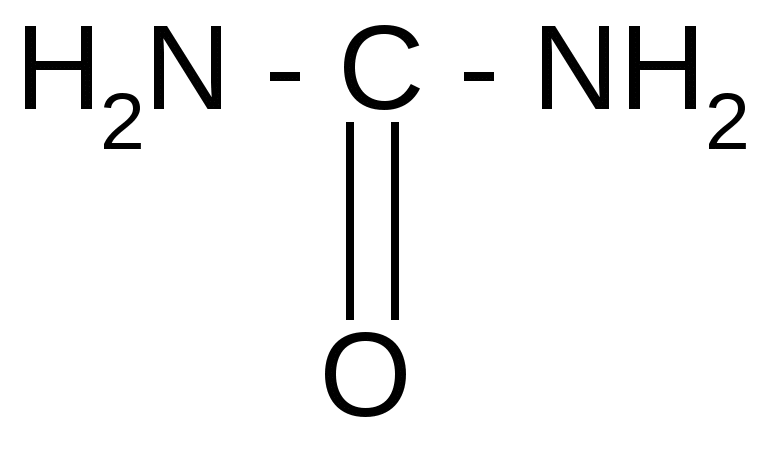   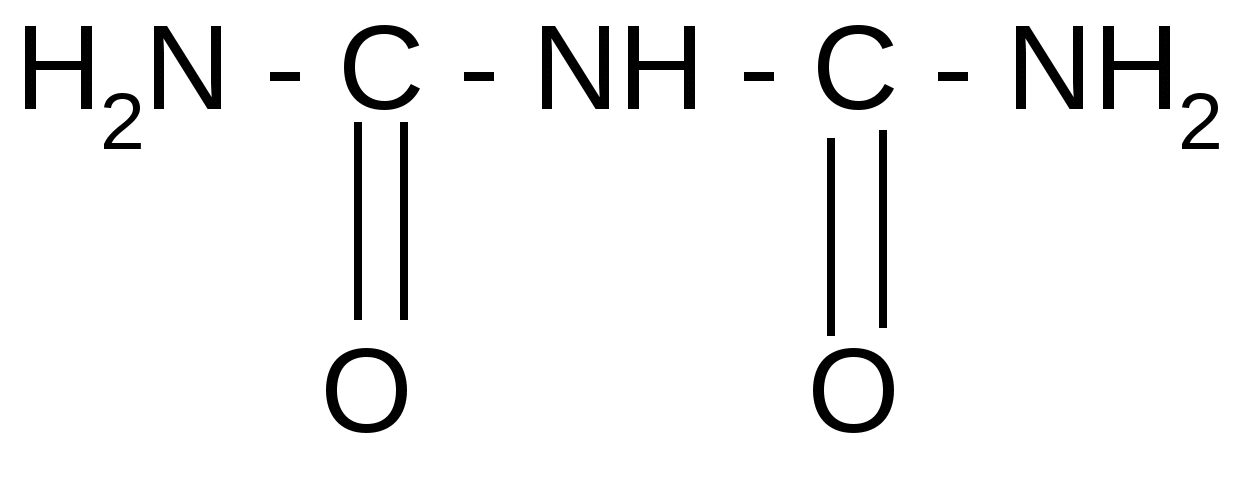 + + -NH3 мочевина биурет 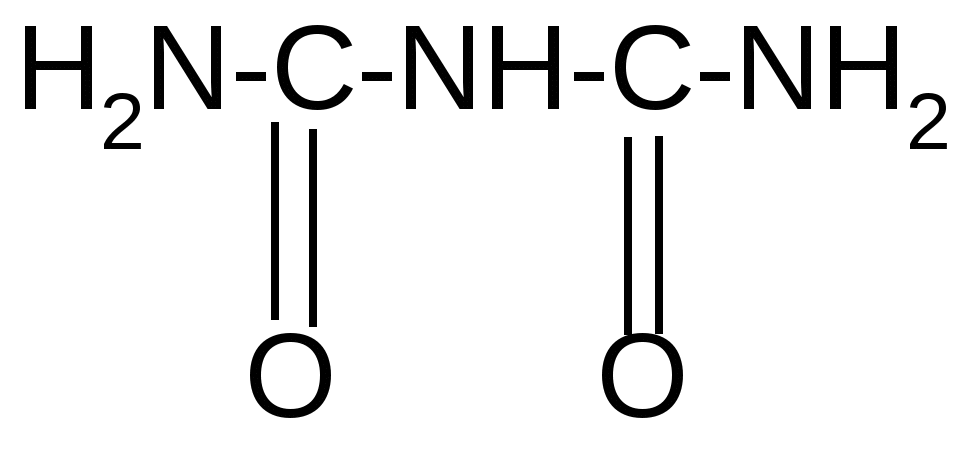 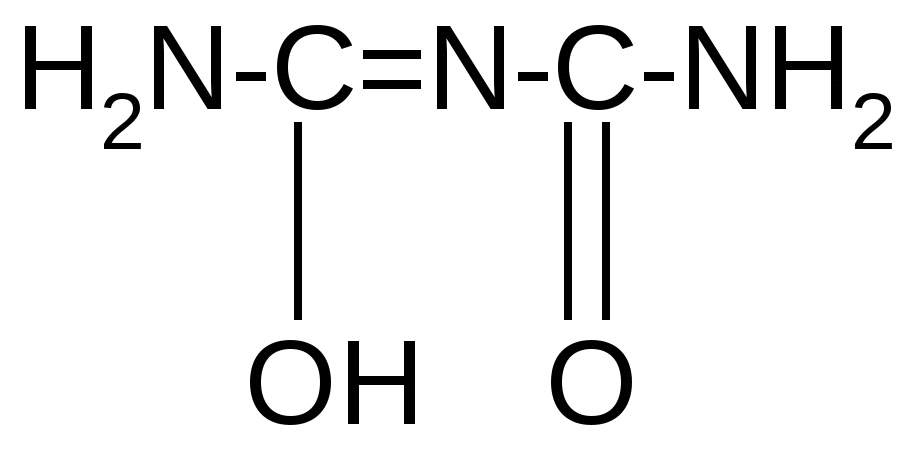   лактамная форма биурета лактимная форма биурета 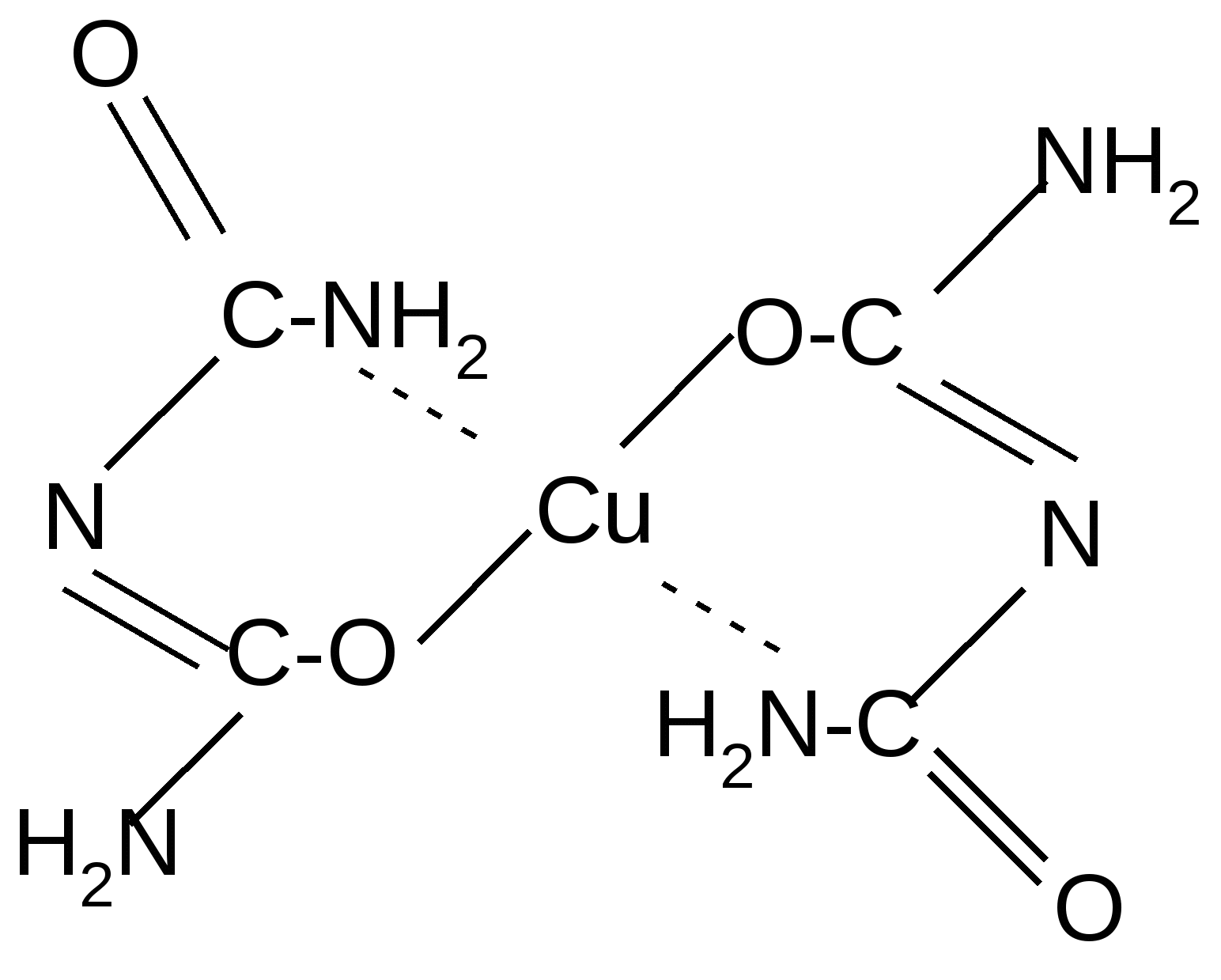 Эта реакция называется биуретовой. Она используется как качественная реакция для обнаружения пептидов и белков. IV. Аналитические, качественные реакции аминокислот и пептидов. Многие качественные реакции в настоящее время для обнаружения -аминокислот и пептидов. 1. Способность к образованию комплексных солей с ионами тяжелых металлов: 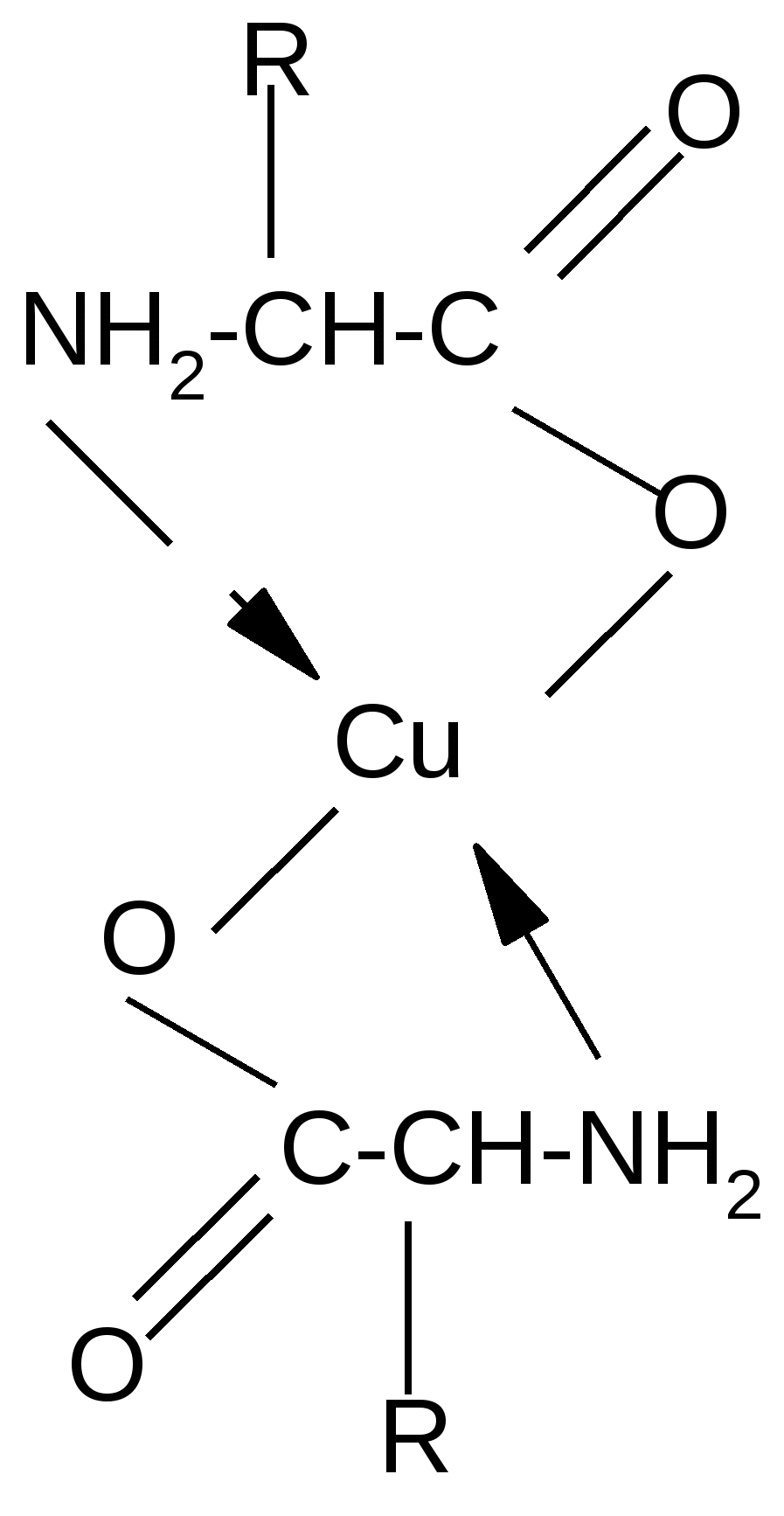 ··  2NH2-CH-C=O + Cu2+ +2Н+ 2NH2-CH-C=O + Cu2+ +2Н+ R OH ·· Комплексная соль Cu2+ хорошо растворима в воде и окрашена в ярко-синий цвет, что может быть использовано как качественная реакция на - аминокислоты. 2. Образование оснований Шиффа: H   -C=O + H2N-CH2-COOH H2C-NH-CH2-COOH H2O + -C=O + H2N-CH2-COOH H2C-NH-CH2-COOH H2O + глицин H OH + CH2=N-CH2-COOH метилениминокислота Реакция лежит в основе метода формольного титрования по Зеренсену. Сами аминокислоты вследствие амфотерности не могут быть оттитрованы щелочью. Иминокислота содержит свободную карбоксильную группу и может быть определена количественно титрованием щелочью. 3. Взаимодействие с 2,4-динитрофторбензолом – ДНФБ (реактивом Сенджера):  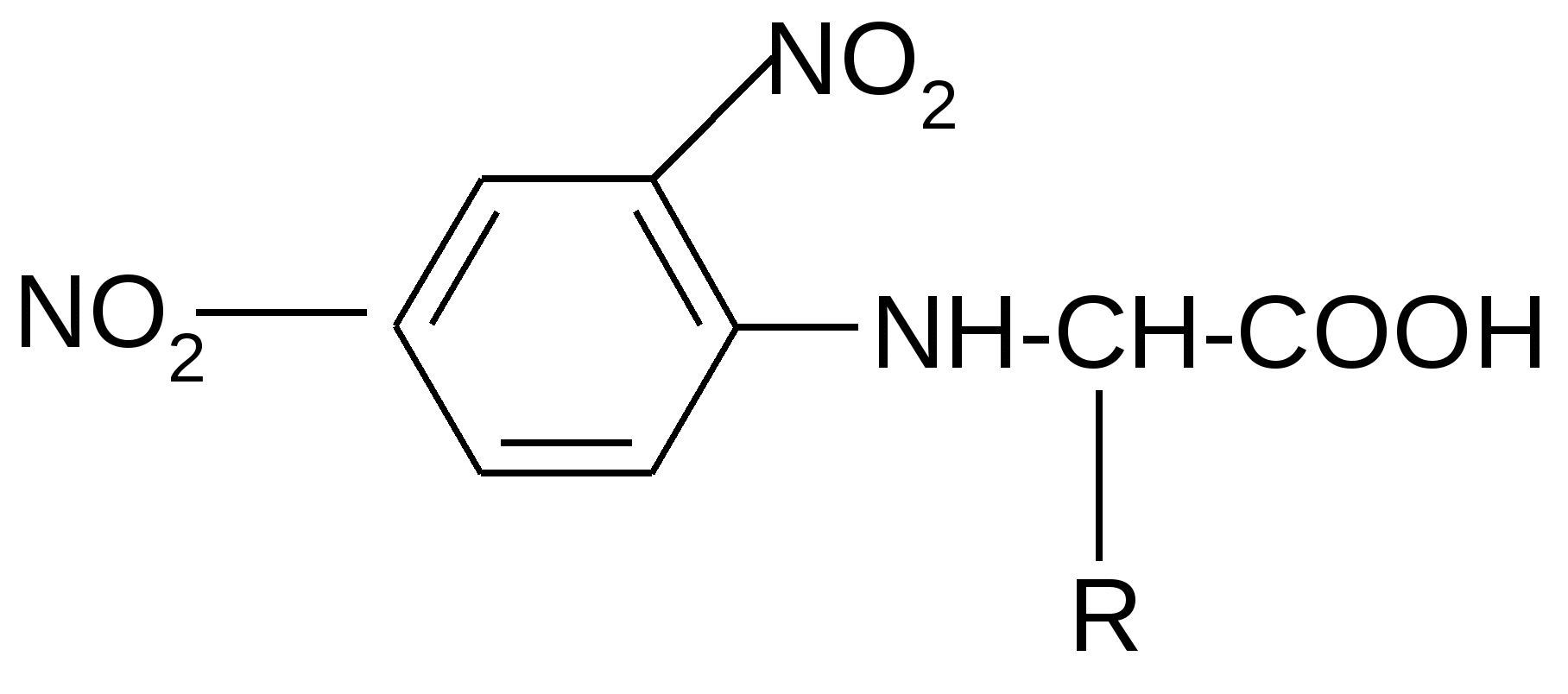  + H2N-CH-COOH + H2N-CH-COOH –HF R ДНФБ -аминокислота ДНБ-производное ДНБ-производное аминокислоты может быть выделено и идентифицировано хроматографически. Метод служит для определения аминокислотной последовательности белка. 4. Нингидриновая реакция обусловлена наличием - аминогруппы, качественная реакция на - аминокислоты, пептиды и белки:  t° t° + NH2-CH-COOH + NH2-CH-COOH 2 R - аминокислота нингидрин   H + CO2 + 3H2O + R-CHO H + CO2 + 3H2O + R-CHO продукт сине-фиолетового цвета Глоссарий Амфотерность – способность соединения проявлять и кислотные, и основные свойства. Первичная структура пептидов и белков – это аминокислотная последовательность, т.е. порядок чередования -аминокислотных остатков в молекуле. Вторичная структура пептидов и белков – это пространственная ориентация основной полипептидной цепи. Основные виды - - спираль и –структура. Изоэлектрическое состояние молекулы – состояние молекулы аминокислоты, пептида или белка, при котором суммарный заряд на молекуле равен нулю. Изоэлектрическая точка – значение рН водного раствора аминокислоты, пептида или белка, при котором молекула достигает изоэлектрического состояния. Пептидная связь (группа) – это группа атомов -СО–NН - , регулярно повторяющаяся в полимерной цепи молекулы. Тема 8. Углеводы Цель занятия: закрепить и расширить знания принципов стереоизомерии, таутомерного равновесия и химических свойств, важнейших моно-, ди- и полисахаридов, участвующих в процессах жизнедеятельности, а также приобрести практические навыки идентификации углеводов. Конкретные задачи 1. Студент должен знать: – пространственное строение моно-, ди- и полисахаридов; – виды изомерии и таутомерию углеводов, а также их химические свойства и биологическое значение. 2. Студент должен уметь: – писать формулы важнейших моно-, ди- и полисахаридов в открытой и циклической формах; – изображать конформации пиранозного цикла моносахаридов и фрагментов полисахаридов; – определять по формуле Фишера принадлежность углевода к стереохимическому ряду (D - или L -); – описывать уравнениями химические свойства моносахаридов; – доказывать восстанавливающую способность углеводов дисахаридов; – проводить качественные реакции для обнаружения и доказательства строения глюкозы, фруктозы, мальтозы, сахарозы, крахмала. Мотивация. Углеводы – один из важнейших классов органических природных соединений, играющий большую роль в процессах, обеспечивающих нормальную деятельность живых организмов. Они принимают участие в энергетическом и пластическом обмене; с углеводами связана специфичность групп крови высших организмов; химия иммунитета. Многие углеводы используются в качестве медицинских препаратов. Вопросы для самоподготовки 1. Открытые и циклические таутомерные формы глюкозы, галактозы, маннозы, фруктозы, рибозы, дезоксирибозы и ксилозы. 2. Реакции окисления и восстановления моносахаридов. 3. Гликозиды и их биологическая роль. 4. Сложные эфиры углеводов: моно-, ди- и полисахаридов. 5. Доказательство строения углеводов – моносахаридов. 6. Строение, номенклатура и восстанавливающая способность дисахаридов: мальтозы, лактозы, целлобиозы. 7. Строение гомополисахаридов: крахмала, гликогена, клетчатки (целлюлозы). Их гидролиз. Этапы занятия и контроль усвоения знаний
Содержание этапов занятия 1 этап. Преподаватель проверяет выполнение домашнего задания в рабочих тетрадях и оценивает его по пятибалльной системе. 2 этап. На 1 занятии по теме «Моносахариды» студенты пишут микроконтрольную работу по цикло-цепной таутомерии. На 2 занятии по теме «Ди- и полисахариды» каждый студент отвечает письменно на билет тест-контроля. Билет содержит 2 вопроса: 1-й вопрос – по теме «Моносахариды»; 2-й – по теме «Ди- и полисахариды». Ответ оценивается по 10 балльной системе (0, 5 или 10 баллов). 3-й этап. На первом занятии по теме «Моносахариды» студенты учатся писать открытые и циклические таутомерные формы моносахаридов на примере глюкозы и фруктозы, разбирают конформационное строение моносахаридов, способствующее образованию 6- и 5- членных циклов (пиранозных и фуранозных форм) и конформации пиранозных форм; анализируют важнейшие химические свойства моносахаридов. На 2-м занятии по теме «Ди- и полисахариды» разбираются структура, номенклатура, тип и свойства дисахаридов (мальтозы, лактозы, целлобиозы и сахарозы) и полисахаридов (крахмала, гликогена, целлюлозы). 4-й этап. Студенты выполняют лабораторные работы по теме занятия под руководством преподавателя. 5 этап. В ходе выполнения лабораторной работы студенты записывают наблюдения, анализируют их и делают выводы. 6 этап. Защита протоколов лабораторных работ, оценка преподавателем практических навыков, приобретенных студентами на занятии. Тема 8-1. Углеводы. Моносахариды Теория Углеводы широко распространены в природе. В организме животных на углеводы приходится до 2 %, а в растениях – до 90 % сухого вещества. Эти вещества выполняют энергетическую, структурную, защитную и другие функции; входят в состав нуклеиновых кислот, коферментов и витаминов; используются в качестве лекарственных препаратов. В зависимости от строения углеводы классифицируют на моно-, олиго- и полисахариды. Моносахариды (монозы) – это многоатомные альдегидо- и кетоноспирты, не гидролизующиеся до более простых. По числу атомов углерода моносахариды подразделяют на тетрозы (С4 ), пентозы (С5), гексозы (С6) и т.д. Моносахариды, содержащие альдегидную группу, называют альдозами; кетонную – кетозами.
Для представления пространственного строения моносахаридов Э. Фишер предложил использовать проекционные формулы. Важнейшие природные моносахариды |
