Тема Соединения со смешанными функциями Гидроксиальдегиды и гидроксикетоны. Гидрокси и оксокислоты Цель занятия
 Скачать 1.67 Mb. Скачать 1.67 Mb.
|
Содержание этапов занятия1-й этап. Преподаватель проверяет и оценивает по пятибалльной системе выполнение домашнего задания по заданной теме и отвечает на вопросы студентов. 2-й этап. Студенты письменно отвечают на билет тест – контроля. Ответ оценивается по десятибалльной системе (0, 5, 10 баллов). 3-й этап. При обсуждении теоретического материала необходимо вспомнить свойства карбоновых кислот, спиртов, альдегидов и кетонов как соединений, определяющих общие химические свойства гидрокси- и оксокислот. Разобрать специфические свойства: отношение к нагреванию -, -, -гидроксикислот на примере молочной, -гидроксимасляной, -гидроксимасляной кислот; способность - гидроксикислот разлагаться при нагревании в присутствии серной кислоты на примере молочной кислоты; реакции декарбоксилирования пировиноградной и ацетоуксусной кислот; кето-енольную таутомерию на примере ацетоуксусного эфира; оптическую изомерию на примере винной и молочной кислот. 4-й этап. Студенты по 2 человека выполняют лабораторные работы по теме занятия. 5-й этап. Студенты оформляют в рабочей тетради протокол лабораторной работы в виде таблицы. Заполняют графы «Наблюдения и выводы» 6-й этап. Студенты предоставляют оформленный протокол и объясняют полученные результаты. Преподаватель оценивает приобретенные практические навыки. Теория Органические соединения, содержащие ОН- и >С=О группы, называются гидроксиальдегидами и гидроксикетонами. Важнейшие представители приведены в таблице 1. Соединения, содержащие -ОН и -СООН группы, называются гидроксикислотами (таблица 2). ГидроксикислотыКлассификация Г |
| по количеству -ОН групп, включая и входящую в -СООН, бывают двух- и многоатомными | по количеству -СООН групп бывают одно- и многоосновными | бывают -,.-, - и т.д. гидроксикислотами |
Виды изомерии: структурная – по положению 2-й функциональной ОН – группы относительно – СООН; стереоизомерия (энантиомерия, диастереомерия)
Химические свойства
I Гидроксикислоты проявляют общие свойства спиртов и кислот. В зависимости от реагентов и условий проведения реакций взаимодействует ОН или -СООН группа или обе одновременно. Как кислоты они более сильны, чем соответствующие карбоновые кислоты (сказывается –I эффект ОН- группы).
П. Гидроксикислоты проявляют специфические свойства, которые обусловлены взаимным влиянием ОН- и СООН- групп.
Например, своеобразная реакция отщепления воды при нагревании.
Она позволяет отличить -, -, - и другие гидроксикислоты.
а
 )
) t°


гидролиз + 2H2O
+ H+ или OH-
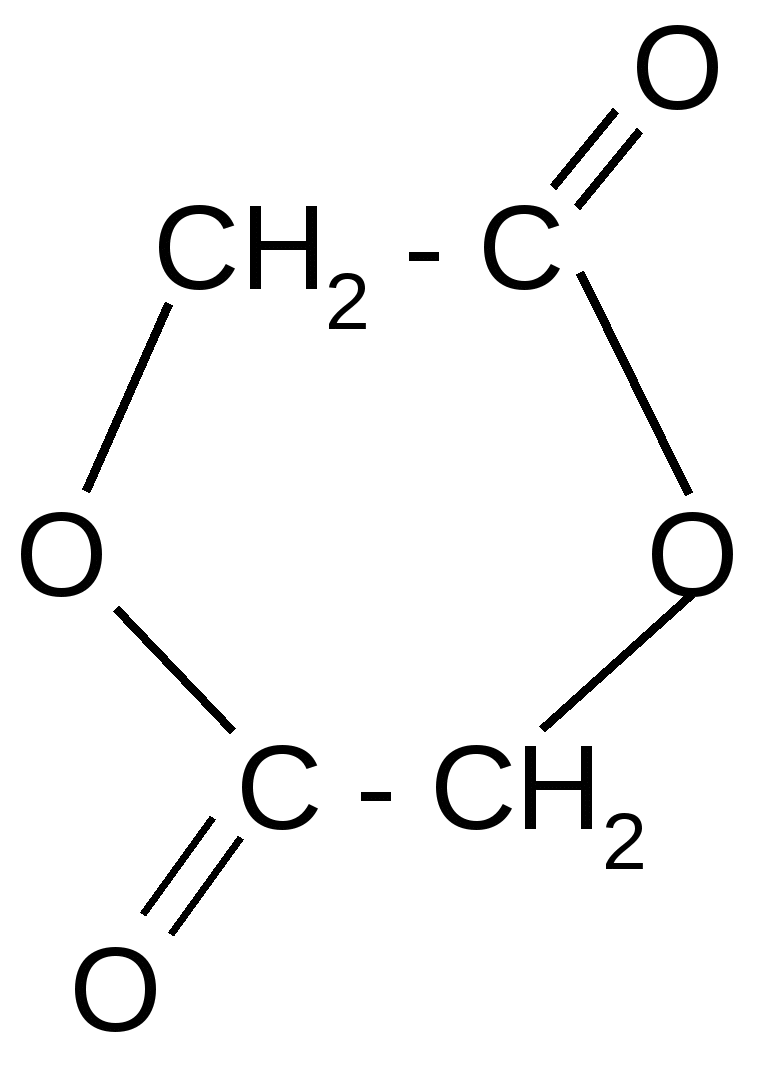
лактиды
(циклические
 сложные эфиры)
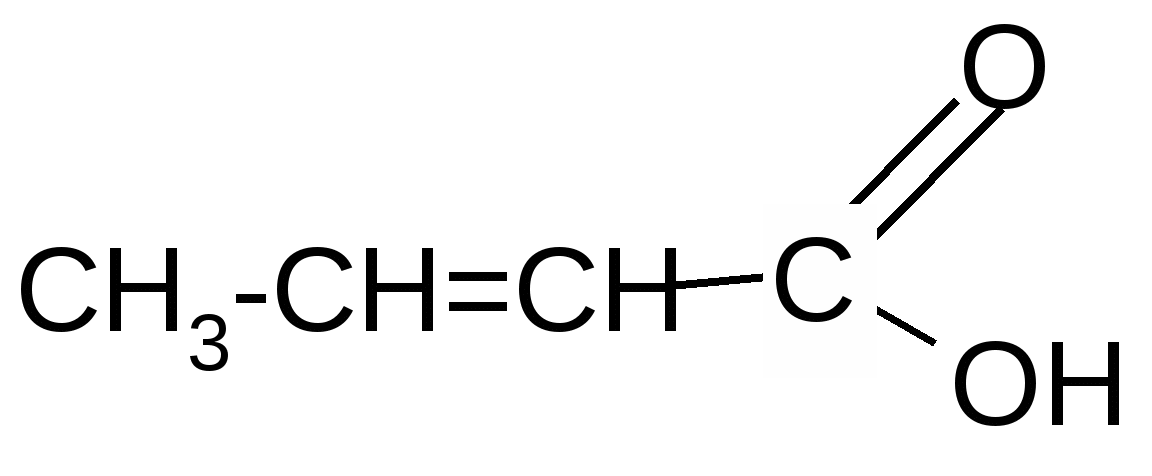
сложные эфиры)б) t°

-H2O
-оксимасляная кротоновая кислота
кислота
в
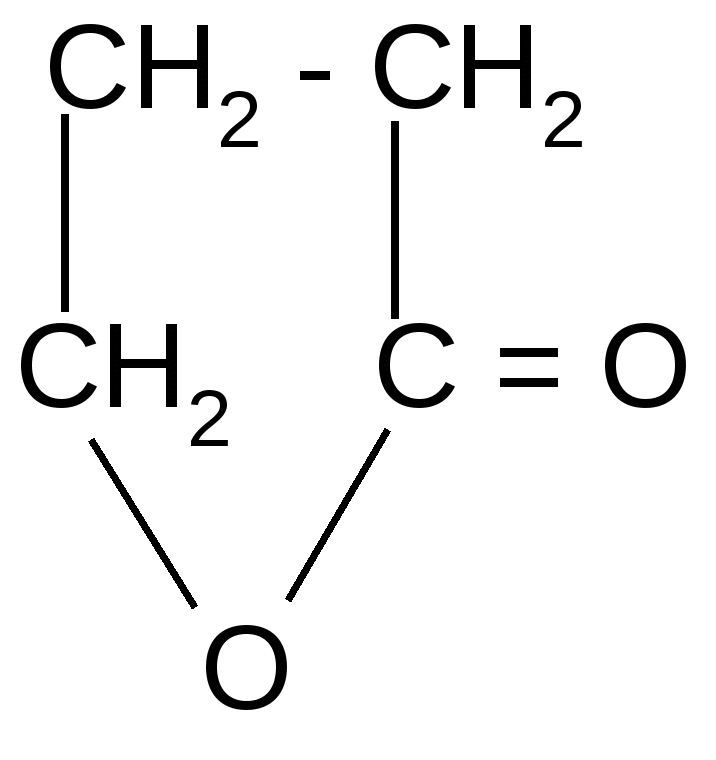 ) t°
) t° 

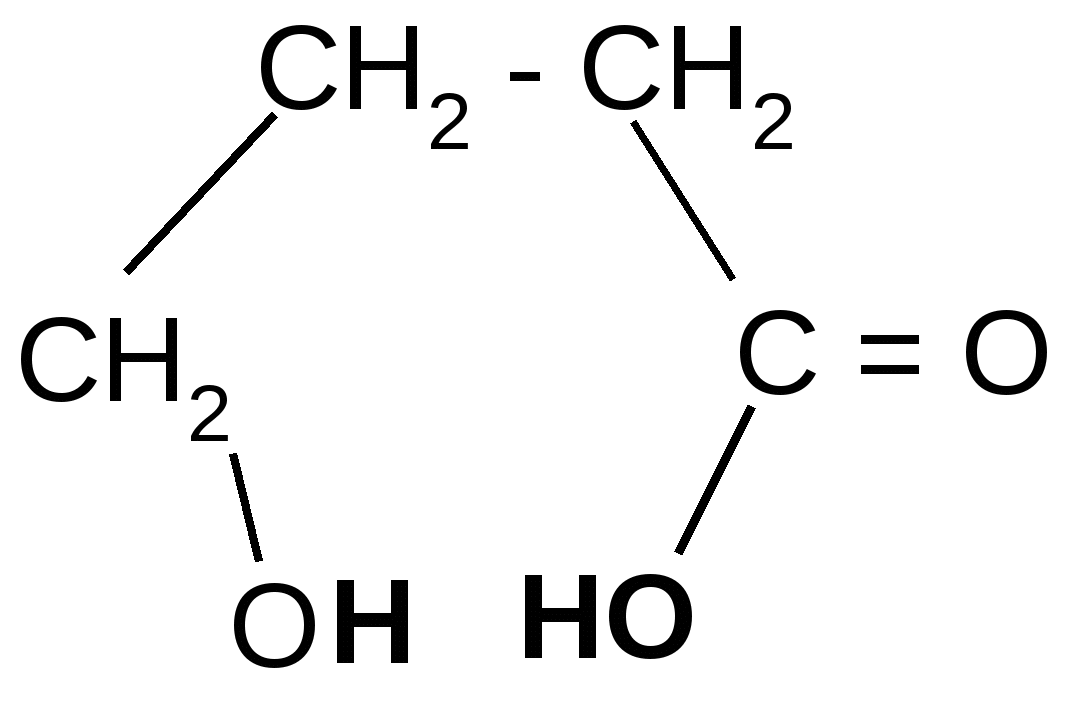 + H2O
+ H2Oгидролиз
H+
-гидроксимасляная - бутиролактон
кислота (ГОМК)
ГОМК обладает наркотическим действием, нетоксична, применяется в виде натриевой соли как снотворное средство и при неингаляционном наркозе при операциях.
г)
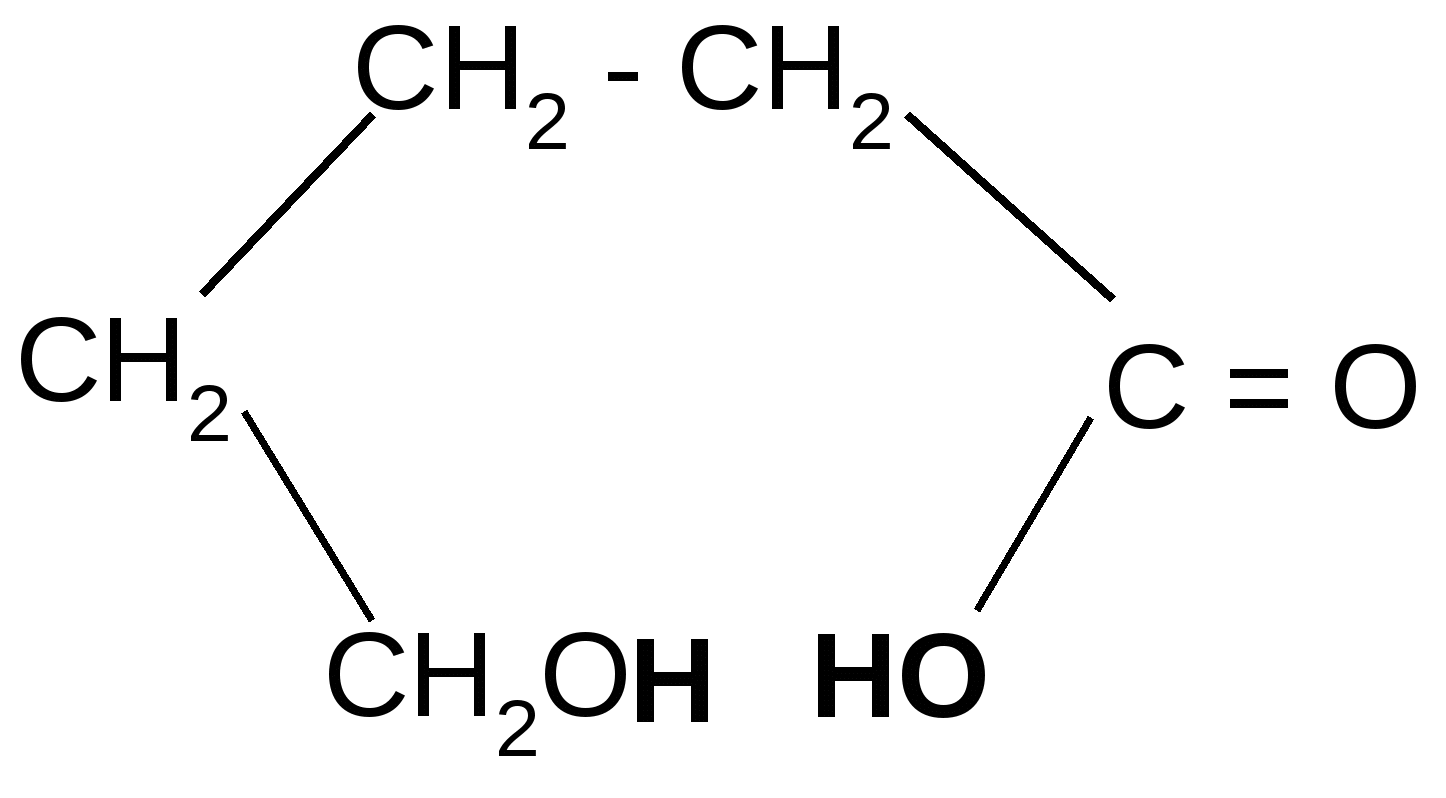
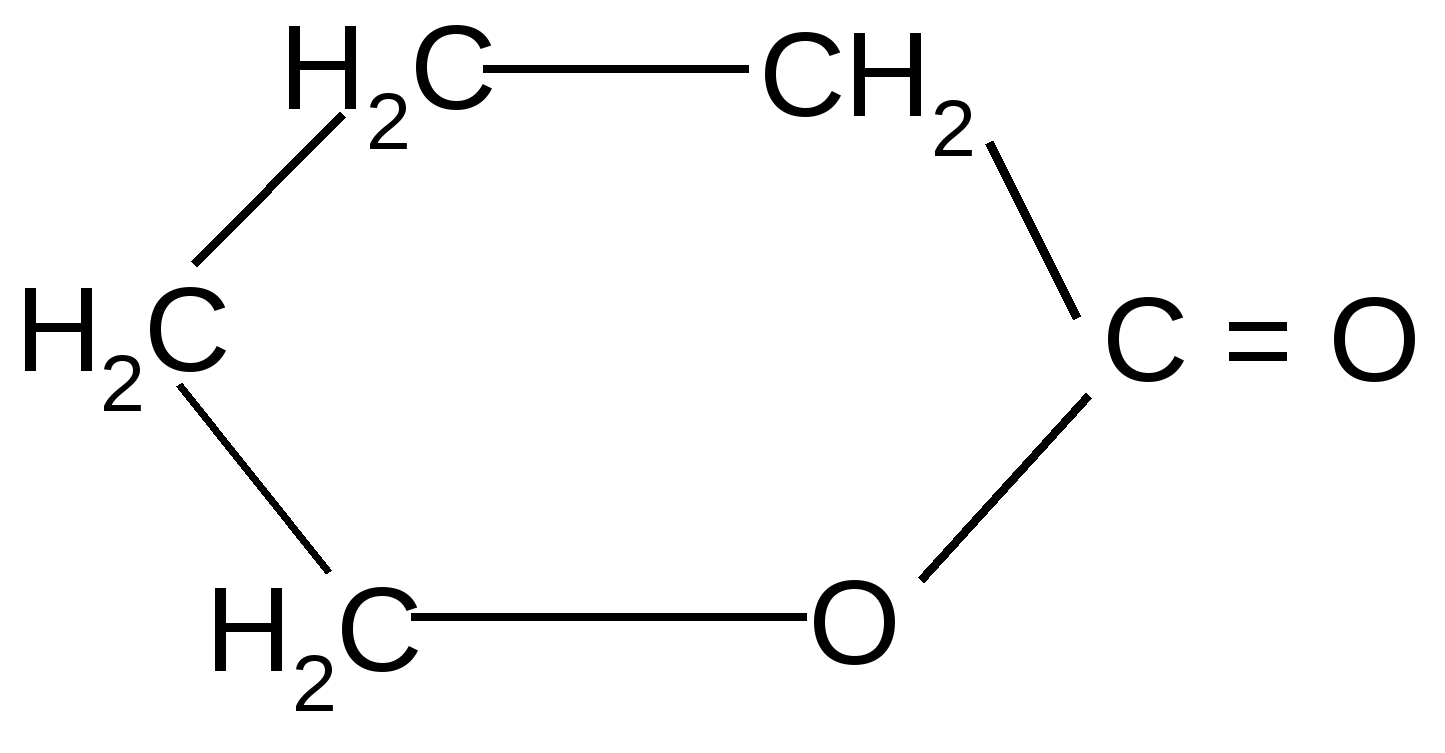
t°

 + H2O
+ H2Oгидролиз
H+
-гидроксивалериановая - валеролактон
лактон
Лактиды и лактоны могут гидролизоваться в кислой среде с образованием исходных гидроксикислот.
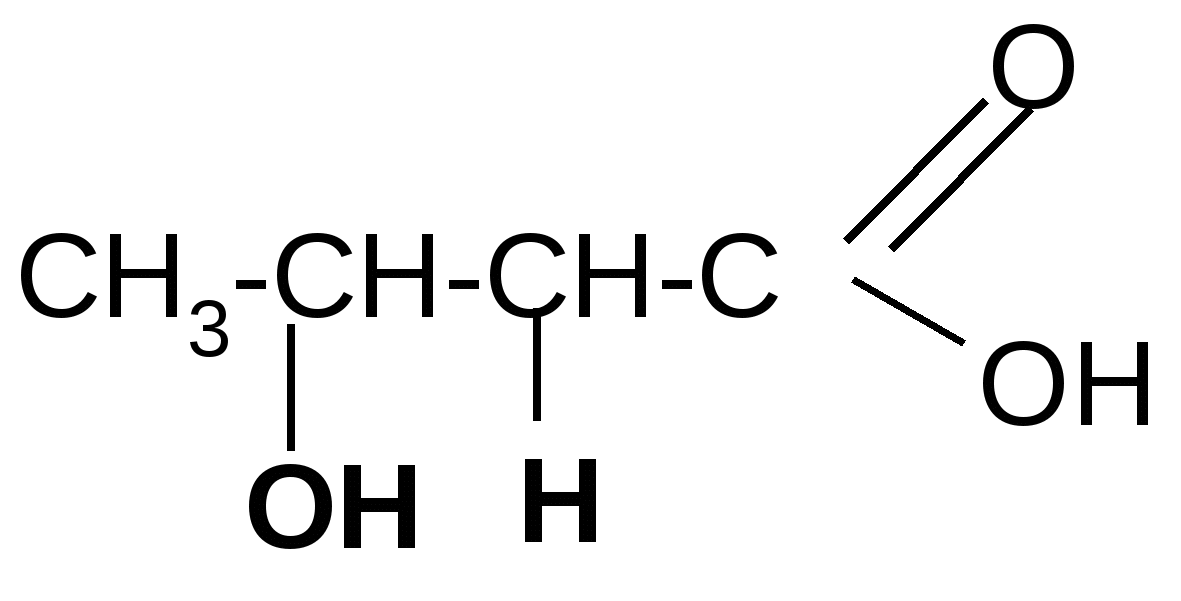
2. Разложение -гидроксикислот при нагревании в присутствии H2SO4:
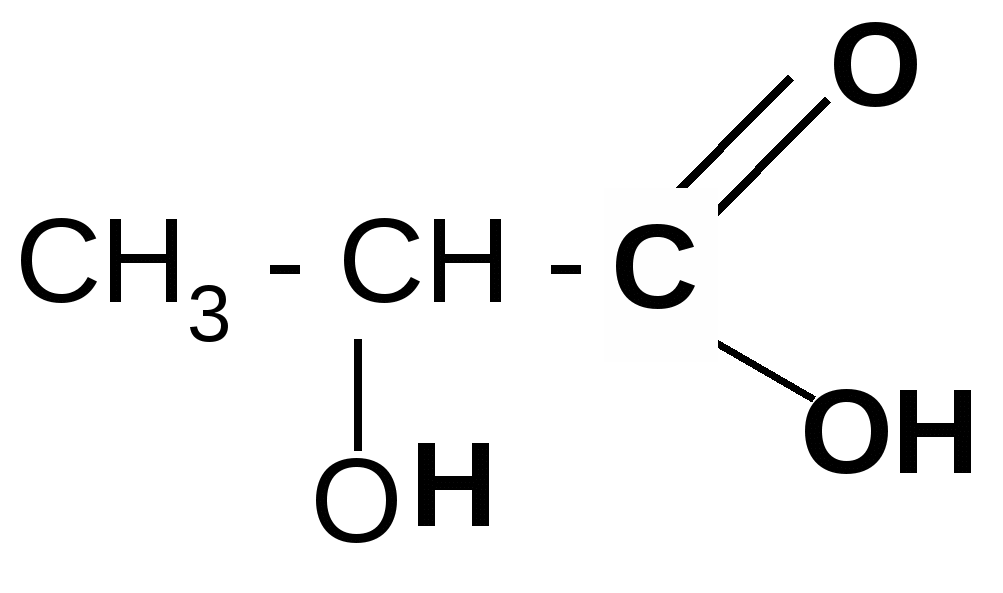
t°, H2SO4
 CH3–CHO + HCOOH
CH3–CHO + HCOOHМногоосновные кислоты ведут себя так же. Например,
а) при нагревании лимонная кислота будет вести себя как -гидроксикислоты:
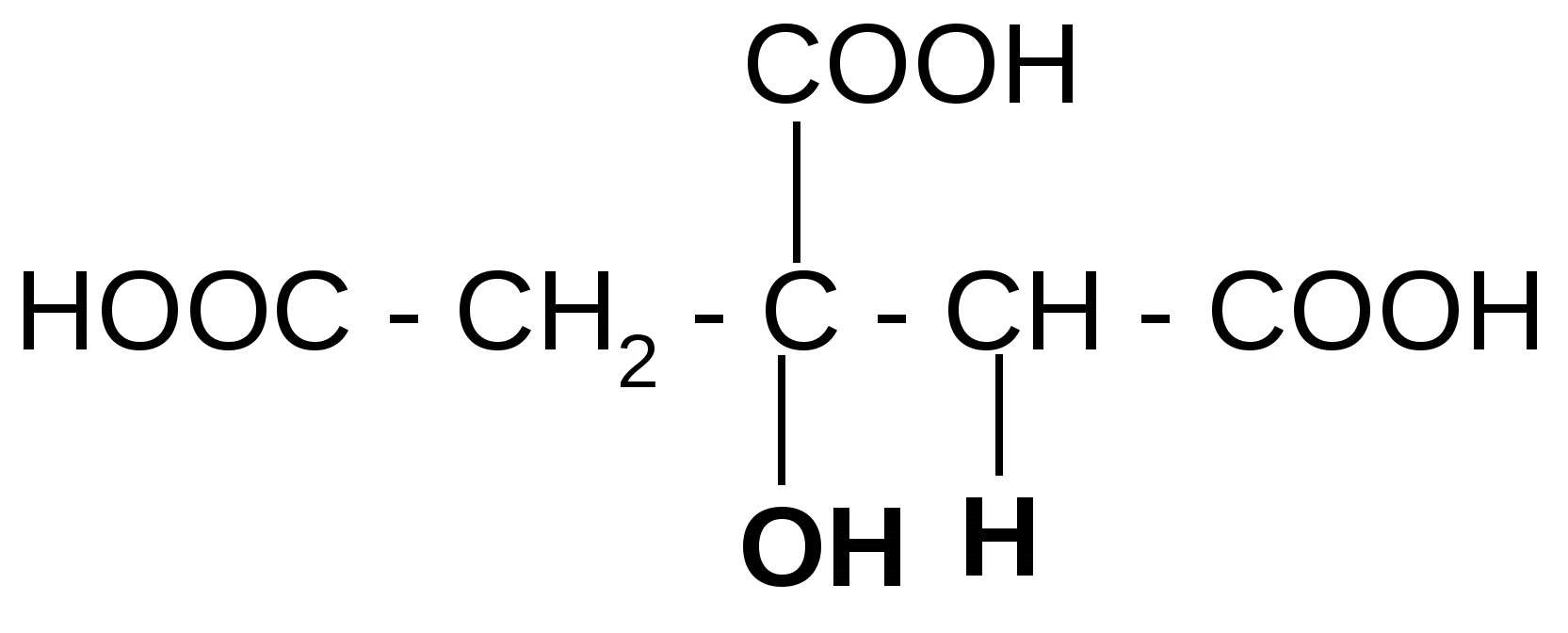
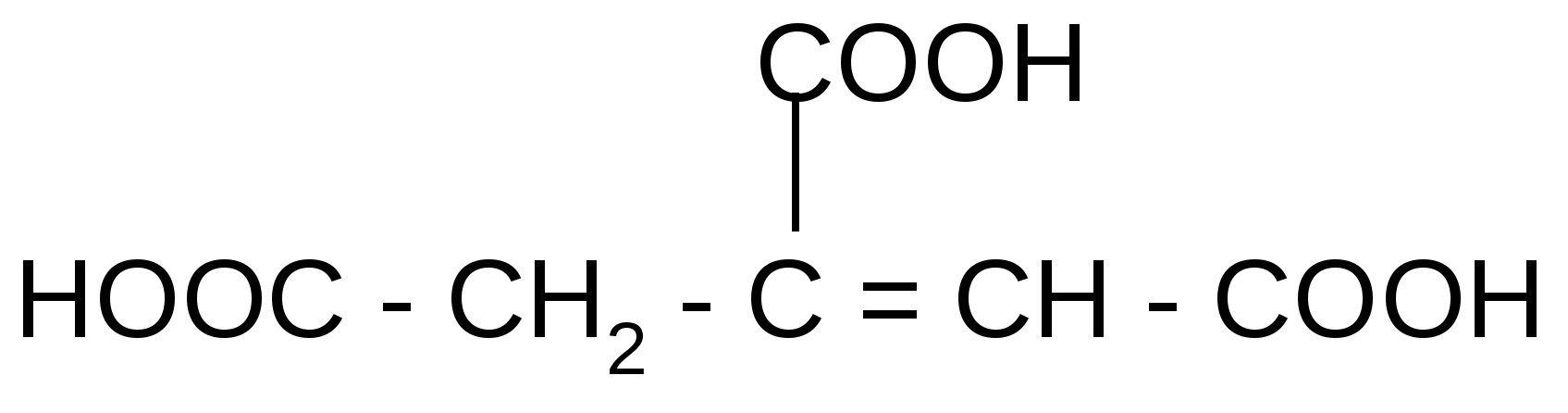
t°


-Н2О
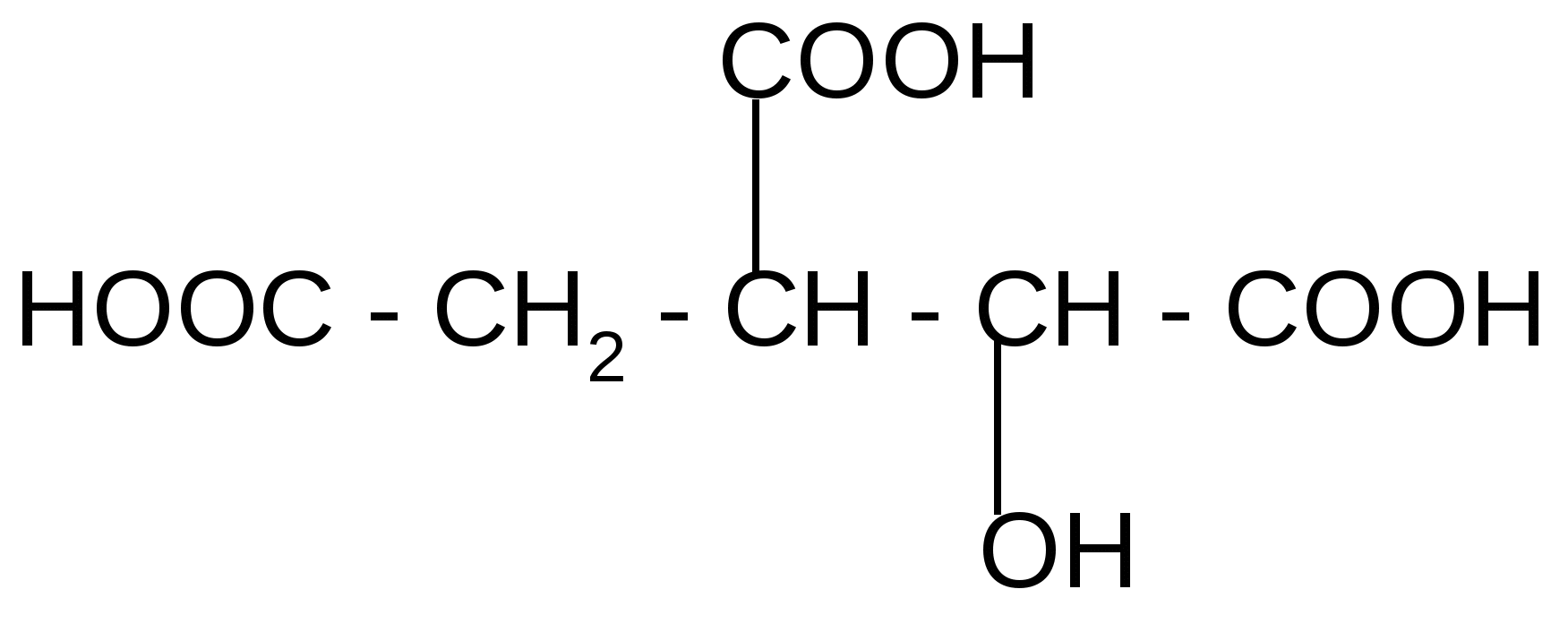 лимонная кислота цис-аконитовая к-та
лимонная кислота цис-аконитовая к-та+ Н2О

против правила
Марковникова
изолимонная кислота
б) при действии H2SO4 и нагревании она ведет себя как -гидроксикислота, т.е. разлагается с выделением муравьиной кислоты:
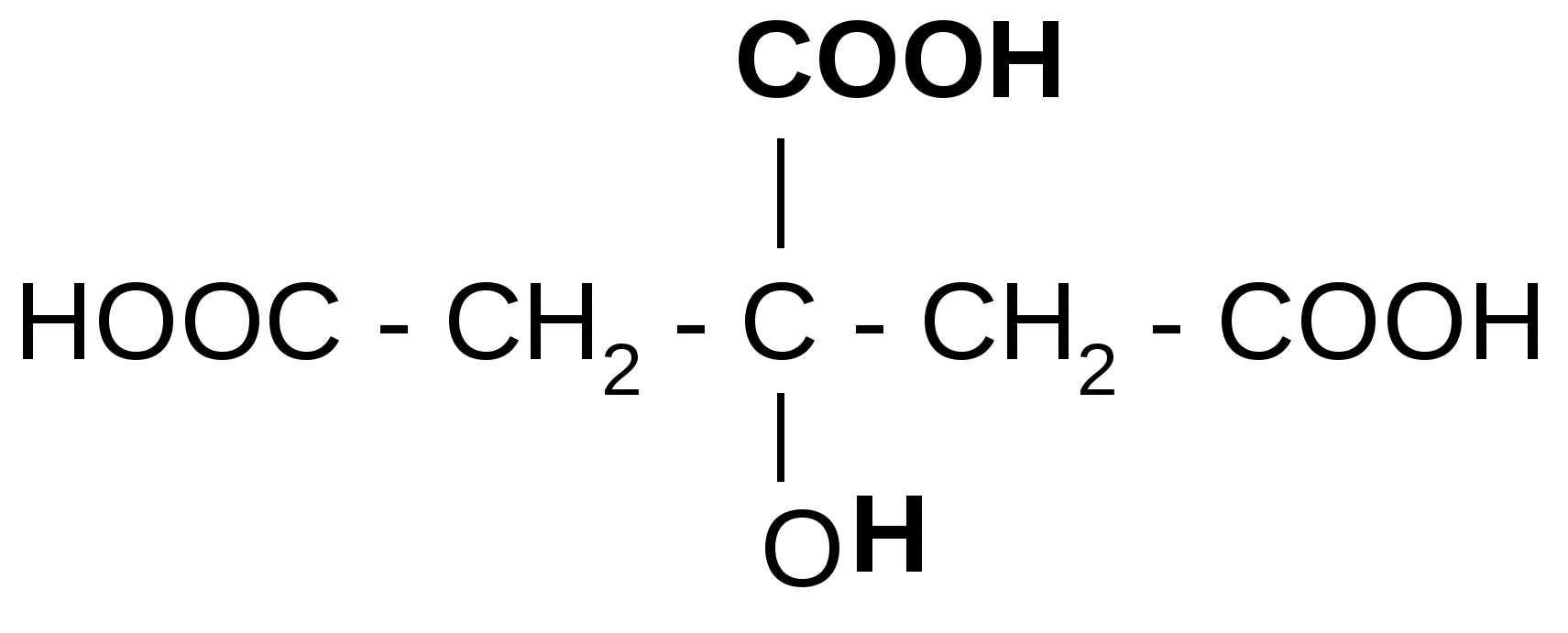
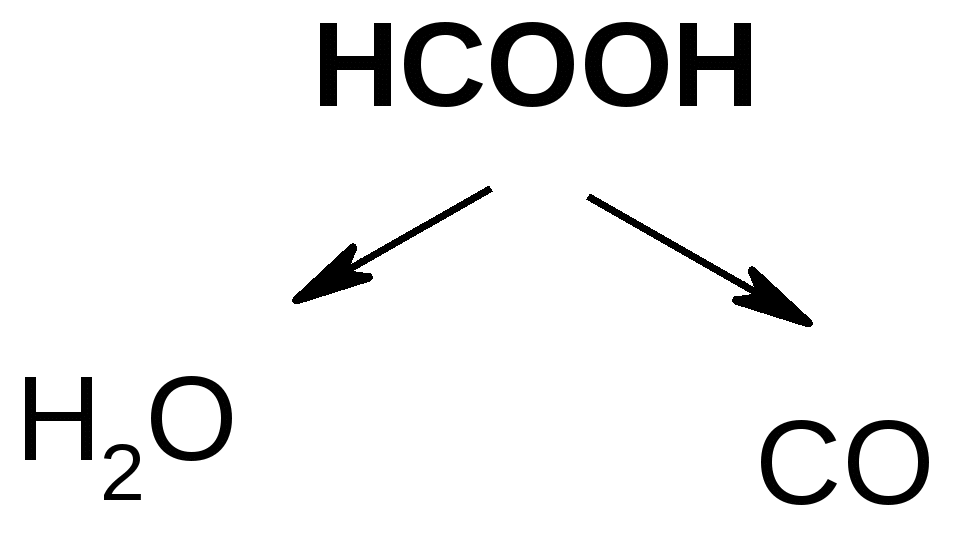
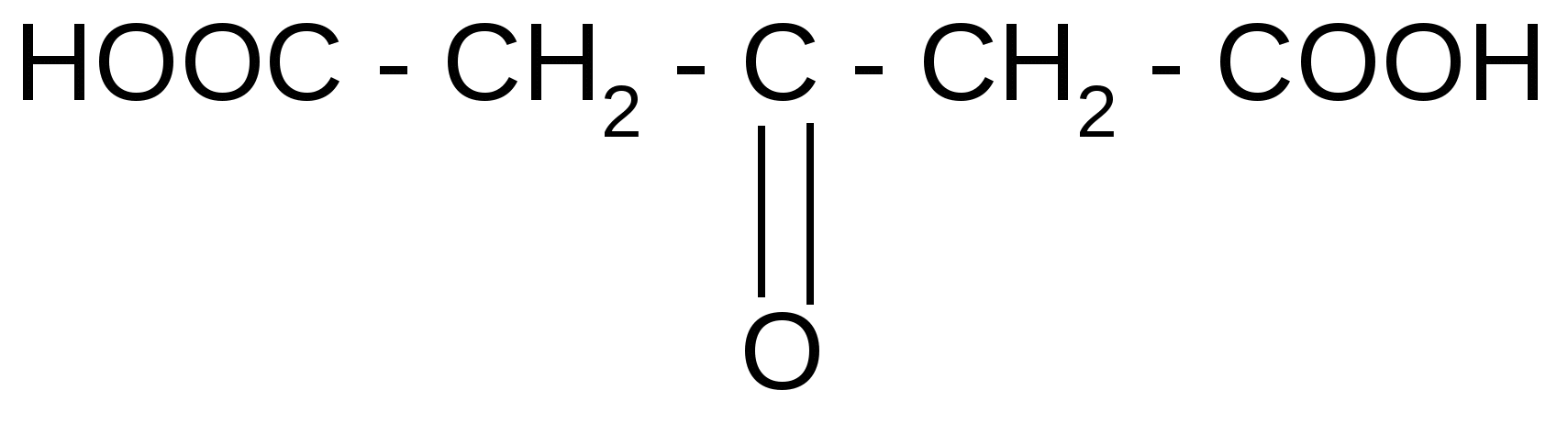 t°, H2SO4
t°, H2SO4  +
+ ацетондикарбоновая



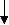 кислота
кислота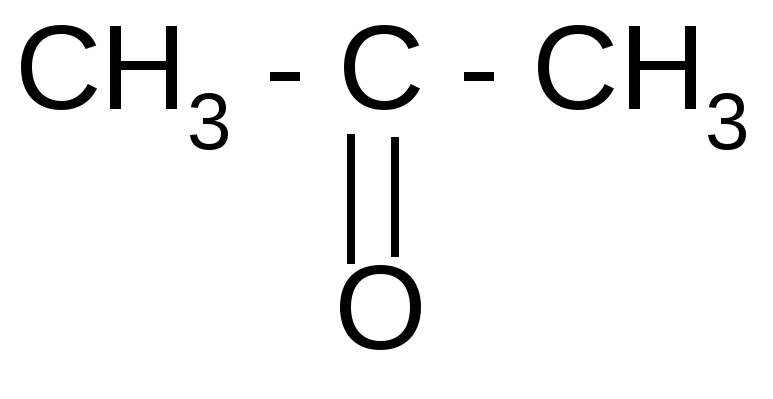 2СO2 +
2СO2 + Таблица 1
Гидрокси – и оксоальдегиды и кетоны
| Формула | Тривиальное название | ИЮПАК – номенклатура | Местонахождение в природе и биологическая роль |
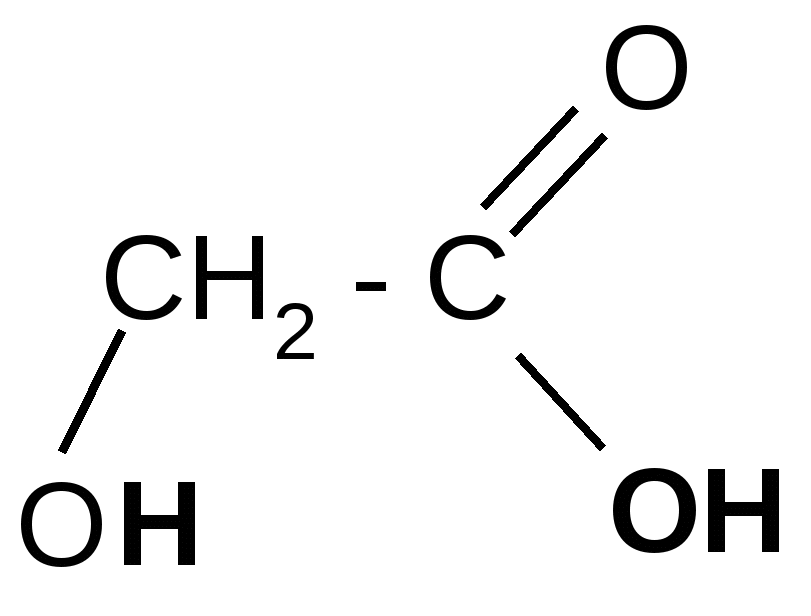
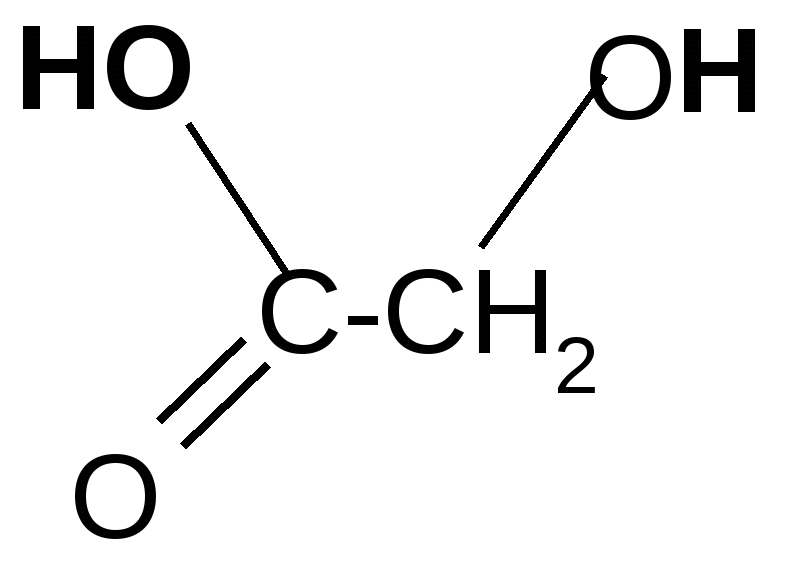
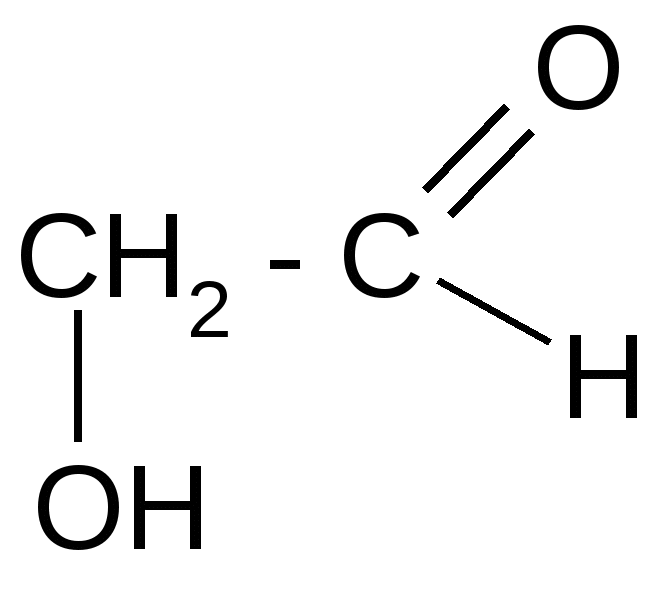  | Гликолевый, или гидроксиуксусный альдегид | 2– гидроксиэтаналь | Предшественник гликолевой кислоты |
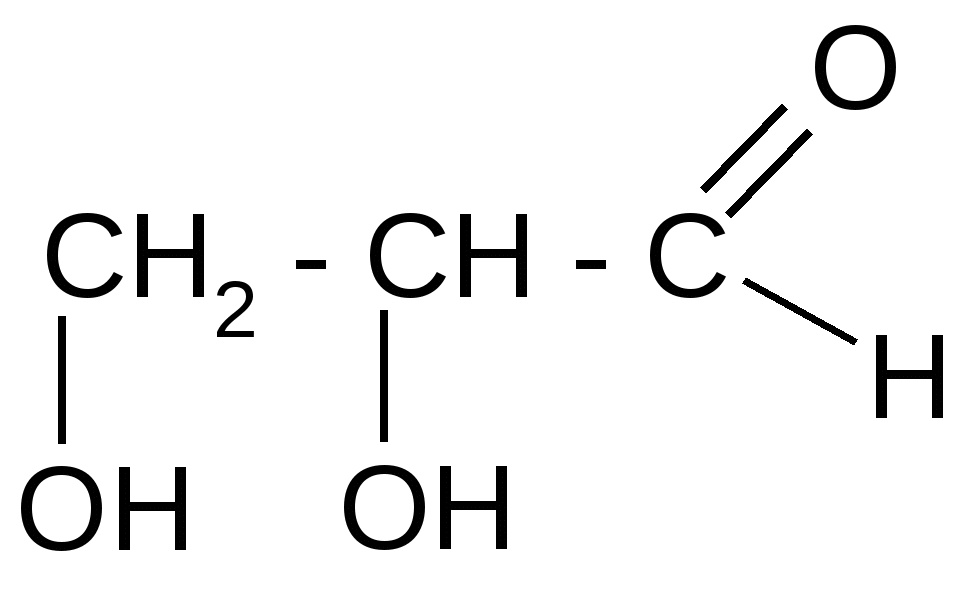
| | Глицериновый альдегид | 2,3–дигидрокси-пропаналь | Стандарт конфигурации всех «хиральных» соединений: гидрокси- и аминокислот, углеводов и др. |
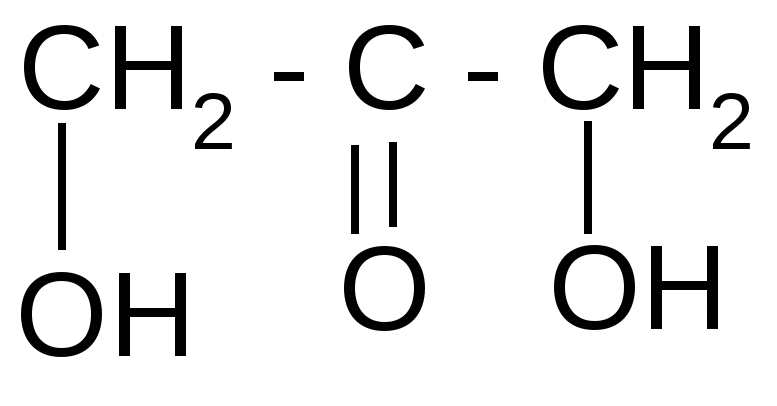 | Дигидроксиацетон | 1,3 – дигидрокси-2-пропанон | В виде фосфорно-кислого эфира встречается как промежуточный продукт при окислении глюкозы в организме |

 идроксикислоты
идроксикислоты