учебник по патфизу. Учебник для слушателей и курсантов военномедицинской академии и военномедицинских институтов под редакцией проф. В. Ю. Шанина
 Скачать 4.96 Mb. Скачать 4.96 Mb.
|
|
Расстройства нервной трофики Нервная трофика - это особый вид межклеточных взаимодействий, то есть специальные влияния нейронов, необходимые для поддержания нормальной жизнедеятельности иннервируемых ими структур - постсинаптических нейронов и клеток различных тканей. Регуляция трофических процессов в клетке осуществляется в частности через действие нейромедиаторов и нейромодуляторов. Собственно нейтрофические влияния реализует действие специальных нейротрофических факторов. При этом нейротрофические факторы реализуют медленные несинаптические взаимодействия. Данные факторы осуществляют рост, развитие, дифференцировку нейронов и участвуют в определении их нейромедиаторной природы. Молекулярная структура нейтрофических факторов (НТФ), а также их физиологические свойства весьма вариабельны. Недостаток НТФ в развивающейся нервной системе и в культуре нервных клеток нарушает формирование связей между нейронами и вызывает их гибель. Недостаточночть действия НТФ на дифференцированные клетки обуславливает развитие нейродистрофического процесса. Денервационный синдром во многом обусловлен недостаточным действием на клетки НТФ. Прекращение поступления или дефицит НТФ в тканях, граничащих с внешней средой, может привести к возникновению трофической язвы. Основными патогенетическими механизмами, действие которых приводит к возникновению нейтрофической язвы, являются:
Не исключено, что нервные окончания в тканях в патологических условиях высвобождают вещества, эффекты которых обусловливают расстройства нервной трофики (патотрофогены). Патотрофогены могут играть роль в индукции генератора патологически усиленного возбуждения, патологических детерминанты и системы нервной регуляции. Как указывает акад. Г.Н. Крыжановский, “Нейрон, иннервируемая им клетка, а также связанный с ним глиоцит составляют регионарную трофическую систему, внутри которой происходит постоянный взаимный обмен трофическими веществами ... . Нейроны ЦНС связаны между собой не только функционально, но и трофически. Нервная система представляет собой генерализованную трофическую систему, или трофическую систему. Нарушения ее деятельности являются трофическим базисом заболевания нервной системы. Нервная, эндокринная и иммунная системы вместе с периферическими тканями образуют общую трофическую систему организма. Нарушения деятельности регионарной и генерализованной трофических систем, а также общей трофической системы организма представляют собой малоизученную часть патогенеза заболеваний нервной системы”. Острая соматическая боль Острую боль следует рассматривать как индуктор системной реакции, которая на всех уровнях структурно-функциональной организации расстраивает и повреждает функциональные системы, их регуляторные и исполнительные аппараты таким образом, что снижает качество жизни и приспособительный потенциал, предрасполагая к развитию болезней и патологических состояний. Острая боль вызывает ряды причинно-следственных отношений, которые составляются звеньями патогенеза различных патологических состояний. Данные, пронизывающие все уровни организма каскады реакций, могут не затухать в течение недель и месяцев. Если острую соматическую боль не предупредить или не устранить разноуровневой эффективной проводниковой и центральной анальгезией, то в течение месяцев организм может испытывать последствия повреждения тканей как стимула системной патологической реакции. Ноцицептивное раздражение рождает систему взаимодействия патогенной боли и организма. Данная система является комплексной динамической системой. Напомним, что развитие комплексной динамической системы (КДС) определяется в начальном и кратком периоде взаимодействия явлений и объектов, вызывающего КДС. Система взаимодействия боли и организма - это КДС, которая в течение недель и месяцев определяется реактивностью организма и эффективностью анальгезии в течение короткого «острого периода» (состояние в ближайшие часы после травмы, время операции и анестезии и пр.). В данном контексте под реактивностью следует понимать не только способность к стрессорным и патологическим реакциям в ответ на ноцицептивные раздражения. Реактивность в случае острой соматической боли составляется способностью к быстрому ответу стресс-лимитирующих систем всех уровней. Активированная антиноцицептивная система выступает ведущей антисистемой, ограничивающей и блокирующей развитие КДС взаимодействия патологической боли и организма. Задача анестезиологического пособия, помощи на поле боя и догоспитальном этапе, интенсивной терапии состоит в том, чтобы вызвать состояние анальгезии как оптимума стабильной активации стресс-лимитирующих систем. При этом стабильная активация стресс-лимитирующих систем всех уровней структурно-функциональной организации наступает вслед за устойчивой активацией ноцицептивной системы. Предоперационная подготовка, анестезиологическое обеспечение, полноценная первичная хирургическая обработка в пределах здоровых тканей повышают резистентность организма к возникновению КДС взаимодействия патологической боли и организма. Резистентность такого рода во многом составляется нормальной реактивностью антиноцицептивной системы. Нормальную реактивность антиноцицептивной системы сохраняют и восстанавливают проводниковым обезболиванием, оксигенотерапией, гемодилюцией и переливанием крови строго по показаниям. Действие экзогенных опиоидов протезирует реакцию подавленной тяжелой раневой болезнью антиноцицептивной системы (АНС). После восстановления ее нормальной реактивности эффект опиоидов вызывает стойкую активацию АНС как ведущей стресс-лимитирующей системы в остром периоде тяжелой раневой болезни. В этой связи следует считать неполным и дезориентирующим определение острой боли как запрограммированной генетически физиологической реакции в ответ на действие повреждающих организм стимулов, связанных с оперативными вмешательствами, травмой и заболеваниями. Относительно давно известно о возможности устранения патологической боли как способа улучшения исходов хирургического лечения. В конце девяностых было заявлено о возрождении такого подхода на основе новых способов регионарного и проводникового обезболивания. При этом к анестезии стали относиться как к ключевому этапу и необходимому условию эффективности всей интенсивной терапии, лечебного питания и ранней мобилизации больных. Следует заметить, что анестезию без излишней депрессии с обязательным сочетанием эффективных центрального и проводникового обезболивания мы уже давно признали детерминантой исходов хирургического лечения тяжелых раненых. Это произошло на основе экстраполяции на практику анестезиологического пособия при тяжелых ранениях и травмах теории нашего учителя, пионера советской анестезиологии и послеоперационной интенсивной терапии проф. Ю.Н. Шанина. Следует заметить, что подход Ю.Н. Шанина к анестезии как к способу сохранения и восстановления качества жизни, улучшения исходов хирургического лечения красной нитью проходил через все его публикации и выступления семидесятых-восьмидесятых годов ушедшего века. Острая интраоперационная боль является тем патологическим состоянием организма (рис. 7.1), которое развивается вне зависимости от сохранения сознания пациентом. В этой связи становится ясным, что анальгетический компонент анестезии и эффективность послеоперационного обезболивания должны быть полноценными у больных в бессознательном состоянии. Отсутствие осознания болевого ощущения еще не означает отсутствия боли как патологического состояния всего организма. 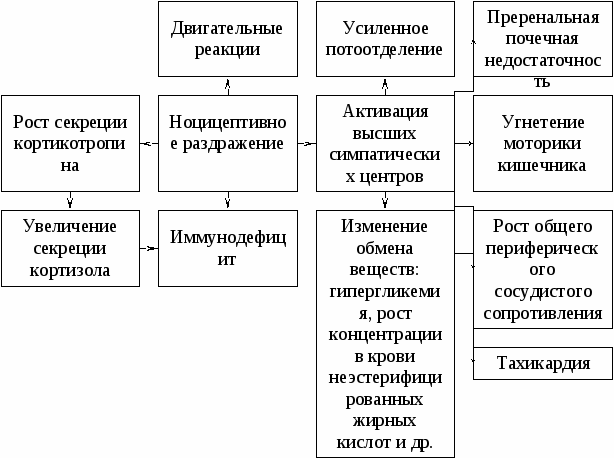 Рисунок 7.1. Системная патологическая реакция на интраоперационную боль, которая при неэффективной анальгезии персистирует в послеоперационном периоде Механизмы индукции острой боли Существует ряд раздражителей, действие которых или сразу повреждает ткани, или может вызвать повреждения при определенной длительности и силе воздействия. Такие раздражители определяют как ноцицептивные. Необходимым условием ноцицептивного характера раздражителя является определенная интенсивность его действия. Действие ноцицептивных раздражителей (ноцицептивное раздражение) механической, химической или другой природы повышает частоту разрядов, генерируемых ноцицептивными афферентами (ноцицепторами). Частота разрядов ноцицепторов находится в прямой связи с логарифмом значения силы ноцицептивного раздражения. Высокопороговые ноцицепторы реагируют ростом частоты только на раздражения, интенсивность которых выше пороговой. Разрушения тканей активируют ноцицепторы и запускают локальный воспалительный процесс. Медиаторы воспаления повышают чувствительность ноцицепторов (сенситизация) или активируют рецепторы, находившиеся в состоянии функционального покоя до первичной альтерации и воспаления. Непрерывное или периодическое высвобождение медиаторов воспаления при злокачественном клеточном росте или аутоиммунных заболеваниях резко усиливает болезненность или вызывает острую боль. Сенситизация повышает частоту разрядов ноцицепторов в условиях покоя, когда на ноцицепторы не действуют раздражители, повреждающие ткани и клетки. В очаге первичной альтерации сенситизированные ноцицепторы находятся под непрерывным воздействием медиаторов воспаления: моноаминов, цитокинов, простаноидов, пептидов, нейротрансмиттеров и факторов клеточного роста. Взаимодействия в очаге воспаления ноцицепторов и других афферент с медиаторами воспаления, нейротрансмиттерами и факторами клеточного роста обуславливают сенсорную интеграцию. Сенсорная интеграция в данном контексте - это приобретение большинством составляющих общего афферентного потока иоцицептивного качес-тва. Одновременно на периферии происходит модуляция (в основном усиление) ноцицептивной импулъсации. Ноцицептивная импульсация из очагов первичной альтерации как соматической, так и висцеральной локализации проводится в задние рога спинного мозга по С-, А-, и А-волокнам. В дальнейшем ноцицептивная импульсация поступает в таламус, лимбическую систему и корковые структуры. Именно они участвуют в распознавании импульсации как ноцицептивной, вызывая аффективную реакцию. На уровне задних рогов спинного мозга происходит интеграция ноцицептивной импульсации с периферии. Одновременно с интеграцией нейроны задних рогов адаптируются к ноцицептивной импульсации. К экзогенным анальгетикам, которые действуют на уровне задних рогов спинного мозга, относят:
В начале воспаления, вызванного действием ноцицептивных раздражителей, в его первые минуты и часы, происходит экспресссия протоонкогена c-fos и других генов нейронов дорзальных рогов спинного мозга. Уже в первые минуты после своего возникновения острая соматическая боль вызывает пластическую перестройку нейронов ноцицептивной системы. Это происходит параллельно с изменениями поведения (в течение одного часа после первичной альтерации). Одновременно активируются сегментарная и супрасегментарная антиноцицептивные системы. В результате растет сила нисходящих влияний со стороны ствола головного мозга. Нисходящие влияния со стороны стволовых нейронов тормозят активность нейронов ноцицептивной системы на различных уровнях спинного мозга. Кроме того, системная активация антиноцицептивной системы реализуется посредством усиления выброса и системного эффекта энкефалинов. Сразу после индукции острой боли ноцицептивные и другие нейроны ствола головного мозга оказывают влияния, угнетающие и ослабляющие ноцицептивную афферентацию. В дальнейшем, по мере своей сенситизации, они получают другую функциональную роль, то есть начинают усиливать центростремительную болевую импульсацию. Это частный случай запрограммированной нестабильности биологических систем и их элементов. Запрограммированная нестабильность представляет собой физиологическое свойство образований нервной системы. Устойчивая сенситизация стволовых нейронов, модулирующих центростремительную ноцицептивную импульсацию, - явление патологической стабильности функционального состояния нейронов центральной нервной системы. Не исключено, что устойчивая сенситизация стволовых нейронов, модулирующих ноцицептивную импульсацию, служит одним из механизмов возникновения генераторов патологически усиленного возбуждения. Патогенетические механизмы острой соматической боли и действие анальгетиков Нестероидные противовоспалительные средства и ацетаминофен угнетают активность циклооксигеназы в спинном мозге и на периферии. Посредством снижения активности энзима снижается синтез простаноидов и болезненность в очагах первичной травматической альтерации. Наиболее эффективным средством из данной группы препаратов явля-ется ацетаминофен. Препарат пока доступен не во всех странах. Известно, что системное действие нестероидных противоспалительных средств, и кеторолака в особенности, может вызвать острые почечную недостаточность и гастрит. Ведущим звеном патогенеза данных ятрогенных болезней тут выступает снижение в почках и желудке концентрации простагландинов со свойствами цитопротекторов и медиаторов стресс-лимитирующих систем. Поэтому следует по мере возможности снижать дозу нестероидных противоспалительных средств. Известны два вида циклооксигеназы, первый и второй. Угнетение активности фермента первого вида нарушает почечные экскреторные функции, нарушает целостность слизистой оболочки желудка, повышая адгезивность тромбоцитов. Вторая форма начинает экспрессироваться генами клеток эффекторов воспаления после первичной альтерации. Действие энзима второго вида усиливает воспаление и сенситизацию афферент. В настоящее время изучаются избирательные ингибиторы активности циклооксигеназы второго вида. Анальгетическая активность нестероидных противоспалительных средств в основе своей отчасти имеет угнетение экспрессии транскрипционного фактора кВ, действие которого повышает считывание с генов первичных провоспалительных цитокинов. Действие опиоидных анальгетиков - это основа терапии послеоперационной боли. Экзогенные опиоиды особенно эффективны в том случае, если тяжесть боли варьирует в диапазоне от средней до тяжелой. Действие опиоидов на поврежденные ткани снижает выраженность посттравматического воспаления. Эффект данных средств на уровне задних рогов снинного мозга блокирует и ослабляет проведение ноцицептивной импульсации. Супрасегментарное действие экзогенных опиоидов активирует центральное торможение активности ноцицептивных афферент и нейронов спинного мозга. В настоящее время в развитых странах широко применяется послеоперационная анальгезия морфином, когда пациент сам вызывает внутривенное введение поддерживающей дозы опиоида. На втором месте по частоте использования находится эпидуральная анальгезия, при которой больной дает сигнал электронному устройству о введении поддерживающей дозы анальгетика в эпидуральное пространство при возникновении болевых ощущений. Данные виды послеоперационной анальгезии по эффективности и частоте осложнений не уступают способам послеоперационного обезболивания, основанным на непрерывном внутривенном или другом парентеральном введении лекарственных средств. Сейчас известны многочисленные способы парентерального введения экзогенных опиоидов, которые используются для устранения острой боли: а) внутрь; б) периокулярный; в) внутримышечный; г) подкожный; д) внутривенный; е) ректальный; ж) трансбуккальный, то есть путем всасывания из ротовой полости; з) ингаляционный. Эффективность действия опиоидов при ингаляционном, ректальном и трансбуккальном способе не уступает таковому при внутривенном, внутримышечном и подкожном пути введения, а при ингаляционном часто является более высокой. Кроме того, для послеоперационной анальгезии используется чрезкожный путь введения опиоидов (фентанила и др.), при котором диффузия анальгетика через кожу усиливается электрофорезом. Эффективность действия ряда анальгетиков на основе экзогенных опиоидов позволяет у части больных вызвать эффективную анальгезию назначением одной дозы препарата внутрь. В частности, к таким препаратам относятся метадон и оксикодон. Препятствием для широкого практического применения такого способа обезболивания является значительное число пациентов, страдающих от неэффективной анальгезии. Опасность непрерывных инфузий наркотических анальгетиков короткого действия, альфентанила и ремифентанила заключается в таких частых осложнениях, как тошнота, рвота и центральное угнетение внешнего дыхания. В настоящее время в клинической практике широко используют местный обезболивающий эффект наркотических анальгетиков. Мы были первыми, кто применил фентанил для эффективного регионарного обезболивания у больных с тяжелой сочетанной травмой груди и после операций на органах груди и живота без какого-либо угнетения внешнего дыхания. Фентанил по катетеру периодически вводили в ретроплевральное пространство вместе с раствором местного анальгетика. Фентанил действовал на опиоидные рецепторы париетальной плевры, межреберных нервов, паравертебральных симпатических ганглиев и других образований нервной системы, участвующих в генерации и модуляции ноцицептивной афферентации. Внутрисуставное введение определенной дозы наркотического анальгетика полностью элиминирует болевые ощущения при артроскопии. Эпидуральный и спинно-мозговой пути введения опиоидов используют для устранения боли у пациентов с неизлечимыми злокачественными заболеваниями. При этом у спинно-мозговой анальгезии опиоидами нет преимуществ по отношению к эпидуральной анальгезии теми же средствами. Полагают, что наиболее эффективная анальгезия достигается при одновременном действии на сегментарном уровне и в эпидуральном пространстве местных обезболивающих средств и опиоидов. В данном случае блокада ноцицептивной афферентации местными анальгетиками снижает вторичное угнетение тормозных механизмов в совокупностях нейронов, составляющих генераторы патологически усиленного возбуждения и патологические альгические системы. В таких условиях удается устойчиво активировать нейроны сегментарных представительств антиноцицептивной системы наркотическим анальгетиком. Морфин, введенный в эпидуральное пространство в поясничном отделе, оказывает свое анальгетическое действие на уровне всех сегментов спинного мозга. Данный экзогенный опиоид, попавший в эпидуральное пространство в достаточной дозе, вызывает активацию образований антиноцицептивной системы во всех сегментах спинного мозга. Это позволяет индуцировать стойкую активацию антиноцицептивной системы морфином во всех сегментах, к чему предрасполагает блокада ноцицептивных афферент местным анальгетиком, введенным эпидурально. Частичные агонисты μ рецепторов морфина (трамадол, бупренор-фин и др.) не являются обезболивающими средствами, более эффективными, чем морфин. Эти анальгетики гораздо реже вызывают такие побочные эффекты наркотических обезболивающих средств, как угнетение внешнего дыхания, расстройства перистальтики кишечника и устойчивый спазм сфинктера мочевого пузыря. Это можно отнести и к средствам, которые являются агонистами других, кроме µ, рецепторов морфина: агонист к рецепторов буторфанол и др. Клонирование µ,Δ, к рецепторов морфина позволило полностью идентифицировать все детали их строения. В результате были синтезированы опиоиды со свойствами избирательных агонистов Δрецепторов. В эксперименте данные средства вызывали анальгезию без привыкания и угнетения моторики кишечника у экспериментальных животных. Известна ведущая роль афферентного звена в формировании регуля-торных аппаратов функциональных систем и закреплении патологических систем нервной регуляции на различных уровнях ЦНС. В этой связи становится понятной благотворная роль местного и проводникового обезболивания в анестезиологическом обеспечении хирургических вмешательств, в предупреждении и устранении послеоперационной боли и терапии болевых синдромов другого происхождения. Источники активации стресс-реализующих систем в остром периоде тяжелой раневой болезни Известны патологические реакции, вызываемые тяжелыми операциями и травмой. В частности, к ним относят связанные друг с другом системную воспалительную реакцию, иммунную анергию и патологическую боль. На уровне головного мозга боль усиливает афферентный вход из лимбической системы в гипоталамус. Афферентация из лимбической системы в гипоталамус интегрируется его паравентрикулярным ядром. Таким образом, боль действует как стимул патологического стресса. Массивы некробиотических тканей при ожоговой болезни, тяжелых сочетанных ранениях и травмах высвобождают в циркулирующую кровь интерлейкины (интерлейкин-1, интерлейкин-6 и др.). В результате растет действующая концентрация интерлейкинов в крови. Это повышает поступление интерлейкинов с периферии в головной мозг, где они действуют на свои гипофизарные рецепторы. Возбуждение гипофизарных рецепторов интерлейкинов усиливает секрецию кортикотропина и вазопрессина. Массив некробиотически измененных тканей (очаг посттравматических первичной альтерации и воспаления) требует своей элиминации, так как значительная часть его клеток, потеряв жизнеспособность, становится чужеродной относительно систем иммунитета и всего организма. Для достижения полезного результата элиминации массива чужеродных тканей требуется перераспределение внутри организма субстратов анаболизма и источников свободной энергии, мобилизованных нейроэндокринной катаболической системой из депо жировых, мышечных клеток и других источников. Это перераспределение происходит в интересах иммунных и других защитных систем. Для этого служит усиление секреции кортизола как стресс-реализующего гормона в ответ на возбуждение гипофизарных рецепторов интерлейкинов, которые поступают в центральную нервную систему из раны. Таким образом, рана выступает источником гуморальных переносчиков афферентации. При невозможности эффективной первичной хирургической обработки рана становится фактором патогенной гиперцитокинемии с ростом в циркулирующей крови интерлейкинов 1 и 6, то есть аномально усиленной обратной афферентации. Результат элиминации из организма массы некробиотических клеток и тканей в иерархическом отношении стоит выше, чем полезный результат положительного азотистого баланса. Поэтому повышенную секрецию кортизола (следствие усиленной обратной афферентации высвобождением интерлейкинов раной) не ограничивает снижение экспрессии и действия кортиколиберина. Секреция кортизола устойчиво повышается действием на уровне гипоталамуса интерлейкинов-1 и 6. Гиперкортизолемия как следствие гиперцитокинемии может быть фактором стрессорного голодания, иммунной анергии и сниженной иммунологической резистентности. Напомним, что стрессорное голодание - это системный дефицит в клетке продуктов анаболизма из-за блокады утилизации его субстратов-нутриентов избыточной активацией нейроэндокринной катаболической системы. Принципиально недостижимый в остром периоде тяжелой раневой болезни результат элиминации из организма всей массы некробиотически измененных тканей вызывает усиленную обратную афферента-цию. Усиление обратной афферентации обеспечивается ростом концентрации в крови ее гуморальных переносчиков, интерлейкина-1 и интерлейкина-6. В результате роста концентрации в крови интерлейкинов устойчиво активируется нейроэндокринная катаболическая система. Ее активация обуславливает длительный рост концентрации кортизола в циркулирующей крови. Усиленное действие кортизола повышает протеолиз, и в крови возрастает концентрация аминокислот. Таким образом, достигается предконечный результат защитной реакции иммунной системы: рост концентрации в крови субстратов анаболизма клеток иммунной системы с целью элиминации некробиотических клеток, тканей и продуктов цитолиза. При принципиальной недостижимости конечного результата длительное достижение предконечных результатов может вызвать ряд патологических следствий. В нашем примере одним из них является падение массы скелетных мышц как фактор замедления реабилитации. Принципиальная недостижимость полезного результата вызывает недостаточность полезных результатов других функциональных систем вследствие патологического действия гормонов и других гуморальных переносчиков афферентации, содержание которых растет во внутренней среде. В данном случае речь идет о системном действии кортизола как фактора протеолиза и иммунодепрессии. Следует заметить, что патологическая боль также служит фактором стрессорного голодания и иммунной анергии, обуславливая устойчивую активацию стресс-реализующей катаболической нейроэндокрин-ной системы. В эфферентном звене данной системы в качестве одного из главных медиаторов усиления катаболизма действует кортизол, циркулирующей с кровью в повышенной концентрации. Боль как стимул патологического стресса в остром периоде тяжелой раневой болезни действует синергически с гиперцитокинемией. Можно считать, что при сохранении патологической боли и без первичной хирургической обработки в пределах здоровых тканей в организме однонаправленно действуют и усиливают друг друга факторы стрессорного голодания и иммунной анергии. Все это снижает резистентность к инфекционным осложнениям тяжелых ранений и травм, то есть к действию наиболее частой причины летальных исходов при тяжелой раневой болезни и тяжелой травматической болезни мирного времени. Эстраполяция теорий патологических нейрональных интеграции (акад. Г.Н. Крыжановский) и анестезиологического пособия (проф. Ю.Н. Шанин) на практику лечения тяжелых раненых (результаты собственных исследований) Согласно акад. Г.Н. Крыжановскому, патологическая боль - это системное состояние нарушений и повреждений регуляторных и исполнительных аппаратов. В основе боли лежат сугубо патологические процессы, а также извращение физиологических отношений на молекулярном уровне структурно-функциональной организации. Сдвиги на молекулярном уровне в ответ на действие ноцицептивного раздражителя вызывают системную реакцию. Патологическая системная реакция обуславливает возникновение патогенных совокупностей элементов регуляторных и исполнительных аппаратов на всех уровнях структурно-функциональной организации. Эти совокупности составляют алгическую систему всего организма. Элементы патологической алгической системы усиливают действия друг друга, расстраивающие регуляцию и повреждающие клеточные элементы регуляторных аппаратов и эффекторов. Возникновение патологических боли и алгической системы всего организма связано с врожденной или приобретенной недостаточностью антиноцицептивной системы и с формированием новых патологических интеграции из первично и вторично измененных отделов системы болевой чувствительности. Эти патологические интеграции являются совокупностями элементов систем нервной регуляции, имеющими определяющее значение для патологической алгической системы всего организма. При длительном действии ноцицептивных раздражителей, угнетении тормозных механизмов, предотвращающих избыточную активацию нейронов ноцицептивной системы, возможно стойкое структурное закрепление аномальной интеграции нейронов, определяющих патологическую алгическую систему всего организма. Данная интеграция представляет собой агрегат гиперактивных сенситизированных ноцицептивных нейронов, составляющих генератор патологически усиленного возбуждения (акад. Г.Н. Крыжановский). Формирование патологической организменной алгической системы своим ключевым моментом имеет возникновение генератора патологически усиленного возбуждения. Вследствие действий генератора патологическая алгическая система всего организма выходит из-под контроля нервных и иммунных регуляторных систем, приобретая резистентность к эндогенным саногенетическим антисистемам и нейротропным лечебным воздействиям. В остром периоде после тяжелых ранений индукторами тяжелой раневой болезни служат: а) патологическая боль; б) расстройства системного и периферического кровообращения; в) связанные с микро-циркуляторным стазом, метаболическим лактатным ацидозом и усилением свободнорадикального окисления ишемия и воспаление без первичной альтерации; г) гипоксический гипоэргоз; д) вторичная иммунная анергия при системной воспалительной реакции. Первой на травму, ранение реагирует нервная система. Ее патологическая реакция расстраивает системы регуляции и повреждает клетки регуляторных и исполнительных аппаратов задолго до того, как свой вклад в патогенез тяжелой раневой болезни внесет разнообразная по происхождению токсемия, и гиперцитокинемия в частности. Тяжелое ранение - это всегда причина генераторов усиленного возбуждения и патологической алгической системы всего организма. Ноцицептивная импульсация из ишемизированных тканей смикро-циркуляторным стазом и некробиотическими изменениями клеток подавляет антиноцицептивную систему, предрасполагая к формированию генераторов патологически усиленного возбуждения. Сразу после тяжелого ранения развивается как первичная, так и вторичная недостаточность тормозных механизмов в популяциях нейронов генераторов патологически усиленного возбуждения. Первичное нарушение тормозных механизмов является следствием гипоэргоза нейронов головного мозга. Известно, что, несмотря на компенсацию гиповоле-мии веноконстрикцией, централизацией кровообращения и аутогемо-дилюцией, клетки головного мозга страдают от циркуляторной гипоксии, то есть находятся в гипоксическом гипоэргозе. Вторичная недостаточность - это следствие патогенной интенсивности ноцицептивной афферентации из поврежденных тканей. Дело в том, что в ишемизированных микроциркуляторным стазом тканях, когда расстройства микроциркуляции выходят далеко за пределы зоны первичной и вторичной альтерации, продолжают функционировать устойчивые к гипоксии ноцицепторы. Данные ноцицептивные афференты генерируют патогенную центростремительную импульсацию. Патогенная центростремительная импульсация в сочетании с кровопотерей расстраивает микроциркуляцию, внешнее дыхание респирона и системное кровообращение в большей степени, чем кровопотеря сама по себе. Патологическая алгическая система уже в первые минуты и часы служит фактором развития ряда патологических состояний (рис. 7.2). Адренергическая стимуляция мононуклеарных фагоцитов паренхимы легких, которая предположительно может быть связана с патологической болью, превращает данные клетки в эффекторы воспаления, не связанного с первичной альтерацией. Одновременный спазм легочных вен вызывает замедление тока крови по микрососудам. Микроциркуляторный стаз в легких служит исходным моментом воспаления без первичной альтерации, обуславливающего начальные стадии респираторного дистресс-синдрома взрослых. Вторичная по отношению к алгической системе избыточная адренергическая стимуляция сердца вызывает его острую нейродистрофию. Патологическая боль вызывает избыточную нейрогуморальную симпатическую стимуляцию приносящих артериол почечных клубочков и рост уровня возбуждения бета-адренорецепторов почечной паренхимы. В результате вызывается тенденция преренальной почечной недостаточности. Ее непосредственными причинами являются констрикция приносящих артериол клубочков и сокращение мезангиальных клеток как причина снижения общей площади фильтрующей мембраны почечных клубочков. Мезангиальные клетки сокращаются под действием ангиотензина-П. Напомним, что острый период тяжелой раневой, характеризует вторичный по отношению к патологической боли альдостеронизм. После минновзрывных ранений, столь частых во время афганской кампании и на чеченской войне, быстрые нейродистрофические расстройства охватывают все отделы центральной нервной системы и периферические нервные образования. Это следует связать с быстрым структурным закреплением патологических нейрональных интеграции, когда их внутренние трофические взаимодействия меняют экспрессию генома и фенотип нейронов различных отделов центральной нервной системы. Превентивная многоэлементная патогенетическая терапия предупреждает стабилизацию патологической алгической системы. Тем самым устраняется неизбежность многих патологических состояний, вызванных раневой болезнью при ее движении во времени. Анестезиологическое пособие - это базисный элемент такой терапии. Ее главный компонент - эффективная многоуровневая проводниковая и центральная анальгезия. 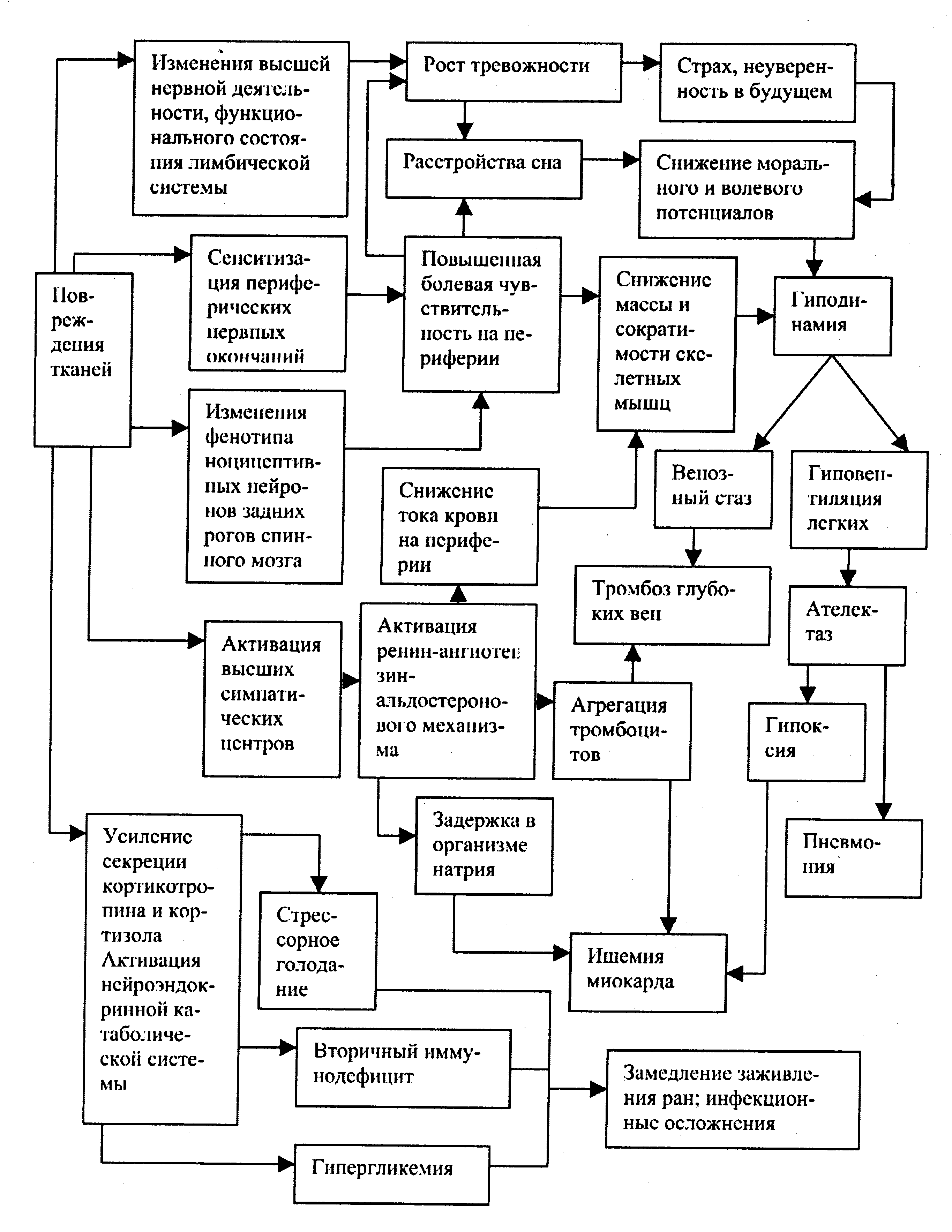 Рисунок 7.2. Следствия патологической боли во время и после ранений, травм и оперативных вмешательств Экстраполяция теории системных нервных расстройств и патологических нейрональных интеграции акад. Г.Н. Крыжановского на практику лечения тяжелых раненых позволяет постулировать принципы предупреждения патологической боли стандартизированной предоперационной подготовкой и анальгетическим компонентом общей анестезии. Общее свойство всех видов анестезии - способность дезинтегрировать ЦНС. Дезинтеграция регуляторных систем и исполнительных аппаратов как причина автономизации их элементов - универсальная биологическая закономерность и существенный признак патологии. В этой связи дезинтефирующий относительно ЦНС эффект анестезии следует рассматривать как патогенное действие наркоза и причину недостаточности нервных тормозных механизмов, в том числе и в ноцицептивной системе. Неизбирательную, дезинтегрирующую и угнетающую ЦНС анестезию можно считать воздействием, способствующим образованию патологических систем нервной регуляции и центральных представительств патологической алгической системы (ПАС). Такая анестезия способствует большим повреждениям клеток и тканей на периферии посредством влияний. При кровопотере и расстройствах микроциркуляции, вызванных тяжелыми ранениями и травмами, дефицит объема циркулирующей крови может достигать 20-30%. В таких условиях анестетики с вено-дилатирующим действием могут обусловить несостоятельность такого механизма аварийной компенсации гиповолемии, как веноконстрикция. Предпочтительней тут являются средства для общей анестезии с мягким симпатомиметическим эффектом (кетамин и пр.). Известны и другие положительные свойства анестезии кетамином: а) отсутствие выраженного депрессивного и дезинтегрирующего эффекта на центральную нервную систему; б) соматоанальгезия, вызывая которую, кетамин действует синергично с опиоидами. Уже относительно давно известно, что превышение дозы фента-нила для индукции анальгезии, которую мы использовали при вводной анестезии у тяжелых раненых, не может существенно повысить эффективность обезболивания при оперативных вмешательствах. Превышение данной начальной дозы не повышает эффективность обезболивания, если за всю анестезию вводят 50-100 мкг/кг массы тела фентанила или эквивалентную дозу последующих наркотических анальгетиков данного ряда (альфентанил, суфентанил). Лишь одновременное использование вместе с центральным обезболиванием опиоидами проводниковой анальгезии повышает эффективность анальге-тического компонента общей анестезии при использовании фентанила и других препаратов данного ряда. Таблица 7.1 Принципы предупреждения и лечения патологической боли у тяжелых раненых
Анальгезию усиливали и поддерживали введением фентанила (100 мкг) перед наиболее травматичными моментами оперативного вмешательства и при признаках недостаточного обезболивания. К таковым в первую очередь относили двигательные реакции в ответ на хирургические манипуляции, не связанные с ними нистагм и мышечные подергивания, рост артериального давления и частоты сердечных сокращений. Первичную недостаточность тормозных механизмов в ноцицептивной системе устраняли стандартизированной предоперационной подготовкой как способом снижения тяжести токсемии и циркуляторной щпоксии. Гемодилюция при гемоконцентрации у большинства тяжелых раненых повышала текучесть крови, снижая ее вязкость. С учетом того, что острый период после тяжелых ранений и травм характеризует асинхронный рост сопротивлений легочных микрососудов пре- и посткапиллярного уровней, гемодилюцию как способ снижения вязкости крови считали способом улучшения легочного газообмена. Начиная намеренную гемодилюцию еще во время предоперационной подготовки, уповали на то, что рост доставки кислорода в клетку под действиями возрастания объема циркулирующей плазмы, циркулирующих эритроцитов (один из позитивных эффектов гемодилюции), а также вследствие мобилизации микрососудов снизит первичное угнетение тормозных механизмов в популяциях нейронов генераторов патологически усиленного возбуждения. При осуществлении гемодилюции ориентировались на известную формулу: кристаллоидные-гипосомоляльные растворы, коллоидные растворы, кровь. Стандартизированную предоперационную подготовку считали показанной сразу после поступления в приемное отделение при следующих боевых ранениях и травмах:
Для предоперационной подготовки в приемном отделении производили катетеризацию периферической вены или чрезкожно заводили катетер в одну из центральных вен по Сельдингеру. Верхнюю полую вену катетеризировали через подключичную вену, внутреннюю яремную, а нижнюю полую вену - через бедренную. В приемном отделении, в предоперационной и во время вводной анестезии последовательно вливали 0,8 л 5% раствора глюкозы, 0,8 л раствора Рингера, 0,4 л реополиглюкина и 0,4 л реополиглюкина. После снижения тяжести гиповолемии, частичного устранения секвестрации части эритроцитов и плазмы на периферии, мобилизации гемодилюцией резервов альбумина блокировали нервы. Производили блокады бедренного, седалищного нервов, межреберную блокаду (двустороннюю при проникающих ранениях живота), блокаду плечевого сплетения. С учетом повышенной чувствительности тяжелых раненых к резорбтив-ному действию местных анальгетиков одномоментно не вводили более 240 мг тримекаина (лидокаина). Блокируя ноцицептивные афференты, снижали интенсивность центростремительной ноцицеп-тивной импульсации. Тем самым устраняли вторичную недостаточность тормозных механизмов в популяции нейронов генератора патологически усиленного возбуждения. Разработанные для улучшения исходов хирургического лечения тяжелых раненых предоперационную подготовку и анстезиологичес-кое пособие применили в отделении анестезиологии и реанимации военного госпиталя воюющей армии. В течение года (после внедрения) разработанную анестезию использовали при лечении тяжелых раненых. В предшествующие двенадцать месяцев (до внедрения) для лечения тяжелых раненых в госпитале использовалась анестезия-антипод. Ее характеризовали использование барбитуратов для вводной анестезии, анестезия закисью азота, отказ от проводникового обезболивания и стандартизированной предоперационной подготовки, меньшие дозы фентанила. Фентанил при проведении анестезии-антипода вводили по 100 мкг через 15-20 мин анестезиологического пособия и оперативного вмешательства. До внедрения анестезию-антипод проводили 218 раненым, поступивших в госпиталь непосредственно с поля боя (первичные раненые), которые после разнообразных оперативных вмешательств были доставлены в отделение реанимации. Из данных 218 раненых умер 61 человек. После внедрения из 185 таких же раненых умерло 28. Летальность снизилась от 28 до 15%. Показатель соответствия составил 9,8 и свидетельствовал о высокодостоверной связи (Р < 0,01) между снижением летальности и изменением содержания анестезиологического пособия. Из 40 первичных раненых, поступивших до внедрения в госпиталь с огнестрельными проникающими ранениями живота, до внедрения умерло 15 (44%), а после внедрения из 31 таких же первичных раненых умерли 7 человек (снижение летальности от 37 до 23%). Из 25 первичных пострадавших с закрытыми травмами груди и живота до внедрения умерли 11 (44%), а после - 1 из 9 человек (11%). Из 10 раненых с торакоабдоминальными ранениями до внедрения умерли 5 человек (50%), а после внедрения из 8-2 человека (25%). Из 75 раненых и пострадавших, поступивших до внедрения в отделение с данными тремя видами боевых ранений и травм, умерли 31 человек (41%), а после внедрения из 48-10 человек (21 %). Показатель соответствия составил 5,5, что свидетельствовало о достоверном снижении летальности при данных трех видах ранений и травм на 20% (Р < 0,05). Все первичные раненые как до, так и после внедрения поступали госпиталь с одних и тех же мест боевых столкновений на бронетехнике. Поэтому сроки эвакуации как до внедрения, так и после него были одинаковыми (0,5-1 ч). Одинаковой в двух совокупностях раненых была и частота шока II-IV степени, который констатировали на основании классификации тяжести шока в соответствии с величинами артериального давления и частоты сердечных сокращений. Если из раненых и пострадавших с огнестрельными проникающими ранениями живота, закрытыми травмами груди и живота, торакоабдоминальными ранениями, минно-взрывными ранениями и травмами, с проникающими ранениями груди находящимися в шоке II-IV степени до внедрения были признаны 47 человек из 133 (35%), то после 44 из 109 (40%). Показатель соответствия составил 0,9, что свидетельствует о недостоверных различиях по частоте состояния шока II-IV степени. Наибольшего повышения эффективности хирургического лечения под действием разработанной анестезии мы ожидали у раненых и пострадавших с минно-взрывными ранениями и травмами нижних конечностей, которые не сочетались с проникающими ранениями груди и живота, черепа, с закрытой черепно-мозговой травмой. При таких боевых повреждениях эффект анестезии как определяющего начального этапа интенсивной терапии был более значимым. Напомним, что первый закон реаниматологии (Ю.Н. Шанин) гласит: интенсивная терапия эффективна лишь при относительных сохранности структуры организма и координирующей функции центральной нервной системы (ЦНС). Из 46 раненых с минно-взрывными ранениями и травмами нижних конечностей, тяжесть состояния которых служила показанием к лечению в отделении реанимации, после внедрения умерли 4 человека (9%), тогда когда после внедрения из 37 таких раненых умерли 9 человек (24%). Это снижение летальности было особенно значительным при минно-взрывных ранениях (от 29 до 10%), достоверность чего подтверждает показатель соответствия (4,9). Об эффективности разработанных предоперационной подготовки и анестезии как способа предупреждения осложнений острого периода тяжелой раневой болезни говорит анализ сроков летальных исходов после проникающих ранений живота, груди и торакоабдоминальных ранений. Если до внедрения в первые-вторые сутки после ранений и поступления в госпиталь в отделении реанимации умерли 30% первичных раненых с данными боевыми повреждениями, то после внедрения в эти сроки из таких первичных раненых не умер никто. Если учесть, что до внедрения в первые-вторые сутки после тяжелых ранений и травм раненые погибали только в связи с такими осложнениями шока и кровопотери, как жировая эмболия, острая почечная недостаточность и респираторный дистресс-синдром взрослых, то разработанные предоперационную подготовку и анестезию можно считать эффективными способами предупреждения данных осложнений тяжелой раневой болезни. Следует заметить, что жировой эмболии и олигурической почечной недостаточности без первичного травматического повреждения почек у первичных раненых после внедрения не развивалось. Итак, разработанные предоперационная подготовка и анестезиологическое обеспечение как способы предупреждения динамической патологической алгической системы в период ее возможной индукции посредством сохранения нормальной системной регуляции компенсаторных процессов, а также структуры и массы эффекторов качественно улучшали исходы хирургического лечения тяжелых ранений и травм в военном госпитале. |
