Учебнометодический комплекс Аналитическая, физическая и коллоидная химия
 Скачать 1.36 Mb. Скачать 1.36 Mb.
|
G = RT Г/СВсе растворимые вещества по их способности адсорбироваться на границе раствор-газ можно разделить на две группы: -поверхностно-активные вещества и поверхностно-инактивные. (неактивные). ПАВ – это вещества, при растворении которых понижается поверхностное натяжение на границе раздела фаз. ПАВ, способны накапливаться в поверхностном слое, происходит положительная адсорбция. ПАВ должны обладать: - поверхностным натяжением меньше G растворителя, - сравнительно малой растворимостью, - способностью резко изменять свойства поверхности адсорбента в результате образования тонких мономолекулярных адсорбционных слоев. Примером ПАВ в отношении воды могут служить многие органические соединения: жирные кислоты с достаточно большим углеводородным радикалом, сульфокислоты и соли, мыла, ВМ спирты, амины, различные жиры. Характерной особенностью строения всех ПАВ является дифильность, т е состоят из двух частей – полярной группы и неполярного углеводорода или ароматического радикала. Обладающая значительным дипольным моментом и хорошо гидратирующая полярная группа обусловливает сродство ПАВ к воде. Гидрофобный углеводородный радикал является причиной пониженной растворимости этих соединений. В связи со строением дифильной молекулы ПАВ ее изображают символом ---O - где кружок соответствует полярной группе (гидрофильной), а черточка – неполярному радикалу (гидрофобной). Поверхностно- инактивные вещества стремятся уйти с поверхности жидкости в объем, в результате чего наблюдается отрицательная адсорбция П - инактивные вещества должны обладать следующими свойствами: -поверхностное натяжение должно быть больше поверхности натяжения растворителя -их растворимость должна быть высокой. П -инактивные веществами в отношении воды являются все неорганическими веществами (электролиты) – кислоты, щелочи, соли. Молекулы не имеют гидрофобной части и распадаются в воде на полярные хорошо гидратирующие ионы. Поверхностное натяжение водных растворов органических веществ, подчиняется правилу Траубе (1891): В любом гомологическом ряду при малых концентрациях удлинение углеродной цепи на СН2 группу увеличивает поверхностную активность в 3-3,5 раза. Ленгмюр определил, что правило Траубе справедливо лишь при свободном расположении адсорбированных молекул в поверхностном слое паралллельно поверхности.( с удлинением цепи углеводородного соединения растворимость его в воде падает: Уксусная - неограниченно растворима Пропионовая растворима Масляная растворима Валериановая мало растворима Капроновая не растворима Стеариновая не растворима (0,034 г на 100 г воды). Спирт этиловый неограниченно растворяется в воде, амиловый спирт (С5Н11ОН– амиловый при 220С –2,7г на 1-00 г воды) Исследование водных растворов жирных кислот показало, что для них зависимость поверхностного натяжения от концентрации выражается уравнением Б.И. Шишковского (1909) ∆G = в ln (С/К +1) в и К- постоянные, в- одинаково для всего гомологического ряда, а К увеличивается в 3-3,5 раза для каждого последующего члена ряда в соответствии с правилом Траубе. Явление адсорбции имеют большое практическое значение. Адсорбция газов и паров на твердых адсорбентах лежит в основе сорбционной техники, применяемой для борьбы с отравляющими и вредными для здоровья газами и парами в воздухе, как для военных целей так и в работе ряда производств. Адсорбция газов и паров имеет первостепенное значение при кондиционировании воздуха. Большое значение имеет применение адсорбентов (угля, силикагеля) для улавливания паров бензина при химической чистке тканей, сероуглерода - в резиновой промышленности, паров летучих растворителей в производстве лаков, целлулоида, искусственных волокон, кинопленки. С явлениями адсорбции связано получение устойчивых эмульсий, играющих огромную роль в пищевой, кожевенной, фармацевтической и др отраслях промышленности. Адсорбция из растворов нашла применение для хроматографического анализа. Он основан на разделении компонентов раствора, благодаря их различной адсорбируемости, на одном и том же адсорбенте. Контрольные вопросы1.Вещества поглотители называются… 2. По линейной изотерме Фрейндлиха можно определить… 3. Ионная адсорбция может протекать по механизмам… 4.Правило открытое Панетом и Фаянсом основано… 5.Важнейшей характеристикой сорбционного процесса является… 6.Сорбатами называются … 7.Твердые поверхности несмачиваемые водой называются 8. Гидрофильными называются поверхности… 9.Гидрофобными называются поверхности… 10.Гетерополярными адсорбентами называются … 11.Анионитами называются… 12.Количественной мерой процесса смачивания служит… 13.Наиболее глубокое взаимодействие поглощенного ве-щества и поглотителя с образованием нового химическо-го вещества называется А. Абсорбцией В. Хемосорбцией С. Десорбцией D. Адсорбцией Е. Капилярной конденсацией 13.Обратный процесс сорбции называется А. Адсорбцией В. Хемосорбцией С. Десорбцией D. Абсорбцией Е.Капилярной конденсацией Задачи 1.Рассчитать, сколько органической кислоты может быть поглощено почвой, если в почвенном растворе установилась равновесная концентрация 12,1 моль/л., Константы уравнения Фрейндлиха равны: К=1,5, 1/n =0,15. 2.Рассчитать, сколько органической кислоты может быть поглощено почвой, если в почвенном растворе установилась равновесная концентрация 2,3 моль/л. Константы уравнения Фрейндлиха равны: К=2,5, 1/n =0,6. Лабораторная работа Опыт 1. Адсорбционные свойства почвы. Приборы и реактивы. Стеклянная воронка, ватный тампон, стакан на 50 мл, метиленовый синий. Выполнение работы. В стеклянную воронку положить ватный тампон и насыпать воздушно-сухую почву так, чтобы после уплотнения слой ее был толщиной около 5см. К 50мл воды в стакане прибавить 3-5 капель метиленового синего (или фиолетовых чернил) и пропустить раствор через слой почвы. Почему из воронки вытекает бесцветный раствор? Что поглощает почва из раствора? Опыт 2. Обменная адсорбция в системе почва-раствор соли. Приборы и реактивы. Коническая колба на 200 -300мл, бумажный фильтр, почва, метиловый оранжевый, дистиллированная вода, 1н раствор ацетата натрия. Выполнение работы. Несколько граммов воздушно-сухой почвы встряхнуть в конической колбе со 100 мл дистиллированной воды в течение 1-2мин. Затем часть суспензии отфильтровать через бумажный фильтр и к прозрачному фильтрату прибавить 3-4 капли метилового оранжевого. Если раствор покраснеет (кислая среда), то в колбу прилить новую порцию свежей дистиллированной воды и повторить операцию, пока реакция почвы не станет нейтральной, т. е. прибавление не станет давать кислую реакцию. К отмытой почве добавить примерно 100 мл 1н раствора ацетата натрия, встряхнуть несколько раз и профильтровать через бумажный фильтр. К прозрачному фильтрату прибавить 3-4 капли метилового оранжевого и зафиксировать изменение окраски раствора. Для сравнения такое же число капель индикатора прибавить к исходному раствору ацетата натрия. После взаимодействия ацетата натрия с почвой он сильно подкисляется и поэтому метиловый оранжевый окрашивает его в красный цвет. В исходном растворе ацетата натрия метиловый оранжевый имеет желтую окраску (почва, как известно, состоит из органической и минеральной частей). Содержащиеся в почве в поглощенном состоянии ионы водорода, могут обмениваться в эквивалентных количествах на любые другие катионы, в том числе и на натрий. Вот почему, раствор ацетата натрия после взаимодействия с почвой подкисляется, что фиксируется по изменению окраски индикатора.) Опыт 3. Ионообменные свойства почвы. Приборы и реактивы. Пробирки, колбы на 50 мл, воронка, фильтры, хлорид меди, гидроксид аммония, хлорид кальция, оксалат аммония, воздушно-сухая почва. Выполнение работы. К 2-3 мл раствора хлориду меди прилить избыток гидроксида аммония. Раствор окрасится в интенсивно синий цвет, т.е в растворе присутствуют ионы меди. В другой пробирке к 2-3 мл раствора хлорида кальция прилить раствор оксалата аммония, выпадет белый осадок оксалата кальция, т.е присутствуют ионы кальция. Налить в колбу 20 мл 0,1% раствора хлорида меди, прибавить 5г измельченной воздушно-сухой почвы и взбалтывать с интервалом 5-6 мин. Через 30 мин смесь профильтровать. К 2-3 мл фильтрата в одной пробирке прибавить избыток гидроксида аммония, синей окраски не появляется. К такому же объему фильтрата прибавить раствор оксалата аммония, появляется белый осадок. Объяснить, почему в фильтрате отсутствуют ионы меди, но присутствуют ионы кальция. Опыт 4. Разделение катионов Ag+, Pb 2+, Hg2+ бумажной хроматографией. Приборы и реактивы: фильтровальная бумага, микрошприц, кисточка, пинцет, растворы солей: HgCl2, Hg2Cl2, AgNO3, Pb(NO3)2 Выполнение работы Фильтровальную или хроматографическую бумагу с плотностью 75 г/см погрузить в раствор иодида калия на 3–5 минут в чашку Петри. Бумагу извлечь пинцетом, высушить над плиткой. В химический стакан налить по 0,5мл растворов HgCl2, AgNO3, Pb(NO3)2. На центр фильтровальной (хроматографической) бумаги нанести каплю смеси, после полного растекания раствора, нанести еще каплю смеси, потом 2–3капли дистиллированной воды, далее раствор смеси и так далее (3–5раз). Полученную первичную хроматограмму высушить, при этом на бумаге должны появиться цветные кольца: в центре бумаги зеленое пятно – иодида ртути (Hg2J2), далее красная зона иодида ртути HgJ2, потом светло–желтая зона иодида серебра – AgJ и желтая зона иодида свинца PbJ2. При получении первичной хроматограммы катион Ag+ препятствует обнаружению катиона Pb2+. Поэтому первичную хроматограмму нужно проявить раствором гидроксида натрия. Для этого кисточку смачивают раствором NаОН и проводят по поверхности бумаги от центра к краю. На вторичной хроматограмме зона иодида свинца обесцвечивается, образуется плюмбит натрия –N а2PbО2. Зона иодида свинца обесцвечивается, образуется оксид серебра– AgО2 . Вторичную хроматограмму высушить и наклеить в лабораторную тетрадь. Опыт 5. Хроматографическое разделение ионов железа, меди и кобальта. Приборы и реактивы. Бюретка, штатив, стакан, оксид алюминия, растворы солей: Fe3+, Cu2+, Co2+, раствор K4 Fe(CN)6, секундомер. Выполнение работы. Один конец колонки плотно закрыть кусочком ваты и сверху насыпать порошок адсорбента оксида алюминия (высота столба адсорбента 2,5 см, диаметр 0,8см). Порошок уплотнить, осторожно постукивая по стенке колонки стеклянной палочкой. Слить по 2 мл 0,05% растворов солей железа, меди и кобальта в одну пробирку и тщательно перемешать. Через воронку смесь растворов солей пропустить через колонку с адсорбентом со скоростью 1мл за 10мин. В зависимости от адсорбируемости и скорости движения железо и медь распределяются на разных уровнях колонки. Для их выявления через колонку пропустить со скоростью 1 мл за 10 мин 3 мл 1% раствор гексацианоферрата калия, в результате чего проявляется синяя зона берлинской лазури и коричневая зона гексацианоферрата меди. Этот опыт можно проделать методом бумажной хроматографии. Взять круглый диск фильтровальной бумаги, на нем вырезать бумажный фитилек (от края до центра диска) длиной 2см и шириной 1-2мм, отогнуть его и на место сгиба микропипеткой нанести несколько капель исследуемых растворов. Взять две одинаковые половинки чашек Петри (диаметром на 1-1,5 см меньше диаметра диска), налить в одну половину воды и поместить диск фильтровальной бумаги между двумя половинками чашек Петри так, чтобы фитилек был погружен в воду. Через 15-20 мин, вода поднимется по фитильку и смочит весь бумажный кружок, вынуть его из чашки и обработать слабым раствором гексацианоферрата калия. На фильтре появятся два окрашенных кольца. Сделать вывод. Опыт 6. Адсорбция ацетата свинца углем. Приборы и реактивы. Фарфоровая пластинка, 0,1% раствор ацетат свинца (или нитрата свинца), активированный уголь, дихромат калия (или иодид калия). Выполнение работы. В пробирку налить 3-4 мл 0,1% раствора ацетата свинца, прибавить немного активированного угля, содержимое пробирки энергично взболтать в течение 2-3 минут и профильтровать. После этого на фарфоровую пластинку нанести каплю фильтрата и прибавить к ней каплю раствора дихромата калия, если желтый осадок отсутствует, это указывает на полную адсорбцию ионов свинца активированным углем. Одновременно проделать эту же качественную реакцию с исходным раствором ацетата свинца, в этом случае образуется желтый осадок хромовокислого свинца. Опыт 7. Построение изотермы адсорбции уксусной кислоты. Приборы и реактивы. Четыре сухие колбы, бюретка, штатив, раствор уксусной кислоты (0,5н, 0,1н, 0,05н и 0,01н), активированный уголь, гидроксид натрия, фенолфталеин, фильтровальная бумага, миллиметровая бумага, калькулятор. Выполнение работы. 1.В четыре сухие колбы внести по 1 г растертого в ступке активированного угля. 2. Отмерить по 25 мл растворов уксусной кислоты (соответственно 0,5н ,0,1н, 0,05н и 0,01н). Содержимое в колбах перемешать и оставить на 30 мин., периодически взбалтывать. За это время процесс адсорбции уксусной кислоты на угле практически заканчивается. 3.Титрованием 0,1н раствора гидроксида натрия определить точную концентрацию исходных растворов, приготовленных для изучения адсорбции. Для титрования налить в колбу 5мл 0,5н уксусной кислоты, добавить 1-2 капли фенолфталеина и титровать 0,1н NaOH до изменения окраски. 4.Титрование провести и с другими концентрациями уксусной кислоты (0,1н; 0,05н; 0,01н). 5.По формуле рассчитать концентрацию для 0,5н; 0,1н; 0,05н; 0,01н кислоты. Nк = (Nщ Vщ )/ V к Полученные данные внести в таблицу.
6.Через 30 мин отфильтровать растворы от угля и как в предыдущем случае определить концентрацию кислоты после адсорбции по формуле: Nк = (Nщ Vщ )/ V к Результаты внести в таблицу. 7.Вычислить количество уксусной кислоты, адсорбированной активированным углем для 0,5, 0,1, 0,05, 0,01н растворов по формуле: х=(С1 – Ср) V· 103 ( молей), где С1, Ср – концентрации уксусной кислоты до и после адсорбции, V- объем раствора, взятого для адсорбции, м3. Результаты внести в таблицу. В нашем случае х=(С1 – Ср) 25 · 10 3 ( молей). Результаты внести в таблицу. Рассчитать отношение х/m (m- навеска угля (г)). Результаты внести в таблицу. На основании полученных данных построить график в координатахlg х/m от lgСр. Масштаб по оси абсцисс и ординат должен быть одинаковым. По графику рассчитать значение постоянных в уравнении изотермы адсорбции Фрейндлиха К и 1/n. 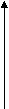 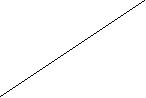 lg х/m lg х/m   lgК lgКlgСр Отрезок, отсекаемый прямой на оси ординат равен lgК, а 1/n есть тангенс угла наклона прямой относительно горизонтальной оси. Лекция 12 коллоидные системы Предметом изучения коллоидной химии являются гетерогенные высокодисперсные системы и высокомолекулярные системы. Коллоидные системы очень распространены в природе, они имеют большое значение для жизнедеятельности растений и животных. Почва, клеточный сок, белковые вещества, лимфа, кровь- все это коллоидные системы. Коллоидные системы состоят из дисперсионной среды. В дисперсных системах одна из фаз находится в мелко раздробленном состоянии и распределена в другой, имеющей непрерывное строение. Вещество, находящееся в мелко раздробленном состоянии, называется дисперсной фазой, а вещество, находящееся в виде сплошной массы - дисперсионной средой. По размерам частиц дисперсной фазы дисперсные системы классифицируются на три вида:
|
