Методичка по гормонам. Учебнометодическое пособие для самостоятельной работы студентов медицинских вузов Москва 2007 Гормоны сигнальные молекулы
 Скачать 1.02 Mb. Скачать 1.02 Mb.
|
|
3. Ключевые моменты в работе эндокринной системы. Основным понятием регуляции в животном организме является концепция гомеостаза. Она базируется на том, что различные количественные показатели, например, уровень глюкозы в крови, содержание кальция в сыворотке крови, артериальное давление, объем циркулирующей крови, соотношение свертывающей и антисвертывающей систем крови и другие поддерживаются в узких пределах, характерных для нормы. При отклонении от нее включаются различные регуляторные механизмы, включая гормональные. Гормоны в организме контролируют самые различные физиологические функции и метаболические процессы. Некоторые из них представлены в табл. 3.1. Таблица 3.1. Некоторые физиологические функции и метаболические процессы, контролируемые гормонами.
Многие из них регулируют метаболические процессы, идущие с накоплением или расходованием энергии. Депонирование энергоемких химических соединений (гликоген, белки, триацилглицеролы) позволяет организму справляться с внезапными возрастаниями энерготрат в стрессовых ситуациях. Нередко эндокринные железы функционируют по принципу реципрокных сочетаний. В результате возможно достижение точной настройки контролируемых процессов и быстрая их адаптация к изменениям окружающей среды. Так инсулин снижает уровень глюкозы в крови, а его антагонист глюкагон – повышает. При этом следует отметить, что гипергликемизирующее действие, крайне необходимое для адекватной реакции организма в острых ситуациях, обеспечивается с некоторой избыточностью гормональных эффектов, создающей своеобразную полосу безопасности. Контригулярных гормонов известно несколько. Наряду с глюкагоном ими являются кортизол, адреналин, соматотропин и ряд других. Многие гормоны контролируют экспрессию генов и этим влияют на способность тканей к росту и созреванию. Соматотропин, йодтиронин, инсулин, андрогены, эстрогены следует считать жизненно важными для растущего организма. В некоторых случаях гормоны не играют фундаментальной роли как регуляторные факторы, но их присутствие крайне актуально. Так йодтиронины не являются фундаментальными регуляторами роста и развития, но требуются для завершения этих процессов. Гипофункция щитовидной железы ведет к задержке роста. Многие гормоны обладают в организме не одним, а несколькими эффектами. В качестве примера можно привести инсулин. Он способствует снижению содержания глюкозы в крови, способствуя его поступлению в моноциты и адипоциты, стимулирует ее превращение в гликоген, задерживает распад гликогена и глюконеогенез в печени. Повышая поступление аминокислот в клетки тканей, инсулин стимулирует биосинтез белков. Регулирующее влияние инсулина на липидный обмен заключается в ускорении биосинтеза жирных кислот и триацилглицеролов в клетках тканей. Основополагающим моментом в функционировании эндокринной системы является контроль выработки и секреции гормонов по механизму обратной связи. Чаще всего эта связь носит отрицательный характер, когда конечный продукт системы регуляторных факторов подавляет продукцию первоначального. Однако существует и положительная связь, когда последний продукт стимулирует дальнейшую секрецию первого и этим ускоряет работу всей системы. В регуляции выработки гормонов могут участвовать катионы. Например, увеличение уровня Са2+ в плазме крови снижает выработку паратирина в паращитовидных железах и образование 1, 25(ОН)2-кальциферола в почках. Повышение осмотического давления внеклеточной жидкости (гиперосмолярность) стимулирует выработку антидиуретического гормона, а его снижение усиливает образование альдостерона. Высокое артериальное давление сопровождается усиленной секрецией атриопептинов в предсердиях, низкое – ренин-ангиотензина. Известны и более сложные системы регуляции по принципу обратной связи. Одна из них – регуляция функции щитовидной железы (рис. 3.1). Г ¯ ипоталамус ( 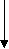  Тиреолиберин) Тиреолиберин)+ 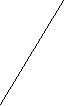 Передняя доля гипофиза (аденогипофиз) ( 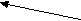 ¯ Тиреотропин)  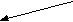 +  Т3 Т4 Щ   итовидная железа Кровь Ткани итовидная железа Кровь Ткани Рис. 3.1. Регуляция секреторной функции щитовидной железы. Йодтиронины (Т3, Т4) контролируют свою собственную продукцию по принципу обратной связи, влияя на выработку тиреолиберина в гипоталамусе и тиреотропина в передней доле гипофиза (аденогипофизе). Биосинтез гормонов нарушается при патологии эндокринной системы. Различают синдромы гормональной недостаточности или избытка гормонов. Они могут быть результатами гипофункции или гиперфункции желез. Причин эндокринных гипофункций желез выделяют несколько: 1. Наиболее часто встречающаяся – аутоиммунное разрушение железистой ткани. Примерами такой патологии являются: инсулинзависимый сахарный диабет, первичный гипотиреоз (болезнь Грейвса), первичная недостаточность коры надпочечников. 2. Разрушение или частичные повреждения эндокринных органов, вызываемые инфекционными поражениями (туберкулез), грануломатозными заболеваниями (саркоидоз), инфарктом желез. 3. Хирургическое удаление или деструкция железы под воздействием химиотерапевтического лечения или облучения также порождают гормональную недостаточность. 4. Причиной гипофункции желез могут быть мутации генов, приводящие к изменению структуры гормонов или белков-рецепторов для них. В обоих случаях имеет место состояние «гормональной резистентности». Резистентность к действию гормонов может быть наследственной, генетически обусловленной (псевдогипопаратиреоз), приобретенной (инсулинорезистентность при ожирении) или сочетанной (инсулинонезависимый сахарный диабет). Механизмы развития гиперфункций эндокринных состояний также разнообразны: 1. В крови могут появляться вещества, имитирующие гормональную активность. Они связываются с рецепторами и инициируют внутриклеточную последовательность событий, которую вызвал бы истинный гормон. Например, повышенная тиреоидная активность, наблюдаемая при болезни Грейвса, возникает в связи с избытком в крови тиреостимулирующего иммуноглобулина. Последний имитирует функцию тиреотропина на поверхности клеток щитовидной железы, усиливает выработку йодтиронинов и способствует возникновению ее гиперфункции. 2. Эндокринные опухоли, вырабатывающие избыточное количество гормонов, также могут воспроизводить картину гиперфункционального состояния. 3. Причиной состояний, сопровождающихся избытком гормонов, бывают экзогенные источники, например, передозировка вводимого в качестве лекарственного препарата инсулин при лечении сахарного диабета. Эндокринную патологию выявляют в результате комплексного обследования. Характерные симптомы дают лишь предварительную информацию. Количественное определение гормонов в крови дает более полное представление о характере эндокринной патологии. Часто используют исследование пар тестов, гормон-регулируемый параметр, например паратирин и Са2+ в крови. Иногда для точного диагноза прибегают к выполнению тестов со стимуляцией или угнетением эндокринной системой. При синдромах гормональной недостаточности проводят стимуляционный тест, при синдромах избыточной продукции гормонов – тест с подавлением функции. Еще один подход к изучению функции желез – оценка гормональной секреции или регулируемого параметра в течение длительного отрезка времени. Так определение каких-либо параметров в суточной порции мочи явно более информативно, чем в однократно полученной порции. Определение у больных сахарным диабетом в крови количества гликозилированного гемоглобина дает возможность судить о концентрации глюкозы в нем на протяжении предшествующих трех месяцев и используется для контроля за течением заболевания. Визуализирующие методы исследования: ядерные сканирования, ультразвуковые и рентгенологические исследования, компьютерная томография (КТ) и магнитно-резонансная томография (МРТ) позволяют завершить диагностику эндокринной патологии. Для лечения эндокринных гипофункций чаще всего применяют заместительную терапию. Так при недостаточности тиреоидной функции назначают таблетки тиреоидина или лиотиронина. Заместительная терапия инсулином состоит в применении для инъекций различных его препаратов, медленно высвобождающихся в кровь и имитирующих его биосинтез в поджелудочной железе. В ряде случаев заместительная терапия проводится для восполнения только конечного продукта гормональной системы. Так при поражении передней доли гипофиза со снижением выработки тиреотропина или кортикотропина назначают тиреоидин или кортизол и гипофункции желез-мишеней не проявляются. Дефицит соматотропина при гопоталамической или гипофизарной недостаточности у детей восполняют инъекциями гормона роста, получаемогопо рекомбинантной технологии. Это позволяет ребенку нормально расти. Заместительная терапия дефицита стероидных гормонов относительно проста и восстанавливает многие элементы нормального функционирования соответствующих желез. Подходов к лечению синдромов избытка гормонов существует несколько.
Задание 3.1.
Задание 3.2.
А. Гипноз как особое состояние человека. Б. Обеспечение гомеостаза в организме. В. Выработка, хранение и утилизация энергии. Г. Сон, индуцируемый пептидами «дельта-сна». Д. Рост и развитие организма.
А. Определение в сыворотке крови показателей обмена веществ. Б. Магнитно-резонансная томография (МРТ). В. Ультразвуковое исследование (УЗИ). Г. Исследование в крови количества циркулирующего гормона. Д. Рентгенологическое исследование.
А. Введение гормональных препаратов извне. Б. Применение веществ, подавляющих секреторную функцию соответствующей железы. В. Использование средств коррекции метаболических процессов. Г. Назначение лучевой терапии. Д. Введение конечных продуктов гормональной системы. Задание 3.3. Решите задачу: У женщины 39 лет изменились черты лица. Нижняя челюсть выступила вперед, появились щели между зубами. Она стала носить обувь большего размера. Ее пальцы кисти значительно увеличились. Все эти данные позволили предположить развитие акромегалии. Однако возникла проблема выявления очага поражения, которым нередко бывает доброкачественная опухоль, секретирующая гормон роста. Предложите методы визуализирующей диагностики этой патологии. 4. Механизм действия гормонов. В соответствии с делением гормонов по растворимости на гидрофильные и липофильные различают два механизма передачи сигналов в клетки-мишени: I. Мембранно-цитозольный, или косвенный. II. Внутриклеточно-ядерный, или прямой. I. Мембранно-цитозольный механизм характерен для гидрофильных гормонов и других сигнальных молекул, которые не проникают в клетки и влияют на метаболические процессы в них опосредованно. В общем виде реализация таких сигналов может быть сведена к трем основным моментам: 1. Взаимодействие гормонов с рецепторами, структурированными в плазматические мембраны клеток-мишеней. 2. Конформационная перестройка специализированных белков – первичных посредников, передающих сигналы от рецепторов белкам-эффекторам. Роль первичных посредников часто выполняют G-белки. Их так называют, потому что они связаны с гуаниновыми нуклеотидами (от англ. Guanine nucleotides). 3. Активация вторичных посредников (мессенджеров – от англ. messenger – вестник, курьер, рассыльный) – небольших молекул или ионов, диффузия которых в клетке к определенным субклеточным структурам обеспечивает стремительное распространение сигнала гормона и его реализацию каскадными механизмами. Далее о рецепторах, посредниках, каскадных механизмах подробнее. Белки-рецепторы относятся к гликопротеинами должна выполнять как минимум две функции: 1. Прием сигнала гормона. Это осуществляет гормонсвязывающий локус (домен). 2. Преобразование принятого сигнала и инициация специфических гормональных эффектов. Это реализует эффекторный локус (домен). В молекулах белков-рецепторов, локализованных в плазматические мембраны клеток, выделяют три постоянных структурных компонента: 1. Экстрацеллюлярный, находящийся снаружи. 2. Трансмембранный, пронизывающий билипидный слой плазматической мембраны. 3. Интрацеллюлярный, расположенный в цитозоле. Функции этих элементов у мембранных рецепторов в разных клетках-мишенях у одного и того же гормона могут быть разные. Так α1-, α2-, β1-, β2-адренорецепторы инициируют в клетках отличающиеся по сути эффекты. Различают три типа мембранных рецепторов. 1. Рецепторы первого типа представляют из себя интегральные белки с ферментативной активностью. Сигнальные молекулы, связывающиеся с рецептором снаружи, являются аллостерическими модуляторами, изменяющими конформацию всего белка и его ферментативную активность. Последняя обеспечивает фосфорилирование остатка тирозина в белках (рис. 4.1). Рецепторы инсулина являются тирозинкиназами. Они структурированы в плазматические мембраны клеток-мишеней. Период их полужизни составляет 7 – 12 часов. Они представляют из себя гликогенпротеины (Mr 460 кДа), состоящие из четырех субъединиц, соединенных дисульфидными связями (рис. 4.1). Наружу экспонированы две α-субъединицы (Mr по 135 кДа каждая), а две β-субъединицы (Mr по 95 кДа каждая) пронизывают плазматическую мембрану. Первые выполняют функцию гормон связывающего локуса. Вторые своими участками, выступающими в цитозоль, играют роль тирозинкиназы. Присоединение гормона к рецептору сопровождается фосфорилированием тирозина в соответственных цитоплазматических доменах. При этом одна β-цепь может фосфорилировать другую β-цепь той же молекулы рецептора (аутофосфорилирование). Теперь тирозинкиназа способна фосфорилировать и другие белки-субстраты инсулинового рецептора (англ. Insulin Receptor Substrates - IRS). В любом случае это активирует внутриклеточный сигнальный путь (Ras-путь) и реализацию информации, доставленной сюда инсулином (см. рис. 4.14). Рис. 4.1. Схема активирования инсулином рецептора первого типа, являющегося тирозинкиназой. 1 – гормон связывающий локус в α-субъединицах; 2 – центр тирозинкиназной активности в β-субъединицах; 3 – субстрат инсулинового рецептора (IRS) неактивный; 4 – субстрат инсулинового рецептора (IRS) активный; 5 – активация внутриклеточного сигнального пути (Ras-пути). 2. Рецепторы второго типа являются олигомерными трансмембранными белками, образующими гормон активирующие ионные каналы. Связывание сигнальных молекул с рецепторами ведет к открыванию каналов для Na+, K+, Cl¯ и др. Так «работают» нейромедиаторы, например ацетилхолин через N-холинорецепторы, в которых формируются Na+-каналы (рис. 4.2), ГАМК (γ-аминомасляная кислота, γ-аминобутират) через А-рецепторы (Cl¯-каналы) и др. Рис. 4.2. Схема рецептора третьего типа на примере N-ацетилхолина. 1 – участки связывания сигнальной молекулы. 2 – сформированный ионный (Na) канал. 3. Интегральные белки, относящиеся к рецепторам третьего типа, участвуют в реализации гормональных сигналов в сочетании с G-белками. Полипептидные цепи этих белков включают по семь трансмембранных тяжей и по три примембранных петли с каждой стороны (рис. 4.3). Рис. 4.3. Строение гормональных рецепторов третьего типа, сопряженных с G-белками. 1 – олигосахарид; 2 – N-конец; 3 – трансмембранные петли; 4 – С-конец. Связывание гормона с рецептором третьего типа изменяет конформацию трансмембранных тяжей и примембранных петель. Происходит резкое повышение сродства рецептора к G-белку. Возникает сигнал, передаваемый белками-эффекторами, которые являются либо ферментами (например, аденнилатциклаза, фосфолипаза С), либо ионными каналами. Функция белков-эффекторов заключается в изменении коцентрации вторичных посредников (мессенджеров). G-белки как первичные посредники передают сигналы от рецепторов третьего типа к белкам-эффекторам (рис. 4.4 А). Они состоят из трех субъединиц: α, β, γ. α-субъединица может связывать гуаниновые нуклеотиды ( англ. Guanine nucleotide): ГТФ или ГДФ. Отсюда их название G-белки. Они образуют семейство, включающее около 20 их разных форм. Но различают два их типа: Gs – стимулирующие (от англ. stimulate) «работают» с рецепторами, передающими стимулирующие сигналы возбуждения (Rs), Gi – ингибирующие белки (от англ. inhibite – ингибировать) передают от Ri сигналы торможения. В неактивном G-протеине α, β, γ-субъединицы ассоциированы в единую молекулу и к α-субъединице присоединен ГДФ (рис. 4.5 А). После взаимодействия гормона с рецептором ГДФ замещается на ГТФ (рис. 4.4.Б). Вслед за этим происходит диссоциация G-белка на две части: α-субъединицу в сочетании с ГТФ и комплекс β, γ-субъединиц. α-субъединица-ГТФ активирует белки-эффекторы. α-субъединица-ГТФ активирует белки-эффекторы (например ферменты аденилатциклазу или фосфорилазу С), что в дальнейшем приводит к накоплению в клетках вторичных посредников (рис. 4.4 В). α-субъединица проявляет слабую ГТФ-азную активность. Медленно гидролизуя ГТФ до ГДФ, она переводит саму себя в неактивное состояние и вновь ассоциирует с β, γ-комплексом и ГДФ. G-белок возвращается в исходное неактивное состояние. Передача гормонального сигнала прекращается (рис. 4.4 Г), Gs- и Gi-белки, имея одинаковые β- и γ-субъединицы (Mr 40 кДа обеих вместе), включают разные α-субъединицы. В Gs-белке α-субъединица имеет Mr 45 кДа, в Gi – 41 кДа. Рис. 4.4. Цикл конформационных изменений G-белков в процессе передачи гормонального сигнала. 1 – гормон; 2 – рецептор первого типа; 3 – G-белок; 4 – белок-эффектор (например аденилатциклаза). Вторичные посредники (мессенджеры) – это внутриклеточные вещества, концентрация которых строго контролируется внеклеточными сигналами, передаваемыми гормонами и другими сигнальными молекулами. Такие вещества образуются из доступных субстратов и имеют короткий период полураспада или являются ионами. Ими являются 3', 5' цАМФ, 3', 5' цГМФ. 1. 3', 5'-циклический аденозинмонофосфат (3', 5' цАМФ); 2. 3', 5'-циклический гуанозин монофосфат (3', 5' цГМФ); 3. Диацилглицерол (ДАГ); 4. Инозитол-1, 4, 5-трифосфат (ИФ3); 5. Инозитол-1,3, 4, 5-тетрафосфат (ИФ4); 6. Са2+. Известно несколько путей передачи сигналов с их участием. 1. Аденилатциклазный. 2. Гуанилатциклазный. 3. Фосфоинозитидный. 4. Через «медленные» неэлектрогенные Са2+-каналы. 5. Тирозинкиназный. 6. Через «быстрые» электрогенные Na+- и другие ионные каналы. I. Аденилатциклазный путь мембранно-цитозольного механизма. Это самый распространенный путь передачи гормональных сигналов. В его реализации и завершении участвуют, как минимум, шесть белков. 1. Белки-рецепторы третьего типа (рис. 4.3) взаимодействуют с сигнальными молекулами. 2. Gs- или Gi-белки играют роль первичных посредников (рис. 4.4). 3. Белок-эффектор аденилатциклаза (АЦ) катализирует реакцию образования из АТФ 3', 5' цАМФ – вторичного посредника (рис. 4.5). Он выполняет роль аллостерического активатора протеинкиназы А (индекс «А» от англ. сАМР). Аденилатциклаза (интегральный белок, имеющий 12 трансмембранных доменов) обнаружена во всех тканях и органах. Выявлено 8 ее изоформ, из которых 4 являются Са2+-активируемыми. 4. Протеинкиназа А принимает сигналы от аденилатциклазы. Фермент состоит из четырех субъединиц. Два регуляторных (R) и два католитических (С) протомера образуют структуру R2C2 (рис. 4.7). Связываясь обратимо с регуляторными субъединицами, 3', 5' цАМФ вызывает диссоциацию комплекса (C2R2 → цАМФ4R2 + C + C). Освобождающиеся отдельно друг от друга две каталитические субъединицы фактически и являются активной протеинкиназой. Она фосфорилирует различные белки, включая ферменты, и изменяет их активность (ковалентная модификация). См. рис. 4.6. 5. Фосфодиэстераза, катализирует дециклизацию 3', 5' цАМФ (рис. 4.6) с образованием просто АМФ. Ингибиторами ее являются ураты, ксантины, кофеин, теофиллин, теобромин. 6. Фосфопротеинфосфатаза, возвращающая белки, ранее фосфорилированные протеинкиназой «А», в нативное состояние (рис. 4.6). Ее активность повышается под действием инсулина. Два последних фермента обрывают передачу сигналов по аденилатциклазному пути. Рис. 4.5. Реакции, катализируемые аденилатциклазой и фосфодиэстеразой. 1 – ингибиторы фосфодиэстеразы (ураты, ксантины, кофеин, теофиллин, теобромин). Рис. 4.6. Реакции, катализируемые протеинкиназой «А» с изменением активности белка и фосфопротеинфосфатазой, возвращающей белок в нативное состояние. 1 – инсулин, активирует фосфопротеинфосфатазу. Гормоны, «работающие» по аденилатциклазному пути, могут передавать сигналы возбуждения и торможения (табл. 4.1). Таблица 4.1. |
