Решение задач
Пример 1. Какой объем раствора H3PO4 с W=30% и =1,25 г/мл потребуется для приготовления 2 л раствора с молярной концентрацией 0,2 моль/л?
Дано:
W%=30%
=1,25 г/мл
V=2 л
С(H3PO4) = 0,2 моль/л
|
Решение:
m(H3PO4) = C(моль/л)V(л)М(г/моль) = = 0,2298 = 39,2 г
m(р-ра) = 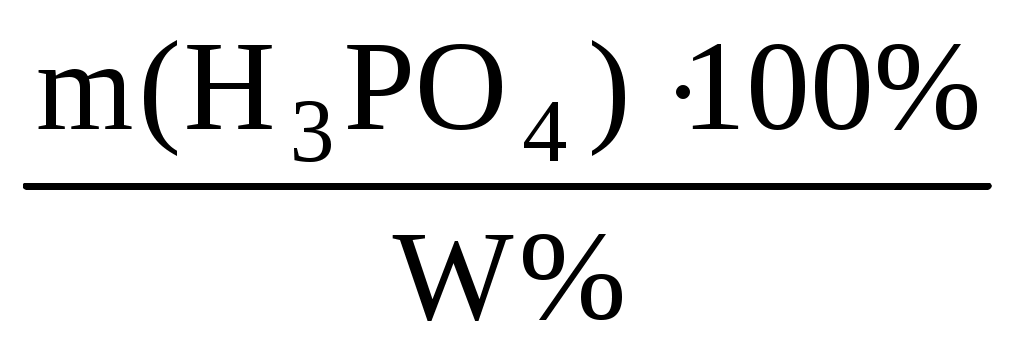 = =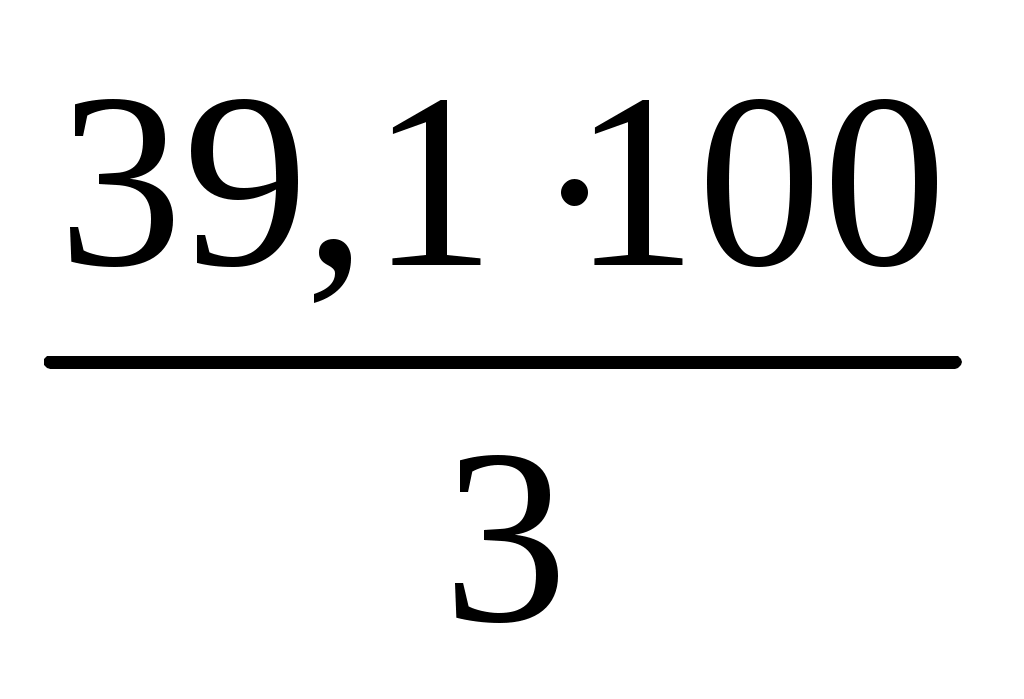 = = 130,7 г = = 130,7 г
V(р-ра) = 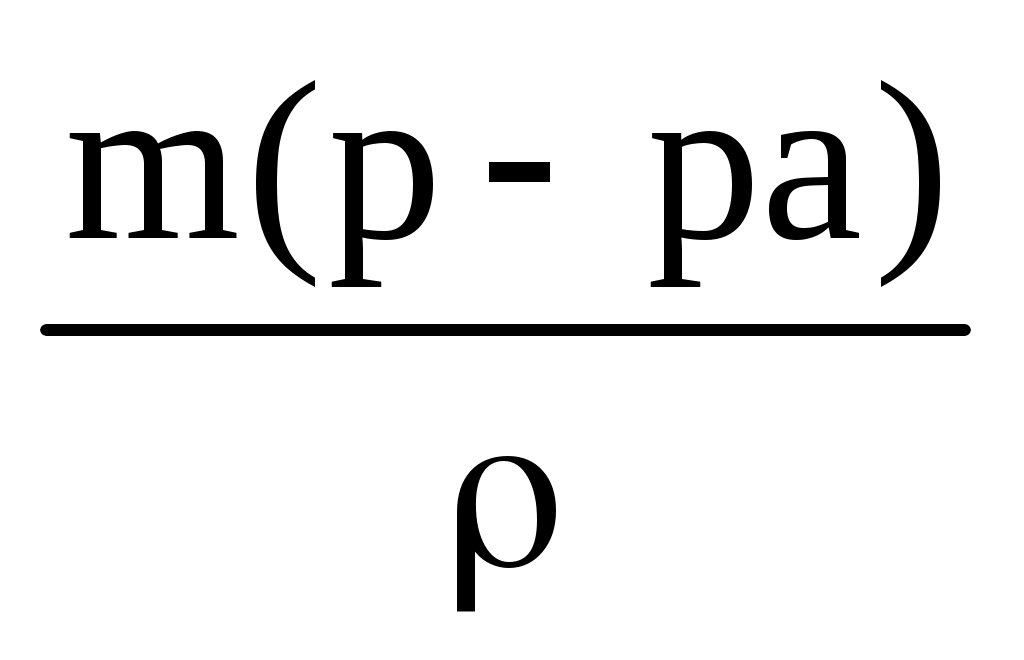 = = 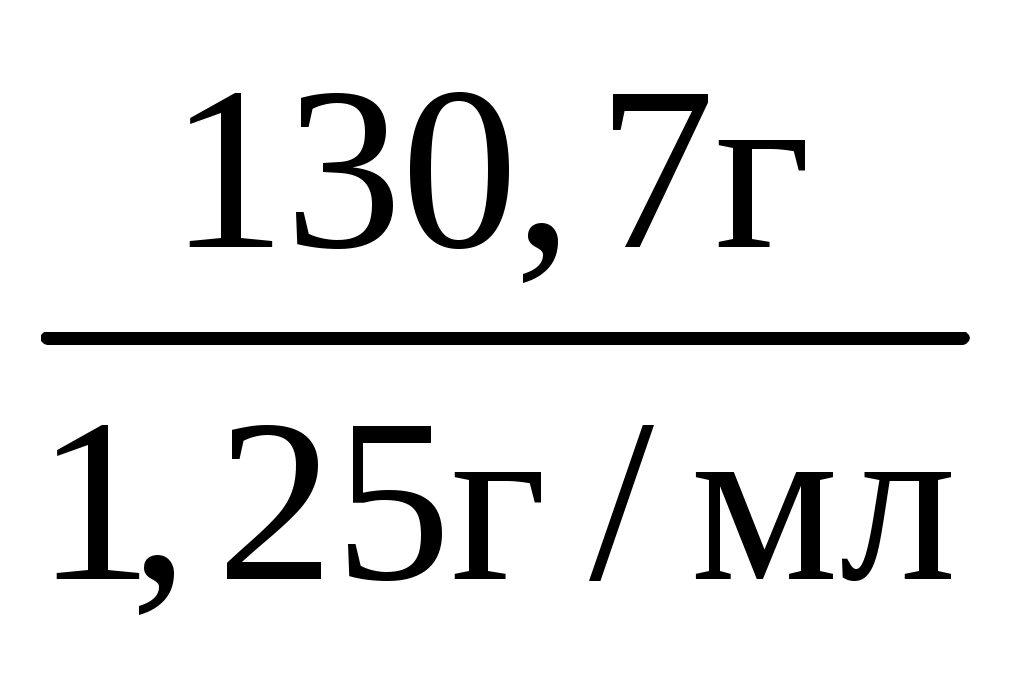 = 104,56 мл = 104,56 мл
Ответ: 104,56 мл
|
V30% р-ра = ?
|
Пример 2. Сколько граммов Na2CO3 нужно взять для приготовления 0,5 л раствора с массовой долей 12% и плотностью 1,1 г/см3?
Дано:
V(р-ра)=0,5л=500 мл
=1,1г/см3 (г/мл)
W%=12%
|
Решение:
m(р-ра)=V(p-pa) =500мл1,1 г/мл = 550 г.
m(Na2CO3)=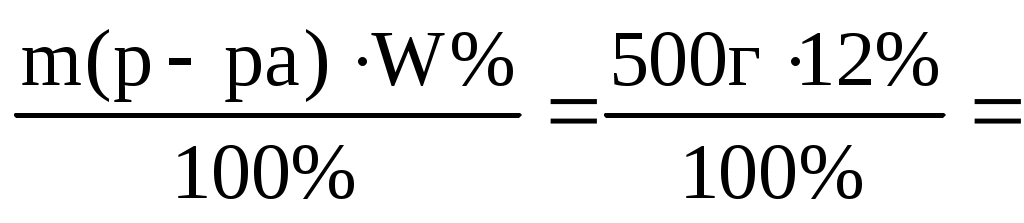 =66 г =66 г
Ответ: 66 г.
|
m(Na2CO3) – ?
|
Пример 3. Смешали 100 г раствора NaOH с W%=10% и 0,3 л раствора NaOH c W%=25% (=1,3 г/мл). Какова массовая доля полученного раствора?
Дано:
m(p-pa)1=100 г
W1%=10%
V2=0,3л
W2%=25%
2=1,3г/мл
W3% – ?
|
Решение:
m(NaOH)1=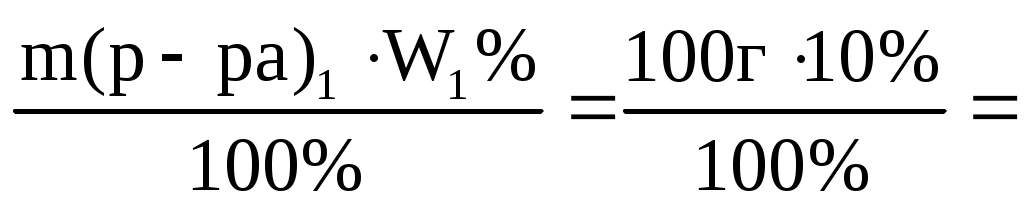
=10 г
m(р-ра)2= V22 = 300 мл1,3 г/мл = 390 г
|
m(NaOH)2=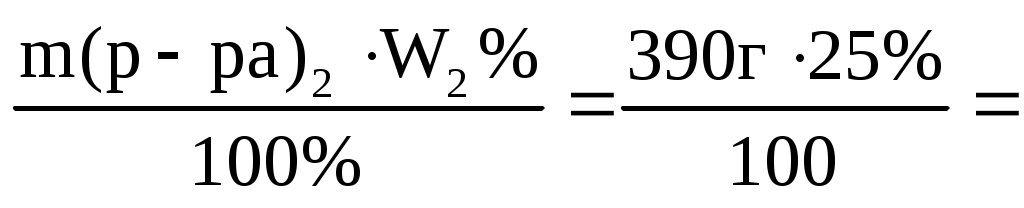 97,5 г 97,5 г
W3=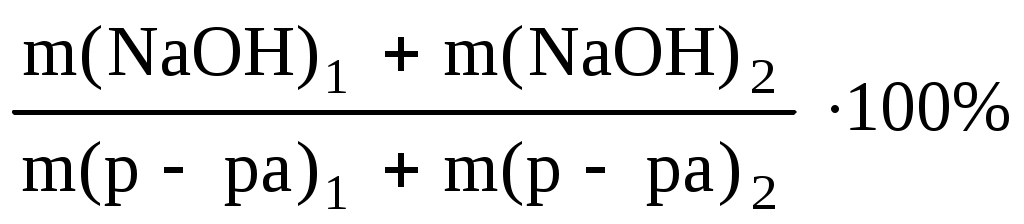 = =
=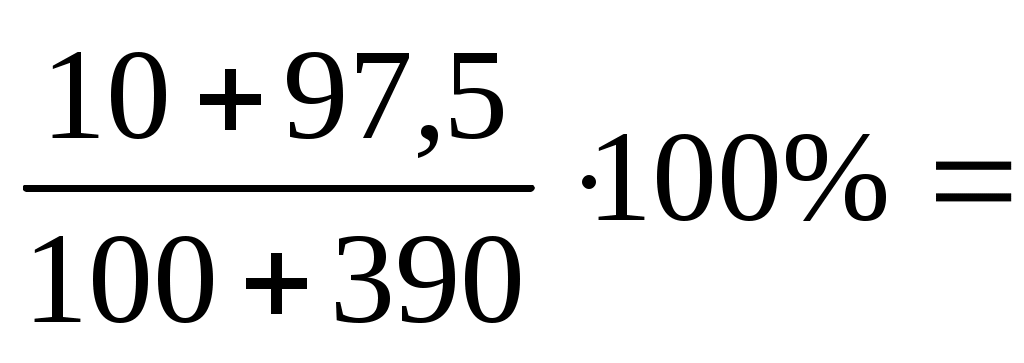 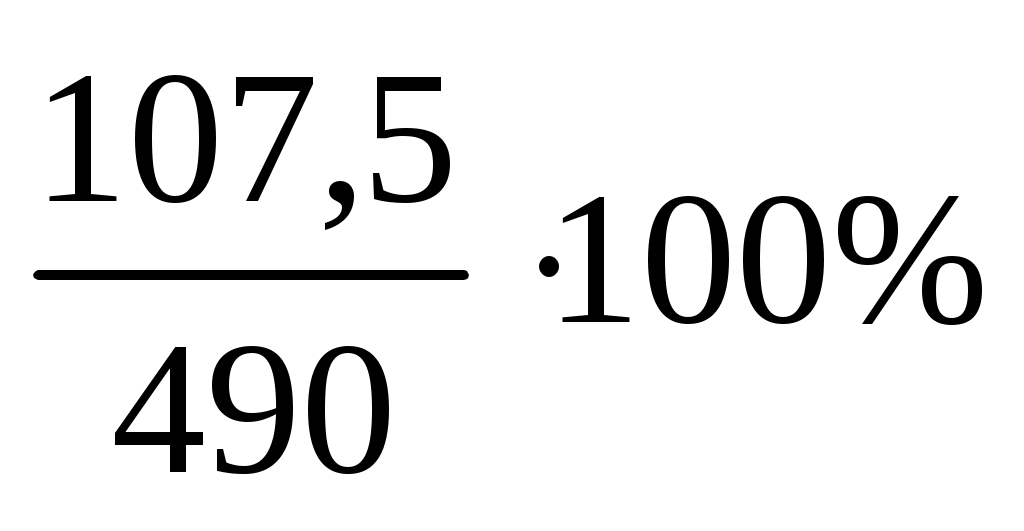 =21,94% =21,94%
Ответ: 21,94%.
|
Пример 4. (Разбавление раствора). Сколько воды нужно прибавить к 100 мл 20%-го раствора серной кислоты (=1,14 г/мл), чтобы получить 3%-ный раствор?
Дано:
W1%=20%
W2%=3%
V(р-ра)= 100 мл
=1,14 г/мл
|
Решение:
m(р-ра)=V(p-pa) = 100мл1,14 г/мл = 114 г.
m(H2SO4)=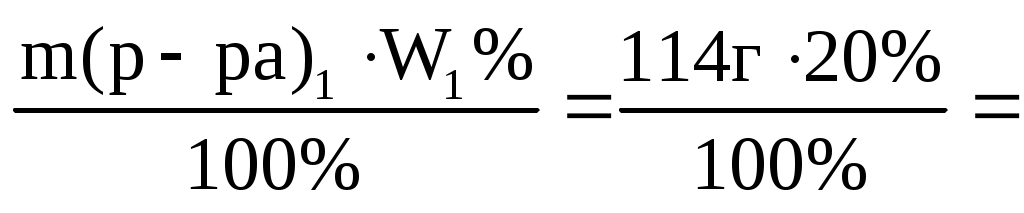 =22,8 г =22,8 г
Так как масса вещества после разбавления остается той же, то
m(p-pa)2=m(H2SO4) 100% / W2% = = 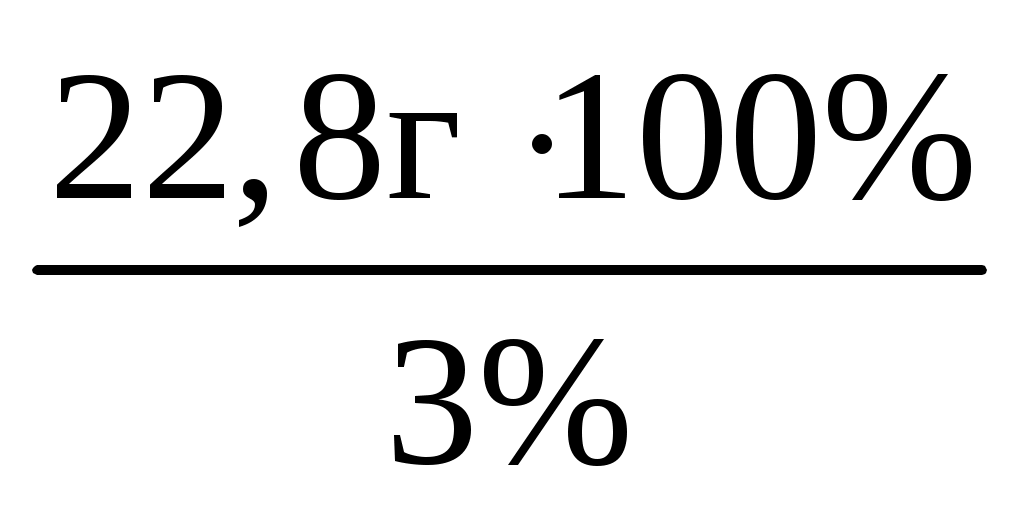 =760 г. =760 г.
4) V(H2O)=m(H2O)=760 г – 114 г = 646 г.
Ответ: 646 г или 646 мл.
|
V(H2O) или m(H2O) –?
|
Пример 5. (Укрепление раствора). Сколько граммов NaCl нужно добавить к 200 мл 10%-го раствора (=1,27 г/мл), чтобы получить раствор с массовой долей 15%?
Дано:
V(р-ра)= 100 мл
=1,27 г/мл
W1%=10%
W2%=15%
m(NaCl)доб – ?
|
Решение:
m(р-ра)=V(p-pa) = 100мл1,27 г/мл = 127 г.
m(NaCl)=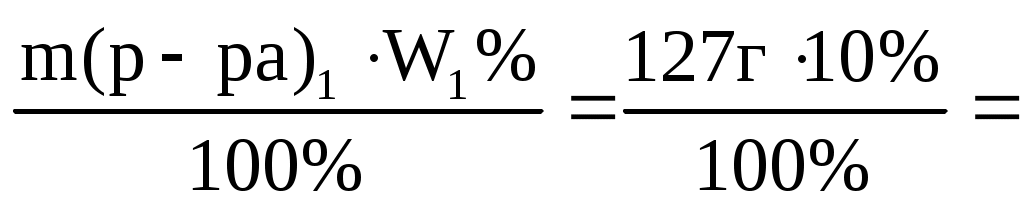 =12,7 г =12,7 г
Обозначим m(NaCl)доб за х. Тогда на х г увеличатся массы и вещества и раствора в 15%-ном растворе.
15%=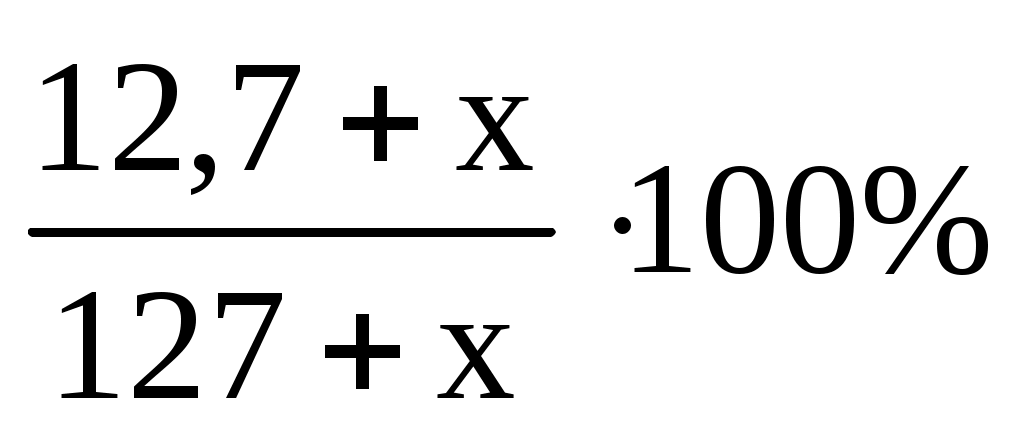
15(127+х)=(12,7+х)100
1905+15х=1270+100х
635=85х; х=7,47 г
Ответ: нужно добавить 7,47 г NaCl.
|
Пример 6. Сколько граммов щавелевой кислоты H2C2O42H2O необходимо взять для приготовления 200 мл децинормального (0,1 моль/л) раствора?
Дано:
C(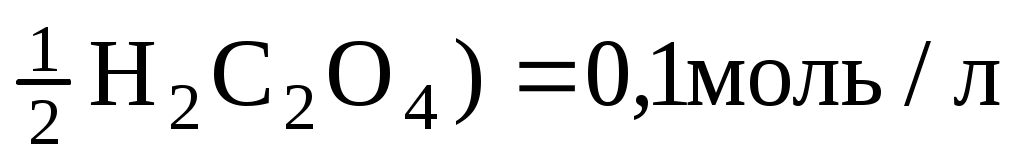
V(р-ра)= 200 мл = 0,2 л
m(H2C2O42H2O) – ?
|
Решение:
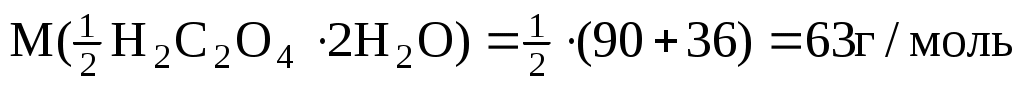
m(H2C2O42H2O)=C(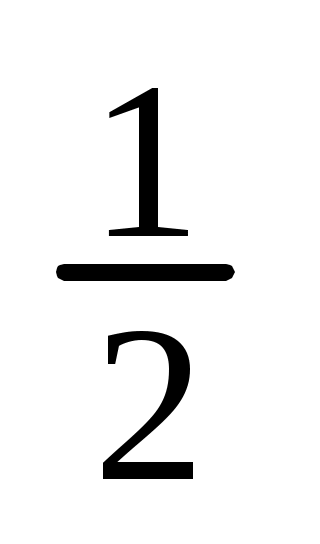 H2C2O4) V M( H2C2O4) V M(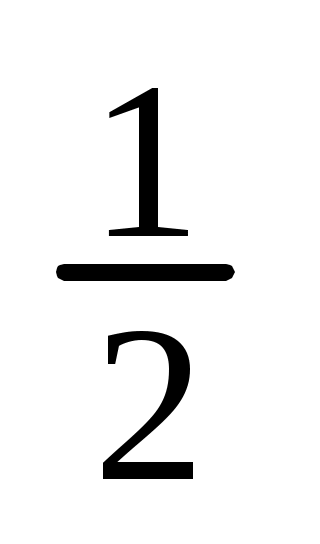 H2C2O42H2O)=0,1моль/л0,2л63г/моль= H2C2O42H2O)=0,1моль/л0,2л63г/моль=
= 1,26 г.
Ответ: 1,26 г H2C2O42H2O
|
Пример 7. Титр раствора H3PO4 равен 0,004 г/мл. Вычислить W%, C(x), C(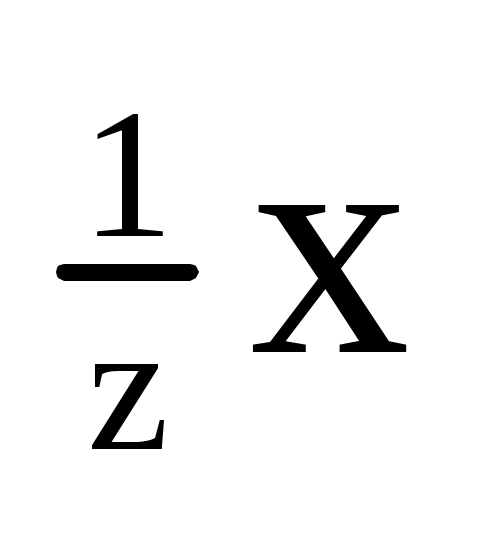 ) этого раствора, если раствора 1,15 г/мл. ) этого раствора, если раствора 1,15 г/мл.
Дано:
t = 0,004 г/мл
= 1,15 г/мл
W% –? C(x) – ? C(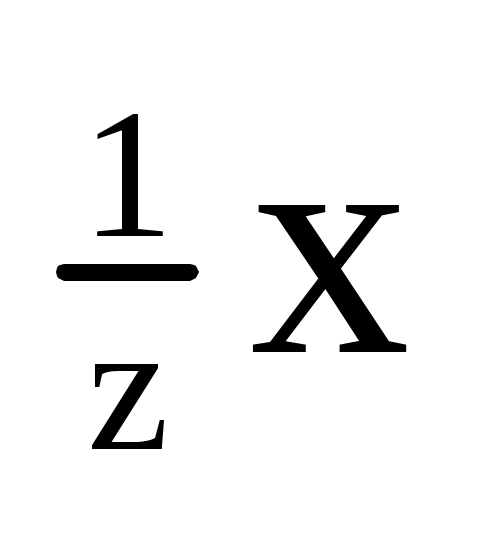 ) – ? ) – ?
|
Решение:
Воспользуемся формулами связи разных способов выражения концентрации между собой, например, формулами (11), (13) и (15).
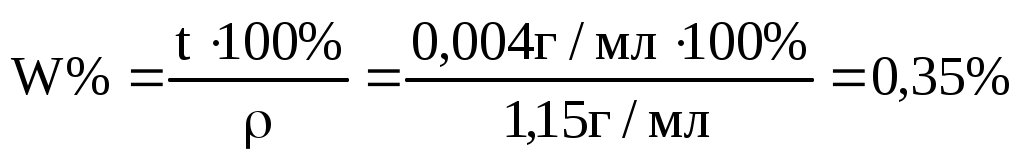
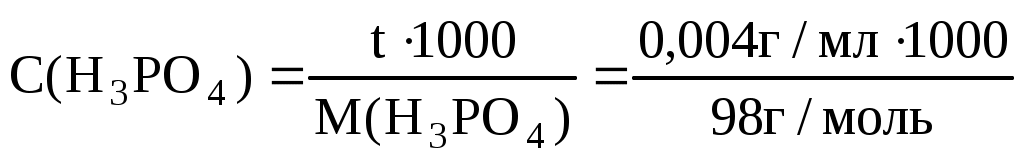 =0,04 моль/л =0,04 моль/л
C(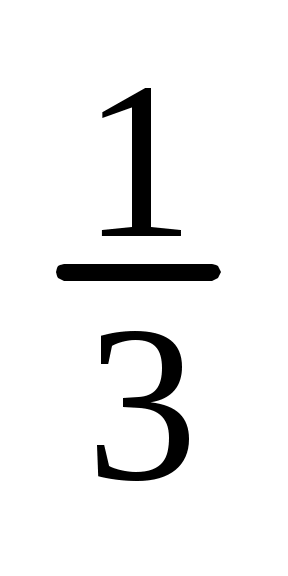 H3PO4) = C(H3PO4)Z=0,04 моль/л3= =0,12моль/л H3PO4) = C(H3PO4)Z=0,04 моль/л3= =0,12моль/л
Ответ: 0,35%; 0,04 моль/л; 0,12 моль/л.
|
Пример 8. Навеска технического карбоната калия массой 0,7 г растворена в 50 мл воды. На реакцию полученного раствора затрачено 48 мл раствора HCl с молярной концентрацией 0,2 моль/л. Определить C(K2CO3), t, m(K2CO3) в растворе и W%(K2CO3) в навеске.
Дано:
m(K2CO3)техн.=0,7 г
V(р-ра K2CO3)=0,05л
V(HCl)=0,048 л
C(HCl)=0,2 моль/л
С(K2CO3) – ? t – ? m(K2CO3) – ? W% –?
|
Решение:
m(HCl)=C(HCl) V(HCl) M(HCl) =0,048 0,236,5= =0,35 г
K2CO3+2HCl2KCl+CO2+H2O
M(K2CO3)=138г/моль; M(HCl)=36,5г/моль
Составляем пропорцию по уравнению реакции:
138 г K2CO3 взаимодействуют с 236,5=73г HCl
х г K2CO3 взаимодействуют с 0,35г HCl
m(K2CO3)=x=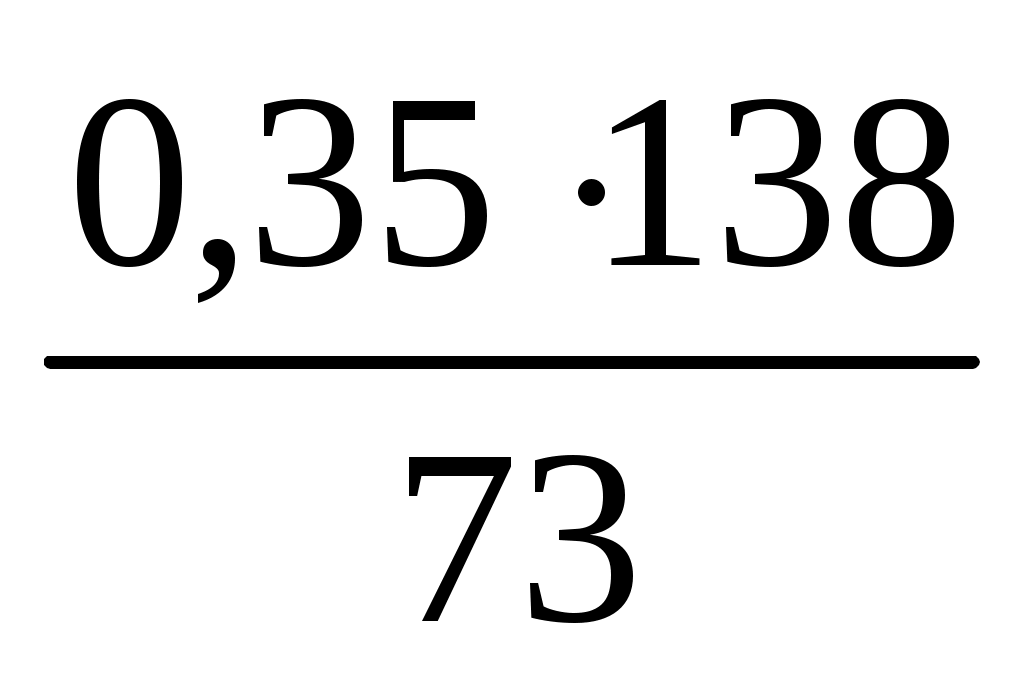 =0,662 (г) =0,662 (г)
С(K2CO3)=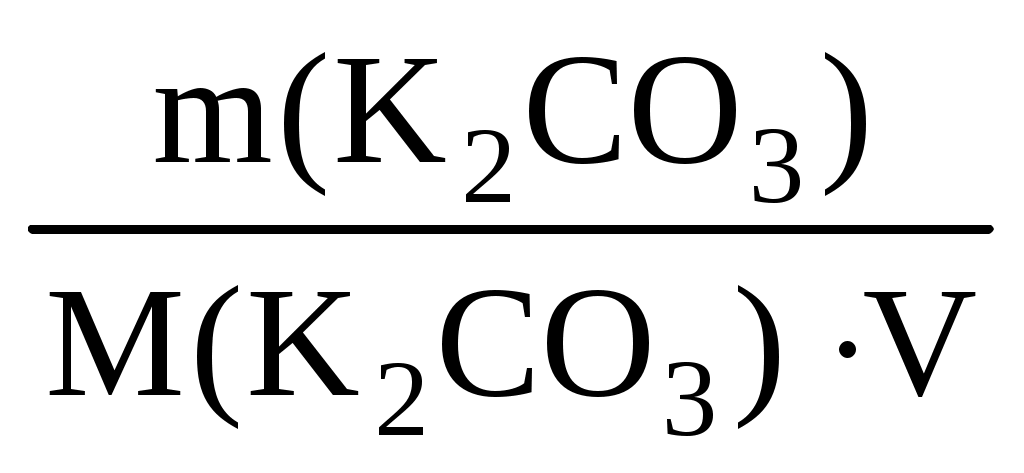 = = 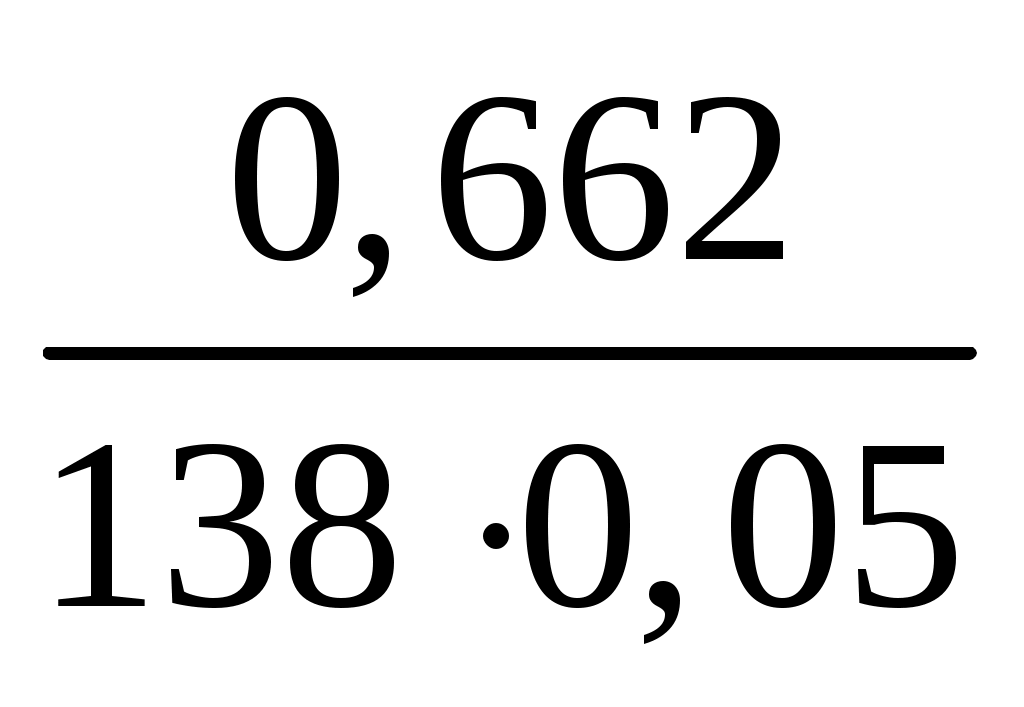 = = 0,096 (моль/л) = = 0,096 (моль/л)
t=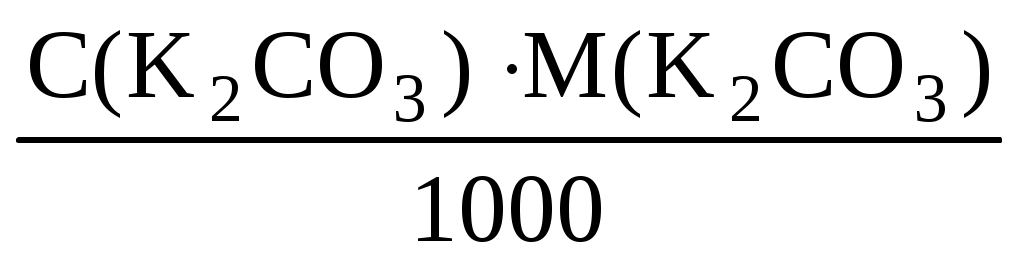 = =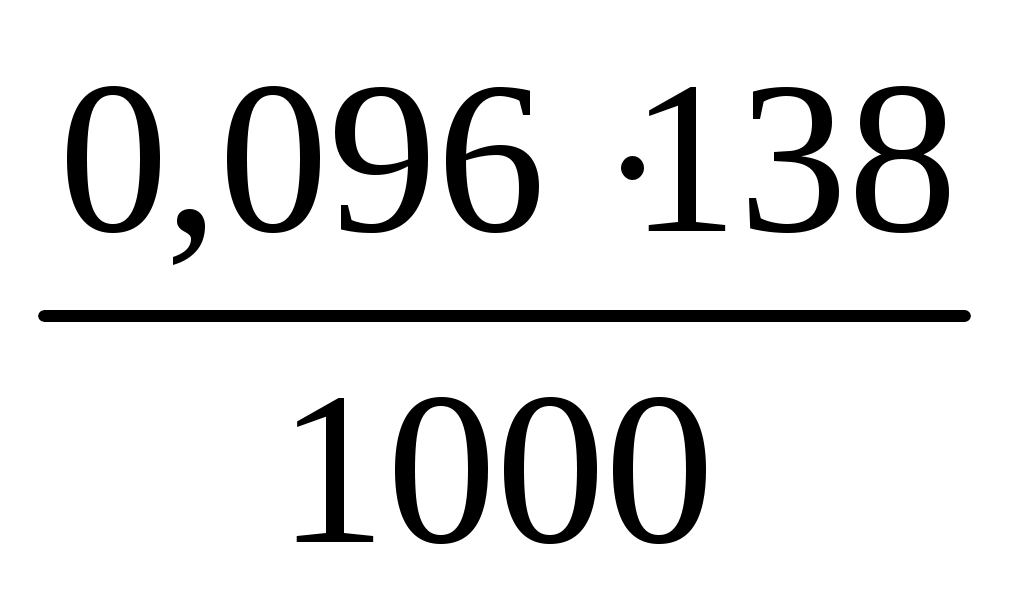 = =0,0132 (г/мл) = =0,0132 (г/мл)
W%=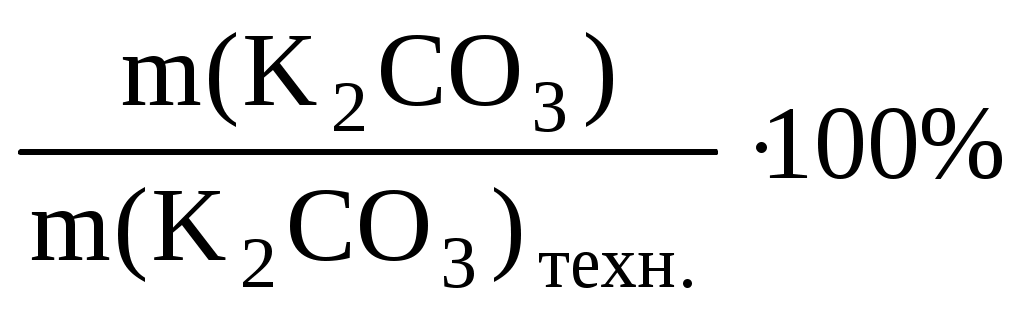 = =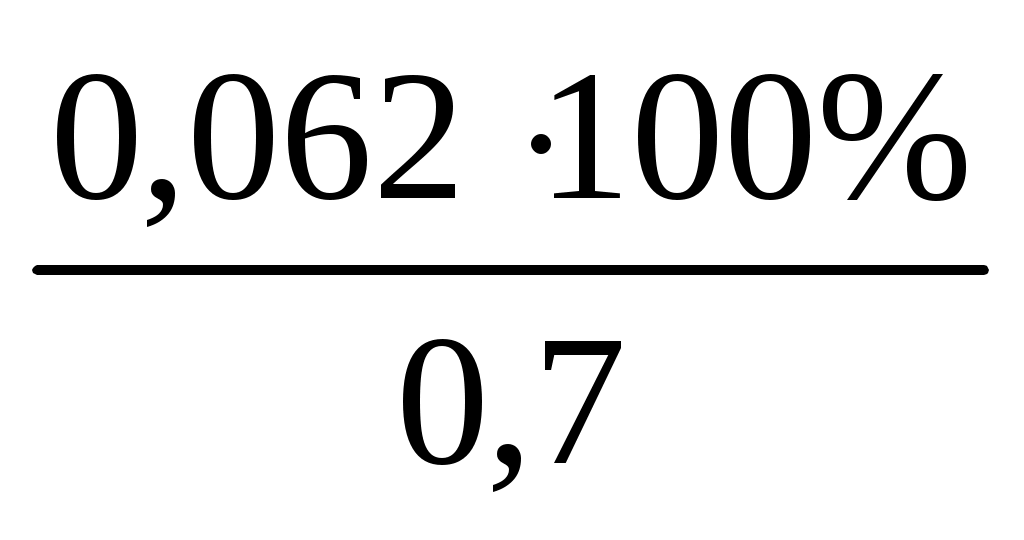 = =94,6 (%) = =94,6 (%)
Ответ: 0,662 г; 0,096 моль/л; 0,0132 г/мл и 94,6%.
| |
 Скачать 1.14 Mb.
Скачать 1.14 Mb.