Контрольные и лабораторные работы_Вариант 1. Учебнометодическое пособие для студентов 1 курса заочного отделения фармацевтического факультета
 Скачать 1.14 Mb. Скачать 1.14 Mb.
|
2. Строение вещества2.1. Электронные оболочки атомов. ПЗ и ПСЭПример 1. Исходя из положения элемента в ПСЭ дать характеристику атома фосфора. Показать его основное и ионизированное электронное состояние. Указать валентные электроны и семейство элементов. Ответ: Фосфор (P) находится в III периоде, V группе, главной подгруппе. Порядковый номер Z=15; массовое число А = 31. Порядковый номер соответствует положительному заряду ядра атома, т.е. числу протонов (p), а также числу электронов (ē). Число нейтронов (n) соответствует разности массового числа и порядкового номера. Запись: 15 электронов атома фосфора располагаются на трех энергетических уровнях (слоях), т.к. он находится в III периоде. Валентными электронами являются электроны внешнего незавершенного уровня. Их число соответствует номеру группы (для элементов главных подгрупп), в которой находится данный элемент. Запись: P0: 1s22s22p63s23p3, 3s23p3 – валентные электроны. Фосфор относится к семейству р-элементов, т.к. электронная конфигурация (формула) основного (электронейтрального) состояния показывает незавершенный р-подуровень внешнего энергетического уровня. Для атома фосфора возможно ионизированное состояние. Оно характеризуется приемом или отдачей электронов с внешнего энергетического уровня. Например: а) P0 – 3ē P+3 (в соединениях P2O3, H3PO3, Na3PO3) Запись: Р+3: 1s22s22p63s23p0 б) P0 – 5ē P+5 (в соединениях P2O5, H3PO4, К3PO4) Запись: Р+5: 1s22s22p63s03p0 в) P0 + 3ē P-3 (в соединении PH3). Запись: Р+5: 1s22s22p63s23p6 Пример 2. Строение внешнего энергетического уровня атома …4s24p3. Назовите элемент и укажите, к какому семейству он относится. Ответ: Исходя из строения внешнего энергетического уровня следует: элемент находится в IV периоде, 5 группе, главной подгруппе. Этот элемент – мышьяк (As). Также можно записать электронную конфигурацию атома элемента полностью (с учетом правила Клечковского): 1s22s22p63s23p64s23d104p3. Сумма всех электронов равна 33. Это соответствует порядковому номеру элемента, следовательно, элемент – 33As. Т.к. внешний незавершенный подуровень – р, то As относится к семейству р-элементов. Пример 3. Главное квантовое число n=2. Определите максимальное число электронов. Какие значения принимает побочное квантовое число? Как называются соответствующие им электроны? Ответ: Максимальное число электронов на энергетическом уровне определяется по формуле Хn = 2n2, следовательно, в данном случае: Хn = 222 = 8. Побочное квантовое число l изменяется от 0 до n-1, следовательно, в данном случае l = 0, 1. Так как значения l определяют подуровни, на которых располагаются электроны, то в этом случае: l=0 (s-электроны), l=1 (р-электроны). Пример 4. Исходя из положения элементов в ПСЭ, сравнить по свойствам а) Si и P; б) P и As. Ответ: а) Si и Р находятся в III периоде ПСЭ, в IV и V группах (главных подгруппах) соответственно. Их электронное строение: 14Si0: 1s22s22p63s23p2 15P0: 1s22s22p63s23p3 Оба элемента относятся к семейству р-элементов. Но у Si 4 валентных электрона, а у Р – 5 валентных электронов. До завершения энергетического уровня Р не хватает только 3-х электронов, а Si – 4-х, поэтому Р обладает в большей степени неметаллическими свойствами, он более электроотрицателен, а Si – металлическими свойствами. б) Р и As находятся в V группе ПСЭ, в III и IV периодах соответственно. Их электронное строение 15P0: 1s22s22p63s23p3 – 5 валентных электронов 33As0: 1s22s22p63s23p64s23d104p3 – 5 валентных электронов; Оба элемента относятся к семейству р-элементов. Но валентные электроны As располагаются дальше от ядра, чем у Р, т.к. у As радиус атома больше (с увеличением порядкового номера элемента в группах радиус атома возрастает). Поэтому отрыв электронов с IV уровня будет легче, чем с III-го, значит As обладает более металлическими свойствами, чем Р, который является типичным неметаллом. 2.2. Природа химической связи и строение химических соединенийПример 1. Пользуясь методом валентных связей, показать образование молекулы HCl. Указать тип связи; изобразить графически молекулу HCl. Ответ: В состав молекулы HCl входят атомы H и Cl, характеризующиеся различной ОЭО. При взаимодействии атомов неспаренные электроны образуют общую электронную пару, которая будет смещаться в сторону атома Cl, т.к. он более электроотрицателен. Связь – ковалентная, полярная. Ее образование можно представить следующим образом: 1H0: 1s1 17Cl0: 1s22s22p63s23p5
Т.к. при образовании молекулы образовалась одна электронная пара, то связь однократная (одинарная) и графически молекула выглядит так: H–Cl. При образовании связи происходит перекрывание электронных облаков атомов H и Cl. Это можно показать следующим образом: 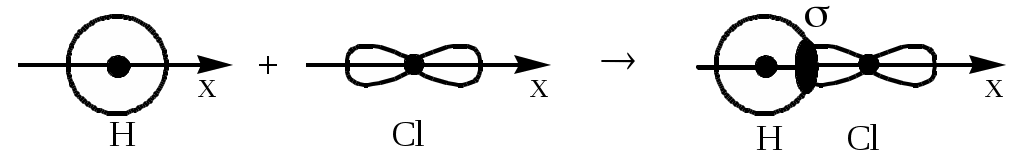 Связь, образующаяся между H и Cl, является -связью, т.к. она находится на линии, соединяющей ядра атомов. Пример 2. Показать возбужденное состояние атомов серы. Определить ее максимальную ковалентность. Ответ: Основное состояние атома серы: 16S0: 1s22s22p63s23p4 Заполнение электронами энергетических ячеек (орбиталей) для внешнего уровня выглядит так:
В 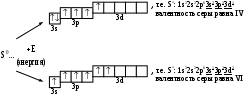 алентность S равна II, т.к. имеется 2 неспаренных электрона. Атом серы может перейти в возбужденное состояние за счет перехода электронов с 3s- и 3p-подуровней на свободные орбитали 3d-подуровня: Возбужденное состояние атома является причиной переменной валентности серы. Например: H2S, валентность = II (H–S–H) SO2, валентность = IV (O=S=O)
Максимальная ковалентность (т.е. способность образовывать ковалентные связи) для атома серы равна VI. Примечание: возбужденное состояние возможно только для тех атомов, у которых есть свободные орбитали, на которые могут переходить электроны. Расспаривание электронов возможно только в пределах данного уровня. Для большинства элементов максимальное число неспаренных электронов в основном или возбужденном состоянии равно номеру группы, в которой находится элемент. 2.3. Комплексные соединенияПример 1. Определить степень окисления (С.О.) и координационное число (К.Ч.) комплексообразователя в соединениях, написать диссоциацию и составить выражения для констант нестойкости (Кнест.) а) K4[Fe(CN)6], б) [Cu(NH3)4]SO4 Ответ: С.О. комплексообразователя определяется при подсчете зарядов всех компонентов (ионов и молекул), входящих в К.С. Следует помнить, что в целом молекула К.С. электронейтральна, т.к. заряд внешней сферы К.С. компенсируется зарядом внутренней сферы. К.Ч. определяется числом монодентатных лигандов, окружающих комплексообразователь (центральный ион) и входящих во внутреннюю сферу. Лигандами могут быть как заряженные ионы, так и нейтральные молекулы. Диссоциация К.С. протекает в 2 стадии, причем II стадия – распад комплексного иона – практически не идет, что доказывается малыми величинами Кнестойкости. Чем меньше Кнест. комплексного иона, тем более устойчив сам комплекс. а) Диссоциация: Iст K4[Fe(CN)6] 4K+ + [Fe(CN)6]4– IIст [Fe(CN)6]4– Fe2+ + 6CN– б) Диссоциация: Iст. [Cu(NH3)4]SO4 [Cu(NH3)4]2+ + SO42– IIст. [Cu(NH3)4]2+ Cu2+ + 4NH30 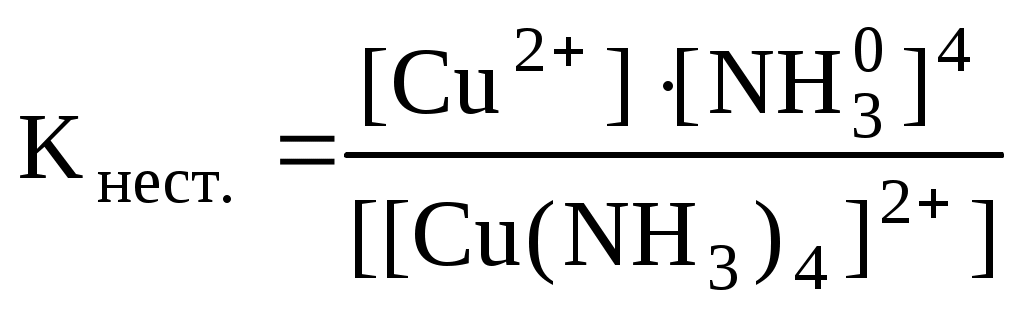 Пример 2. Дописать реакцию образования К.С. и назвать продукт. а) AgCl + NH3 к.ч. = 2 б) KCl + PtCl4 к.ч. = 6 Ответ: При написании продукта реакции следует помнить, что комплексообразующими свойствами обладают в первую очередь d-элементы (малоактивные металлы), затем p-элементы. Для s-элементов комплексообразование не характерно. В названиях К.С. следует использовать номенклатуры Штока или Эвенса-Бассета. а) Шт: Диаммин серебро (I) хлорид Э-Б: Диаммин серебро (1+) хлорид, где (I) – С.О. комплексообразователя Ag, а (1+) – заряд комплексного иона. б) Шт: Калий гексахлороплатинат (IV). Э-Б: Калий гексахлороплатинат (2–), где (IV) – С.О. комплексообразователя Pt, а (2–) – заряд комплексного иона. Пример 3. Допишите реакцию обмена между двумя солями Ответ: 3FeSO4 + 2K3[Fe(CN)6] Fe3[Fe(CN)6]2 + 3K2SO4 Fe3[Fe(CN)6]2 – комплекс анионного типа Шт: железо гексацианоферрат (III), Э-Б: железо гексацианоферрат (3–). Диссоциация: Iст. Fe3[Fe(CN)6]2 3Fe2+ + 2[Fe(CN)6]3– IIст. [Fe(CN)6]3– Fe3+ + 6CN– Пример 4. Определите величину и знак заряда комплексного иона: а) б) Ответ: а) б) Заряд комплексного иона определяется алгебраической суммой зарядов ионов-комплексообразователей и лигандов, а координационное число зависит от С.О. комплексообразователя и равно сумме лигандов. В данных примерах следует учесть, что молекула H2O электронейтральна, а оксалат-ион C2O42- - бидентатный лиганд. |

