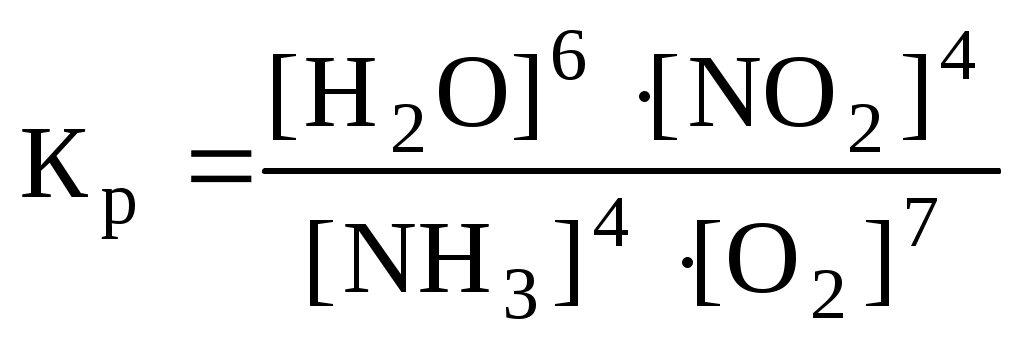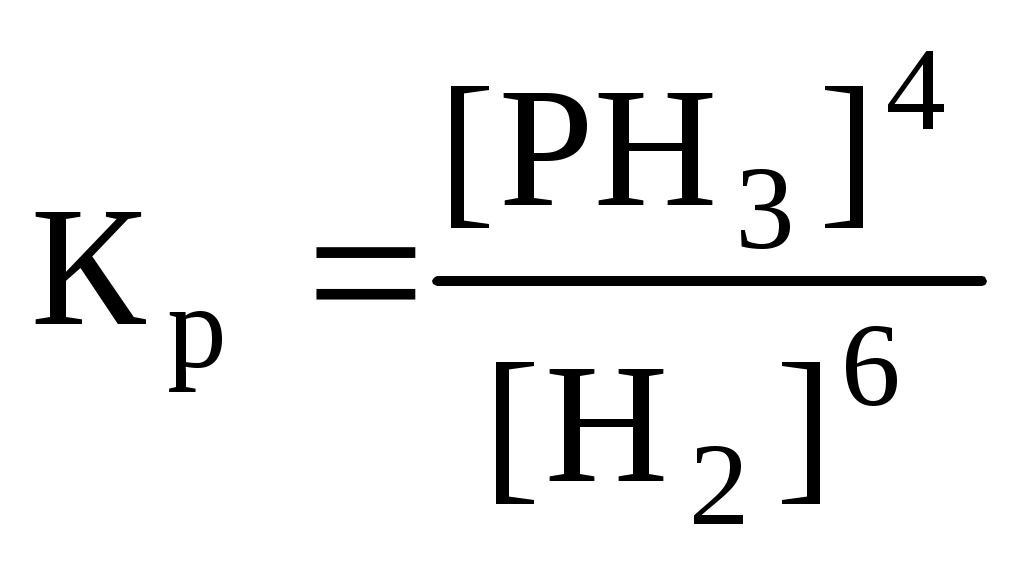Контрольные и лабораторные работы_Вариант 1. Учебнометодическое пособие для студентов 1 курса заочного отделения фармацевтического факультета
 Скачать 1.14 Mb. Скачать 1.14 Mb.
|
Контрольное задание № 1Имеется 56 литров NH3 (при н.у.). Сколько это составляет: а) моль, б) граммов, в) молекул, г) атомов? Вычислить молярную массу оксида азота, если плотность его паров по водороду равна 15. Вывести эмпирическую формулу оксида и изобразить ее графически. К раствору, содержащему 5 моль сульфида натрия, добавили раствор, содержащий 100 г хлорида железа (II). Определить массу полученного осадка и количество непрореагировавшего вещества. Периодический закон. В чем заключается отличие формулировки Д.И.Менделеева от современной? Примеры. Значение ПЗ и ПСЭ для химии. Исходя из положения в ПСЭ дать характеристику атома Al. Показать основное и ионизированное состояние, валентные электроны; указать семейство элементов. Провести сравнение по свойствам Al и Na, Al и Ga. Водородная связь. Ее виды. Примеры. Образование димеров. Показать возбужденное состояние и определить максимальную ковалентность для атома железа. Методы получения К.С. Примеры реакций. Определить С.О. и К.Ч. комплексообразователя в К.С., написать диссоциацию и выражение Кнест.: а) K3[Mn(S2O3)2Cl2], б) [Fe(SCN)2(CO)4]Cl Дописать реакции образования К.С. и назвать продукты: а) б) Основные положения теории ОВР. Уравнять реакции, указать окислитель и восстановитель: а) МЭБ б) МПР Методические указания и типовые примеры |