Контрольные и лабораторные работы_Вариант 1. Учебнометодическое пособие для студентов 1 курса заочного отделения фармацевтического факультета
 Скачать 1.14 Mb. Скачать 1.14 Mb.
|
Примеры выполнения контрольных заданий № 3 и № 4П 3 ример 1. Осуществите превращения согласно предложенной схеме:  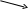 6 Ca3(PO4)2 Ответ: 2Ca + O2 2CaO CaO + H2O Ca(OH)2 3Ca(OH)2 + 2H3PO4 Ca3(PO4)2 + 6H2O 4P + 5O2 (изб) P2O5 + 3H2O 2H3PO4 2H3PO4 + 3Ca(OH)2 Ca3(PO4)2 + 6H2O Пример 2. Покажите взаимную связь между соединениями с помощью химических уравнений. а) Ответ: 2Cu + O2 2CuO CuO + 2HNO3 Cu(NO3)2 + H2O Cu(NO3)2 + 2KOH(недостаток) Cu(OH)2 + 2KNO3 Cu(OH)2 CuO + 2HCl CuCl2 + H2O CuCl2 + 4NaOH(недостаток) Na2CuO2 + 2NaCl + 2H2O б) Ответ: SO2 + 2KOH(изб) K2SO3 + H2O SO2(изб.) + K2SO3 + H2O 2KHSO3 2KHSO3 5K2SO3 + 2KMnO4 + 3H2SO4 6K2SO4 + 2MnSO4 + 3H2O в) Ответ: 2Pb(NO3)2 2NO2 N2O4 2N2O4 + O2 + 2H2O 4HNO3 10HNO3(разб.) + 8K 8KNO3 + NH4NO3 + 3H2O NH4NO3 + KOH Примечание: ОВР уравняйте одним из методов – МЭБ или МПР. Пример 3. К растворам каждого из веществ Zn(NO3)2, NaOH, H2CO3, Be(OH)2 добавили избыток калий гидроксида. Напишите молекулярные и ионные уравнения возможных реакций. Ответ: Zn(NO3)2 + 4KOH (изб.) 2KNO3 + K2ZnO2 + 2H2O Zn2+ + 2NO3– + 4K+ + 4OH– 2K+ + 2NO3– + 2K+ + ZnO22– + 2H2O Zn2+ + 4OH– ZnO22– + 2H2O NaOH + KOH H2CO3 + 2KOH K2CO3 + 2H2O H2CO3 + 2K+ + 2OH– 2K+ + CO32– +2H2O H2CO3 + 2OH– CO32– +2H2O Be(OH)2 + 2KOH (изб.) Be(OH)2 + 2K+ + 2OH– 2K+ + BeO22– +2H2O Be(OH)2 + 2OH– BeO22– +2H2O или Be(OH)2 + 2KOH (изб.) Be(OH)2 + 2K+ + 2OH– 2K+ + [Be(OH)4]2– Be(OH)2 + 2OH– [Be(OH)4]2– Пример 4. Подберите по 2 молекулярных уравнения для реакций, которые выражаются следующими ионно-молекулярными уравнениями: а) Ba2+ + CO32– BaCO3 б) Ca2+ + SiO32– CaSiO3 Ответ: а) Ba(OH)2 + Na2CO3 BaCO3 + 2NaOH Ba2+ + 2OH– + 2Na+ + CO32– BaCO3 + 2Na+ + 2OH– Ba2+ + CO32– BaCO3 Ba(NO3)2 + K2CO3 BaCO3 + 2KNO3 Ba2+ + 2NO3– + 2K+ + CO32– BaCO3 + 2K+ + 2NO3– Ba2+ + CO32– BaCO3 б) Ca(OH)2 + Na2SiO3 CaSiO3 + 2NaOH Ca2+ + 2OH– + 2Na+ + SiO32– CaSiO3 + 2Na+ + 2OH– Ca2+ + SiO32– CaSiO3 CaCl2 + K2SiO3 CaSiO3 + 2KCl Ca2+ + 2Cl– + 2K+ + SiO32– CaSiO3 + 2K+ + 2Cl– Ca2+ + SiO32– CaSiO3 Пример 5. Смесь CaO и CaSO3 массой 80 г обработали раствором соляной кислоты. При этом выделилось 7,84 л газа (н.у.). Определите массовую долю в % CaO в смеси. Решение: Оба компонента смеси взаимодействуют с кислотой: CaO + 2HCl CaCl2 + H2O CaSO3 + 2HCl CaCl2 + SO2 + H2O но т.к. газ (SO2) выделяется во второй реакции, то можно составить пропорцию Тогда Ответ: массовая доля CaO в смеси составляет 47,5%. Пример 6. Через раствор, содержащий 10 г NaOH попустили H2S массой 20г. Какая соль образовалась при этом? Определите ее массу. Решение: При взаимодействии NaOH с H2S возможны две реакции: NaOH + H2S NaHS + H2O 2NaOH + H2S Na2S + 2H2O Для выбора идущей реакции необходимо выяснить количества реагирующих веществ NaOH и H2S и определить, какое из них находится в недостатке. Из сравнения n(NaOH) и n(H2S) следует, что NaOH находится в недостатке, поэтому пойдет первая реакция, для которой нужно меньше вещества NaOH. I способ: Для нахождения массы соли NaHS составим пропорцию: II способ: Исходя из того, что по уравнению реакции 1 n(NaOH) = n(NaHS), можно вычислить m(NaHS) по формуле: Ответ: образуется кислая соль NaHS, ее масса равна 14 г. Пример 7. Какая соль образуется при пропускании всего углерод (IV) оксида, получившегося при сжигании метана объемом 2,24 л. (н.у.) через раствор объемом 19,1 мл с массовой долей натрий гидроксида 32% (ρ=1,35 г/мл)? Определите массовую долю (в %) соли в полученном растворе. Решение: Уравнение реакции горения метана: CH4 + 2O2 CO2 + 2H2O (1) При пропускании углекислого газа через раствор щелочи можно предположить образование средней соли: CO2 + 2NaOH Na2CO3 + H2O (2) Расчет количества вещества реагентов: Из уравнения (1) следует, что n(CH4) = n(CO2) = 0,1 моль. Для нахождения n(NaOH) необходимо рассчитать массы раствора и вещества NaOH. Из уравнения (2) следует, что n(CO2):n(NaOH) = 1:2. Рассчитанные количества CO2 и NaOH находятся в эквивалентных количествах, т.е. 1:2, поэтому образуется средняя соль Na2CO3. Количество Na2CO3 равно n(Na2CO3) = n(CO2) = 0,1 моль, тогда: В результате пропускания углекислого газа через раствор щелочи масса раствора увеличилась на массу CO2: Массовая доля Na2CO3 равна: Ответ: образуется средняя соль Na2CO3, ее массовая доля равна 35,1%. Пример 8. Rp.: Ag. Plumbi 50,0 Acidi borici 2,0 Ag. Destill. аd. 100,0 M.D.S. Примочка. Рассчитать массовую долю борной кислоты в примочке. Решение: В данном рецепте в 100 г раствора содержится 2 г H3BO3, следовательно, ее массовая доля составляет 0,02 или 2%. Ответ: массовая доля 2%. |
