Контрольные и лабораторные работы_Вариант 1. Учебнометодическое пособие для студентов 1 курса заочного отделения фармацевтического факультета
 Скачать 1.14 Mb. Скачать 1.14 Mb.
|
Задачи на рН, ионное произведение водыПример 1. Рассчитать рН и рОН раствора соляной кислоты с концентрацией 110–4 моль/л. Могут ли значения рН и рОН быть равными нулю; меньше нуля? Решение: так как HCl – сильный электролит, диссоциацию соляной кислоты можно считать полной и [H+]=10–4 моль/л. Тогда рН=-lg10-4=4, а рОН=14-рН=14-4=10. рН и рОН могут быть равными нулю при [H+]=1 или [ОH–]=1 (моль/л), т.к. –lg1=0. рН и рОН могут быть меньше нуля при [H+] и [ОH–] больше 1, например, –lg10=-1 или –lg100=-2. Пример 2. Рассчитать рН и рОН раствора КОН с молярной концентрацией 0,001 моль/л.
Пример 3. Для раствора H2SO4 с молярной концентрацией 0,05 моль/л найти
Пример 4. рН раствора равен 4. Найти концентрации Н+, ОН– и рОН. Решение: Из выражений находим [H+]=10-4 (моль/л); рОН=14-рН=14-4=10; [ОH–]=10-10 (моль/л). Ответ: Амфотерные гидроксидыТак как амфотерные гидроксиды проявляют свойства как кислот, так и оснований, то кроме уравнений их диссоциации по ступеням, нужно уметь записывать и двойную диссоциацию, например, к-та H2ZnO2 к-та H3CrO3 (орто) или HCrO2 (мета) Растворение амфотерных гидроксидов в кислотах и щелочах следует записывать в молекулярном и ионном виде. Амфотерный гидроксид как слабый электролит на ионы не расписывается. Пример 1. а) 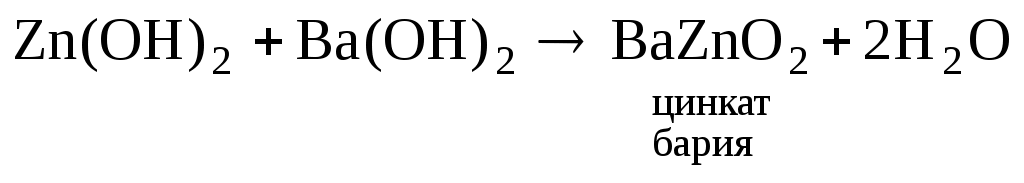 б) Пример 2. 2Cr(OH)3 + 3H2SO4 Cr2(SO4)3 + 6H2O 2Cr(OH)3 + 6H+ + 3SO42- 2Cr3+ + 3SO42- + 6H2O Cr(OH)3 + 3H+ Cr3+ + 3H2O а) Cr(OH)3 + 3KOH Cr(OH)3 + 3OH– CrO33– +3H2O б) Cr(OH)3 + KOH Cr(OH)3 + OH– CrO2– +2H2O в) Cr(OH)3 + 3KOH K3[Cr(OH)6] к.ч.=6 гидроксокомплекс Cr(OH)3 + 3OH– [Cr(OH)6]3– |
