Билет № Х
1. Магнитное и спиновые квантовые числа.
2. Написать электронные формулы; выделить валентные орбитали: F0, Fe+6
3. Уравнять методом полуреакций:
Cu + HNO3 конц. = Cu(NO3 )2 + NO2 + H2O
4. Получить комплекс, уравнять, назвать:
MnCl3 + KCl (к.ч. = 6)
5.Написать реакции в молекулярной и ионной форме (гидролиз по ступеням):
а) K3PO4 + H2O 
б) Cr2O3 + NaOH =
Молярная концентрация р-ра Н3РО4 равна 0,2 моль/л, плотность раствора = 1,1 г/мл. Рассчитать массовую долю, титр и моляр. конц. эквивалента.
7. Изобразить графическую формулу и назвать по двум номенклатурам:
Fe2(SO4)3, KHSiO3, Al(OH)2NO3
Приложение 1
Ряд активности металлов (электрохимический ряд напряжений)
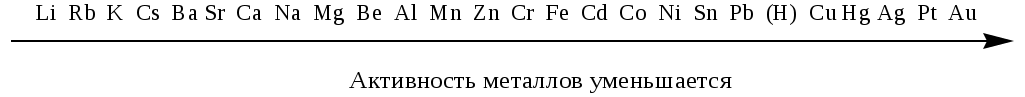
Приложение 2
Стандартные окислительно-восстановительные потенциалы
Электродный процесс
|
Е0, В
|
Электродный процесс
|
Е0, В
|
Li+ + e Li0
|
-3,04
|
NO3 - + e (H+) NO2
|
0,80
|
K+ + e K0
|
-2,92
|
Hg22+ + 2e 2Hg0
|
0,79
|
Ca2++ 2e Ca0
|
-2,87
|
Ag+ + e Ag0
|
0,80
|
Na+ + e Na0
|
-2,71
|
NO3 - + 2e (H+) NO2-
|
0,81
|
Mg2+ + 2e Mg0
|
-2,36
|
Hg2+ + 2e Hg0
|
0,85
|
Al3+ + 3e Al0
|
-1,66
|
NO3 - + 3e (H+) NO
|
0,96
|
Mn2+ + 2e Mn0
|
-1,18
|
NO2 - + e (H+) NO
|
1,0
|
Zn2+ + 2e Zn0
|
-0,76
|
Br2 + 2e 2Br -
|
1,06
|
Fe2+ + 2e Fe0
|
-0,44
|
IO3- + 6e (H+) I-
|
1,08
|
Pb2+ + 2e Pb0
|
-0,13
|
Pt2+ + 2e Pt 0
|
1,20
|
Fe3+ + 3e Fe0
|
-0,04
|
O2 + 4e (H+) 2H2O
|
1,23
|
2H+ + 2e H2
|
0
|
Cr2O7 2- + 6e (H+) 2Cr3+
|
1,33
|
S4O62- + 2e 2S2O32-
|
0,09
|
Cl2 + 2e 2Cl-
|
1,36
|
Sn4+ + 2e Sn2+
|
0,15
|
PbO2 + 2e (H+) Pb2+
|
1,45
|
2IO3 - + 10e (H+) I2
|
0,21
|
BrO3 - + 6e (H+) Br -
|
1,45
|
SO42- + 2e (H+) SO32-
|
0,22
|
2ClO3 - + 10e (H+) Cl2
|
1,47
|
Cu2+ + 2e Cu0
|
0,34
|
MnO4 - + 5e (H+) Mn2+
|
1,51
|
I2+ + 2e 2I-
|
0,54
|
H2O2 + 2e (H+) H2O
|
1,78
|
MnO4- + e (OH-) MnO42-
|
0,54
|
BiO3 - + 2e (H+) Bi3+
|
1,8
|
MnO4- + 3e (H2O-) MnO2
|
0,60
|
S2O82- + 2e 2SO42-
|
2,01
|
ClO3 - + 6e (H+) Cl-
|
0,63
|
F2 + 2e 2F
|
2,87
|
Fe3+ + e Fe2+
|
0,77
|
|
|
|
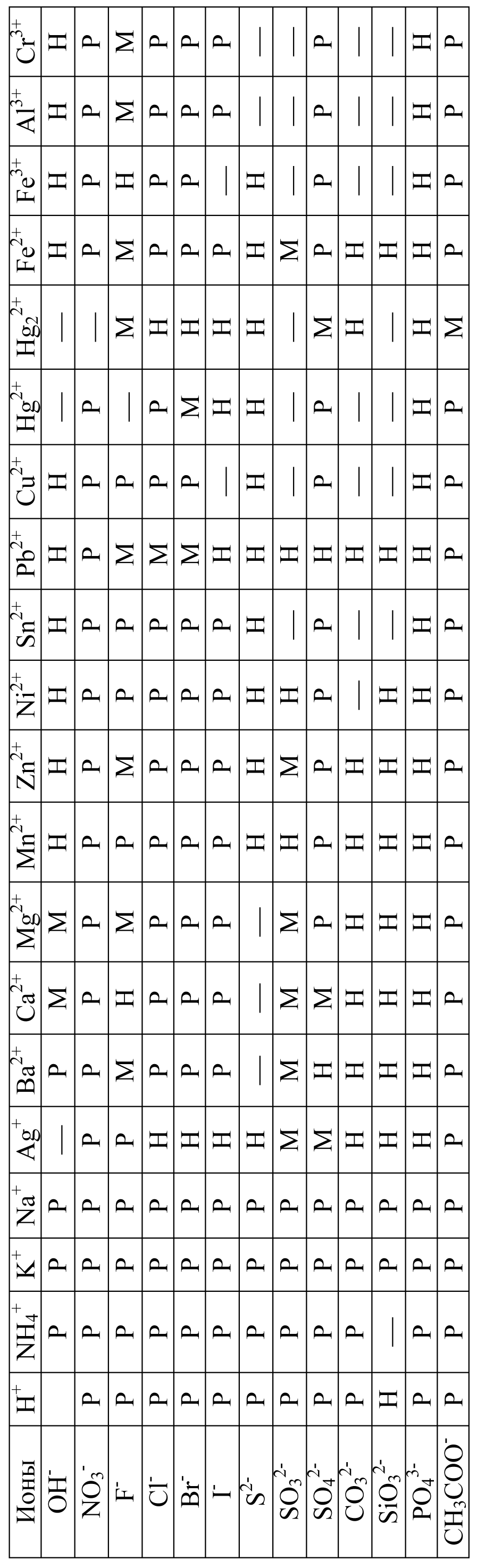
Приложение 3
|
|
|
Приложение 4
Произведения растворимости некоторых
труднорастворимых электролитов (25С)
Электролит
| ПР | Электролит | ПР |
AgBr
|
7,010-13
|
Ca3(PO4)2
|
1,010-29
|
Ag2CO3
|
6,210-12
|
CuCO3
|
1,410-10
|
AgCl
|
1,610-10
|
Cu(OH)2
|
5,610-20
|
Ag2CrO4
|
2,010-12
|
CuS
|
8,510-45
|
Ag2Cr2O7
|
2,010-7
|
Fe(OH)2
|
3,210-14
|
AgI
|
1,010-16
|
Fe(OH)3
|
4,010-38
|
(AgOH)
|
2,210-8
|
FeS
|
3,710-19
|
Ag3PO4
|
1,810-18
|
Hg2Cl2
|
2,010-18
|
Ag2S
|
1,010-49
|
HgS
|
4,010-53
|
AgCNS
|
1,010-12
|
MgCO3
|
2,610-5
|
Ag2SO4
|
8,010-5
|
Mg(OH)2
|
1,210-11
|
AgCN
|
1,410-16
|
MnS
|
1,410-15
|
As2S3
|
4,010-29
|
PbBr2
|
7,410-6
|
BaCO3
|
7,010-9
|
PbCl2
|
2,010-5
|
BaCrO4
|
2,010-10
|
PbCrO4
|
1,810-14
|
Ba(OH)2
|
1,910-2
|
PbI2
|
1,310-8
|
BaSO4
|
1,010-10
|
PbS
|
1,110-29
|
CaCO3
|
1,010-8
|
PbSO4
|
2,010-8
|
CaCrO4
|
2,310-10
|
SrCO3
|
1,610-9
|
CaF2
|
4,010-11
|
SrSO4
|
3,810-7
|
Ca(OH)2
|
5,510-6
|
SrCrO4
|
3,610-5
|
CdS
|
7,010-27
|
Zn(OH)2
|
5,010-17
|
CaSO4
|
6,110-5
|
ZnS
|
7,010-26
|
П рограмма, методические указания и контрольные задания рограмма, методические указания и контрольные задания
по общей и неорганической химии.
Вариант № 1
Учебно-методическое пособие для студентов заочного отделения
фармацевтического факультета. Под ред. профессора М.С.Юсубова.
Авторский коллектив
Белоусова Н.И. – доцент кафедры химии СибГМУ
Шевцова Т.А. – старший преподаватель кафедры химии СибГМУ
Цыбукова Т.Н. – доцент кафедры химии СибГМУ
Москальчук А.Н. – ассистент кафедры химии СибГМУ
Отпечатано в лаборатории оперативной полиграфии СибГМУ
Заказ № Тираж экз.
  |
 Скачать 1.14 Mb.
Скачать 1.14 Mb. рограмма, методические указания и контрольные задания
рограмма, методические указания и контрольные задания 


