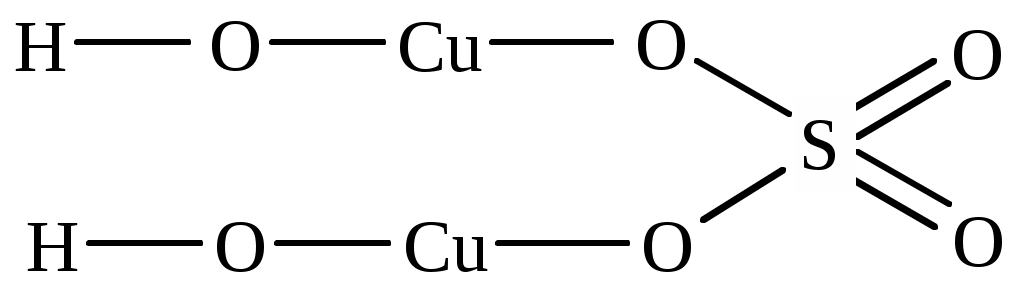Контрольные и лабораторные работы_Вариант 1. Учебнометодическое пособие для студентов 1 курса заочного отделения фармацевтического факультета
 Скачать 1.14 Mb. Скачать 1.14 Mb.
|
Методические указания и типовые примеры | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
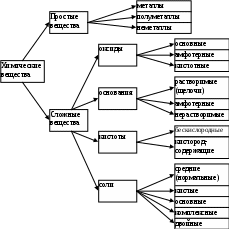
| металл основной оксид основание | соль |
| неметалл кислотный оксид кислота |
Знание химических свойств простых веществ и их соединений позволяет осуществлять превращения между ними.
Номенклатура неорганических соединений. Графические формулы
По единым номенклатурным правилам, разработанным в комиссиях Международного союза теоретической и прикладной химии (ИЮПАК) в 1979 г., рекомендуется называть неорганические соединения слева направо в именительном падеже, хотя в традициях русской номенклатуры принято называть сначала электроотрицательную составляющую соединения (анион), а затем – электроположительную (катион) в родительском падеже.
Стехиометрические отношения элементов в соединениях можно выражать тремя способами:
С помощью приставок из греческих числительных.
Для обозначения числа атомов одинаковых элементов в молекулах простых и сложных веществ употребляют приставки из греческих числительных:
| 1 – моно (обычно не называют) 2 – ди 3 – три 4 – тетра | 5 – пента 6 – гекса 7 – гепта 8 – окта | 9 – нона 10 – дека 11 – ундека 12 – додека |
Для обозначения количества сложных групп атомов (кислотные остатки кислородсодержащих кислот) употребляют латинское «бис», греческие «трис», «тетракис», а группу атомов, к которой они относятся, заключают в круглые скобки.
Примеры: Н2 – диводород, О3 – трикислород, Р2О5 – дифосфор пентаоксид, FeCl2 – железо дихлорид, Ca(NO3)2 – кальций бис(нитрат), Fe2(CO3)3 – дижелезо трис(карбонат).
По системе Штока
После названия элемента в круглых скобках римской цифрой указывают его степень окисления.
Примеры: FeCl3 – железо (III) хлорид, Mn2O7 – марганец (VII) оксид.
По системе Эвенса-Бассета.
После названия иона в круглых скобках пишут его заряд арабской цифрой и знак заряда.
Примеры: Cu(NO3)2 – медь (2+) нитрат, FeCl3 – железо (3+) хлорид.
Систему Эвенса-Бассета используют чаще всего в названиях комплексных соединений.
Графические формулы
При написании графических (структурных) формул соединений необходимо соблюдать 2 правила:
Каждая связующая электронная пара (связь) между атомами обозначается черточкой (штрихом). Число черточек соответствует степени окисления элемента, взятой по абсолютной величине.
«Электроположительные» атомы могут соединяться только с «электроотрицательными» (имеющими отрицательную степень окисления).
Оксиды
| Формулы | Названия по номенклатуре с приставками и по Штоку | Графические формулы |
| MnO2 | марганец диоксид марганец (IV) оксид | O=Mn=O |
| N2O3 | диазот триоксид азот (III) оксид | O=N–O–N=O |
| N2O5 | диазот пентаоксид азот (V) оксид | 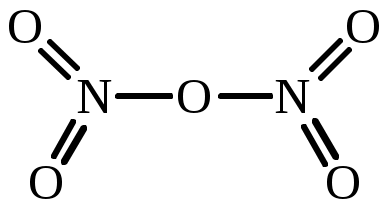 |
Основания
| Формулы | Названия по номенклатуре с приставками и по Штоку | Графические формулы |
| Mg(OH)2 | магний дигидроксид магний (II) гидроксид | 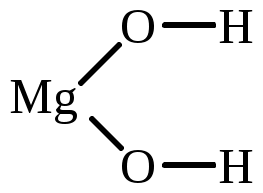 |
| Al(OH)3 | алюминий тригидроксид алюминий (III) гидроксид | 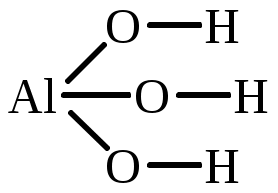 |
Кислоты
Основные правила названий кислот и их анионов приведены в теоретическом разделе, посвященном классам неорганических соединений. Ниже приведены названия некоторых, не вошедших в список ранее названных, кислот и их анионов, а также графические формулы наиболее распространенных кислот
| Формула кислоты | Название кислоты | Название аниона кислоты |
| HBr | бромоводородная | бромид |
| HI | йодоводородная | йодид |
| HCH3COO | уксусная | ацетат |
| H2C2O4 | щавелевая | оксалат |
| H2C4H4O6 | винная | тартрат |
| H3BO4 | ортоборная | солей нет |
| (HBO2)2 | метаборная (кислоты не существует, только соль) | метаборат |
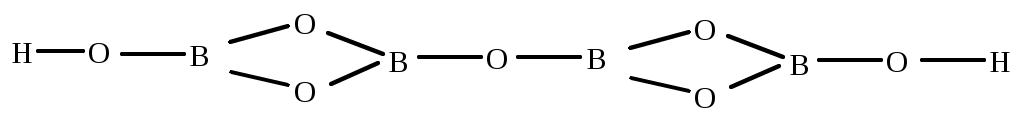
| H2B4O7 | тетраборная (кислоты не существует, только соль) | тетраборат |
| H3PO3 | фосфористая | фосфит |
| H3AsO4 | (орто) мышьяковая | (орто) арсенат |
| H3AsO3 | (орто) мышьяковистая | (орто) арсенит |
| H3SbO4 | (орто) сурьмяная | (орто) антимонат |
| HSbO3 | метасурьмяная | метаантимонат |
| H3SbO3 | (орто) сурьмянистая | (орто) антимонит |
| HSbO2 | метасурьмянистая | метаантимонит |
| H2MnO4 | марганцовая | манганат |
угольная серная сернистая азотная
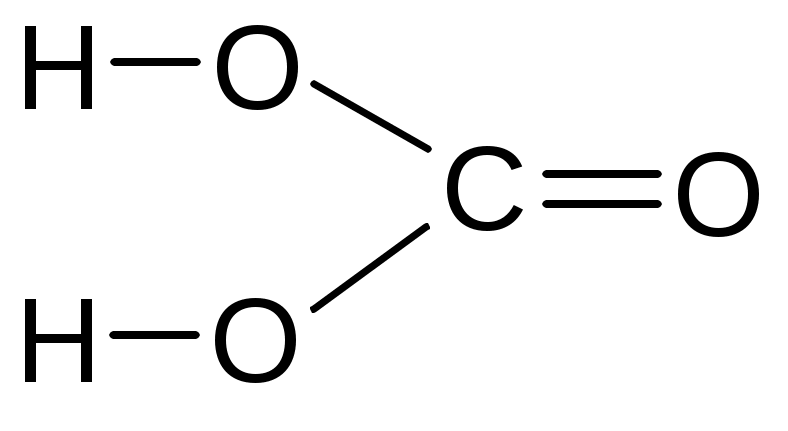
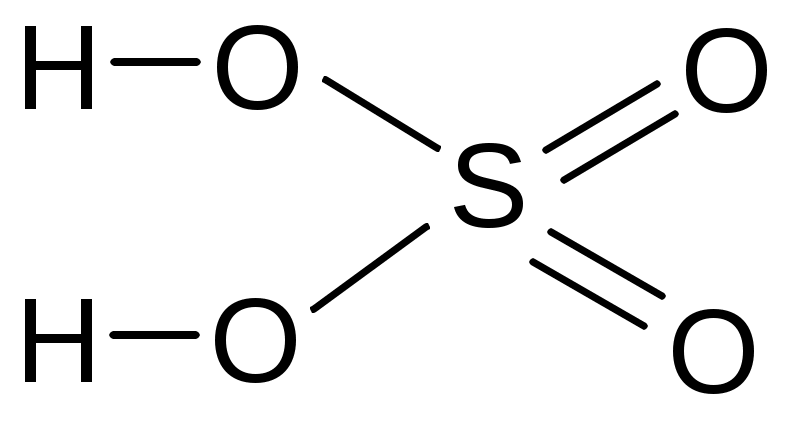
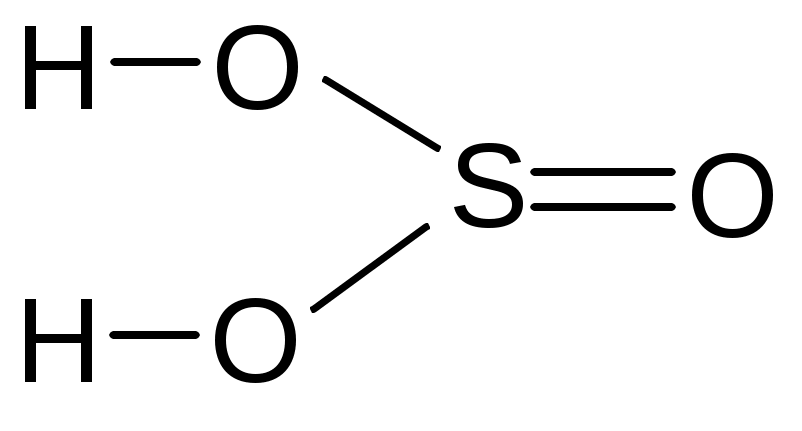
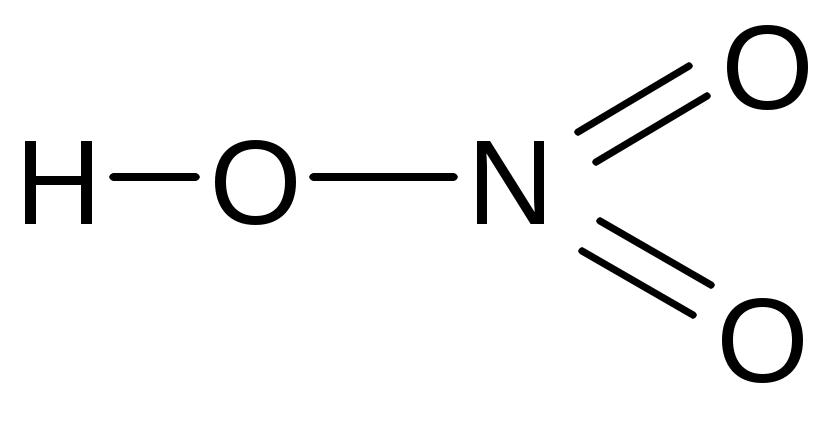
фосфорная хромовая дихромовая пирофосфорная

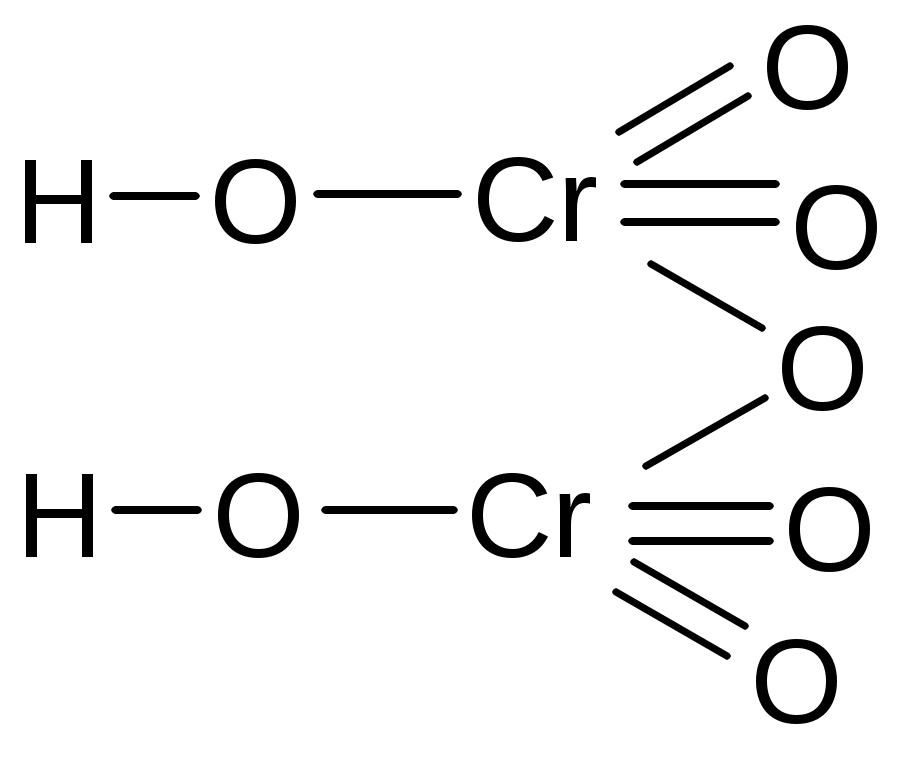
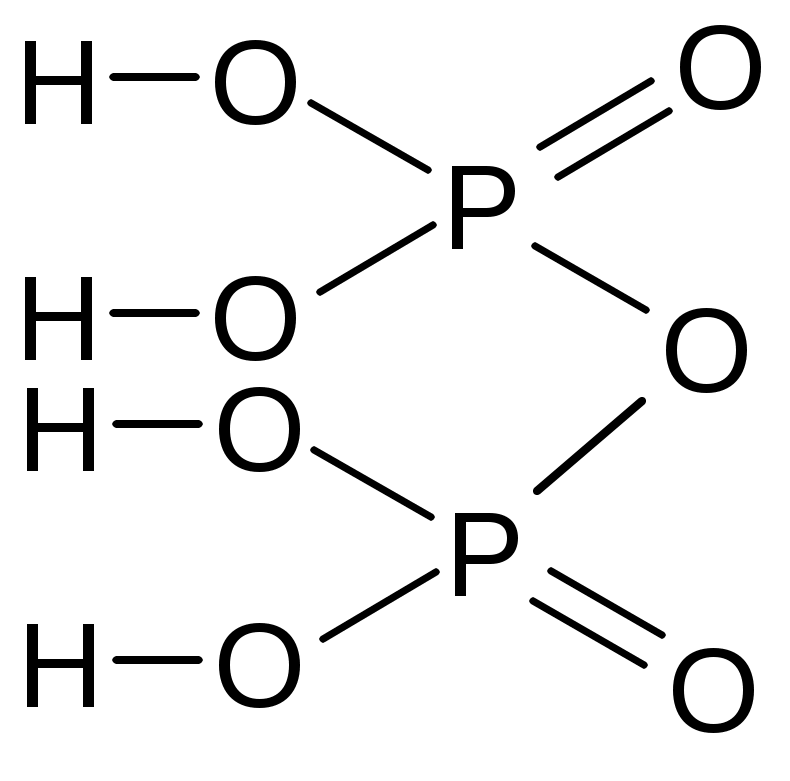
тетраборная
перхлорная пермарганцовая метесурьмяная
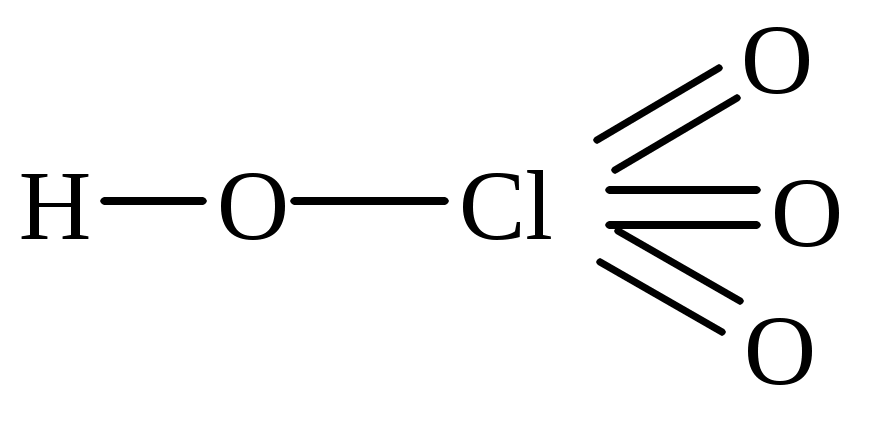
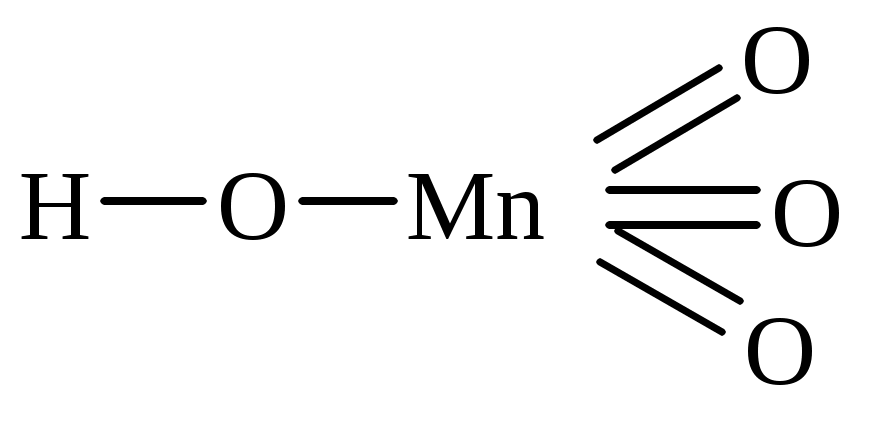
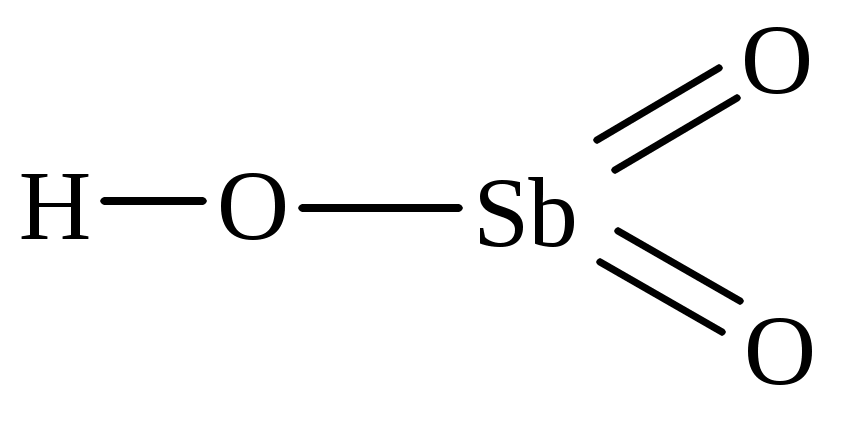
Соли
Сначала называется электроположительная составляющая солей (катион) в именительном падеже, а затем – электроотрицательная (анион).
Средние соли
Примеры (номенклатура с приставками из греческих числительных и по системе Штока):
| Fe2S3 | дижелезо трисульфид, железо (III) сульфид | |
| Ca3(PO4)2 | трикальций бис(фосфат), кальция (II) фосфат | 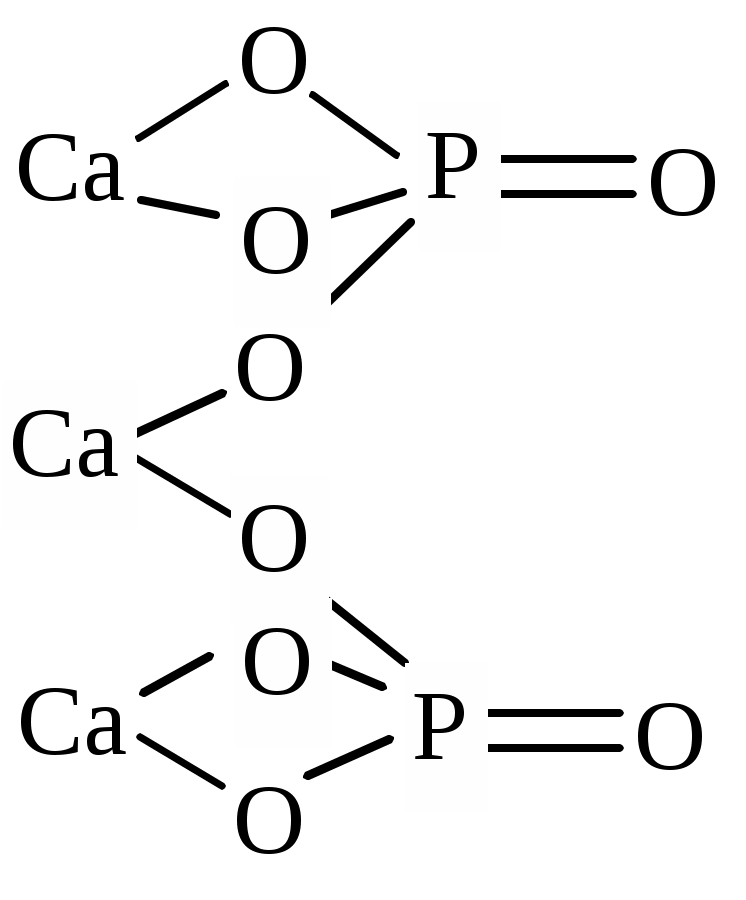 |
| Al2(CO3)3 | диалюминий трис(карбонат), алюминий (III) карбонат | 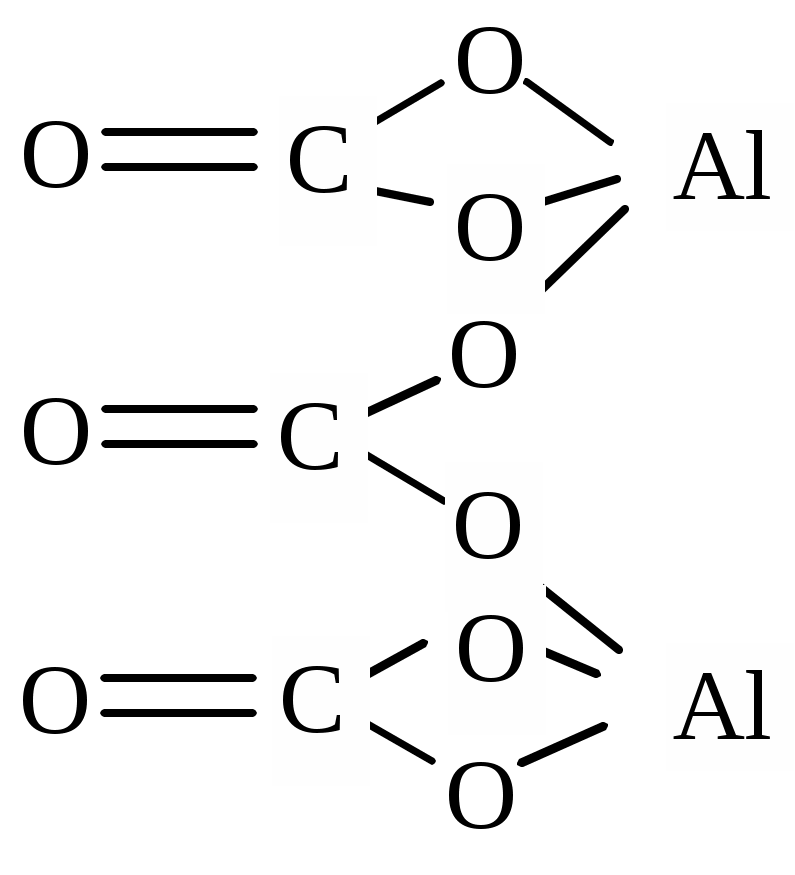 |
Кислые соли
В названии солей, содержащих не полностью замещенный в кислоте водород, перед названием кислотного остатка без пробела называется слово «водород» с указанием, в случае необходимости, числа его атомов.
Примеры:
| Формулы | Номенклатуры | |
| с приставками из греч. числительных | по системе Штока | |
| Ca(HSiO3)2 | кальций бис (водородсиликат) | кальций (II) водородсиликат |
| Mg(H2PO4)2 | магний бис (диводородфосфат) | магний (II) диводородфосфат |
| Fe2(HPO4)3 | дижелезо трис (водородфосфат) | железо (III) водородфосфат |
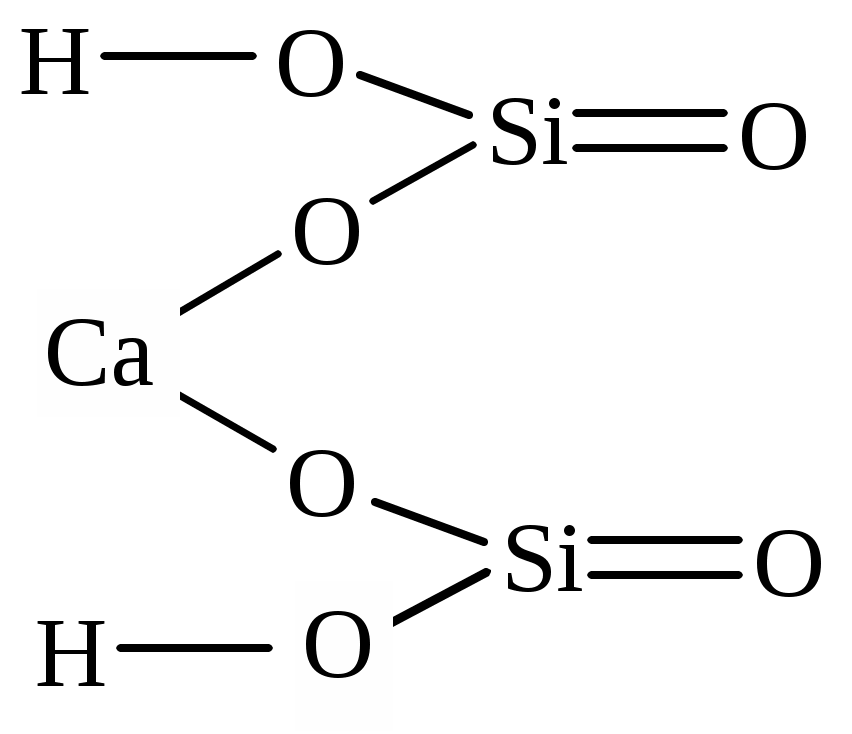
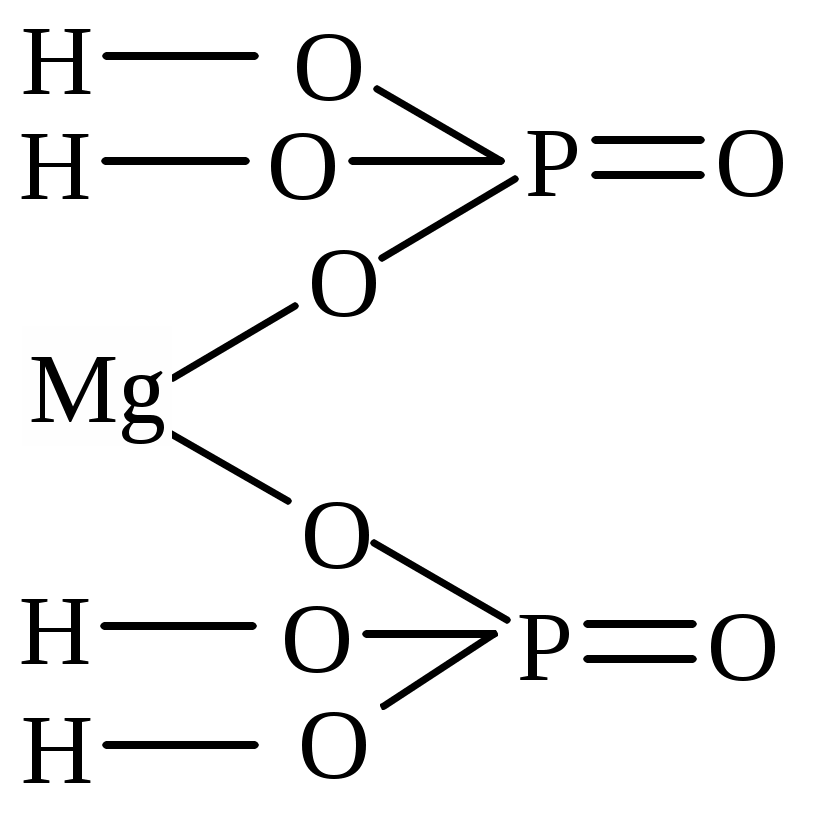
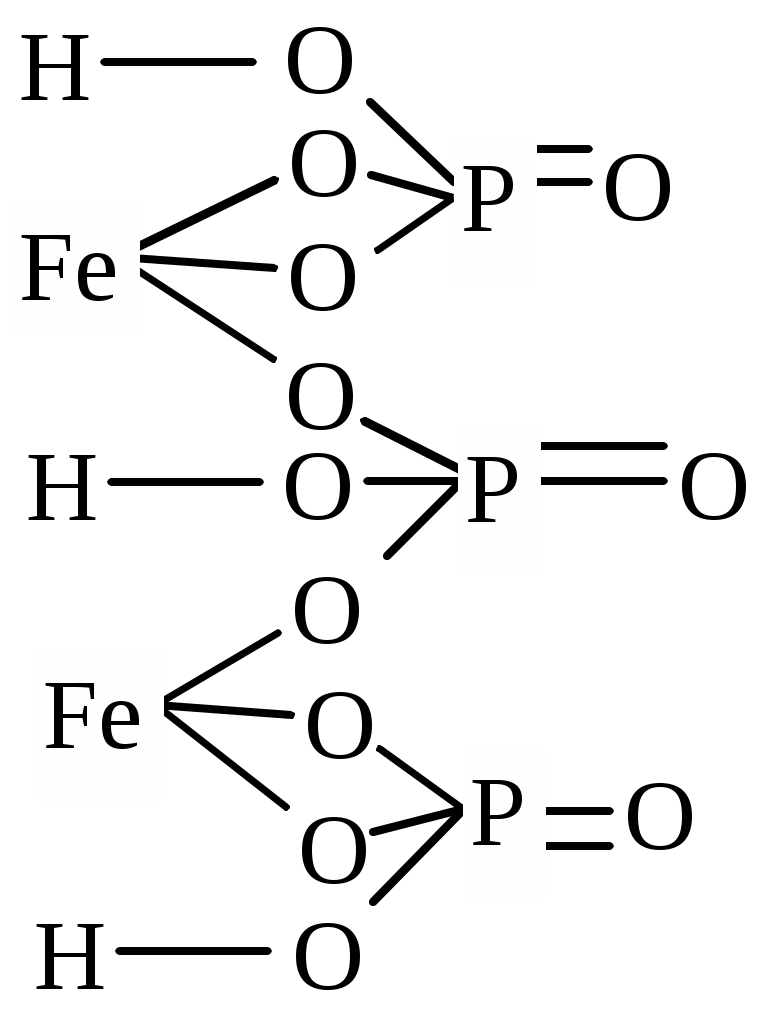
Основные и оксидные соли
В названиях солей, содержащих одну или несколько групп ОН, после названия металла употребляется слово «гидроксид» с указанием числа гидроксидных групп, принадлежащих одному атому металла, а затем следует название аниона.
Примеры:
| Формула | Номенклатуры | |
| с приставками из греч. числительных | по системе Штока | |
| (CuOH)2SO4 | бис(медь гидроксид) сульфат | медь (II) гидроксид сульфат |
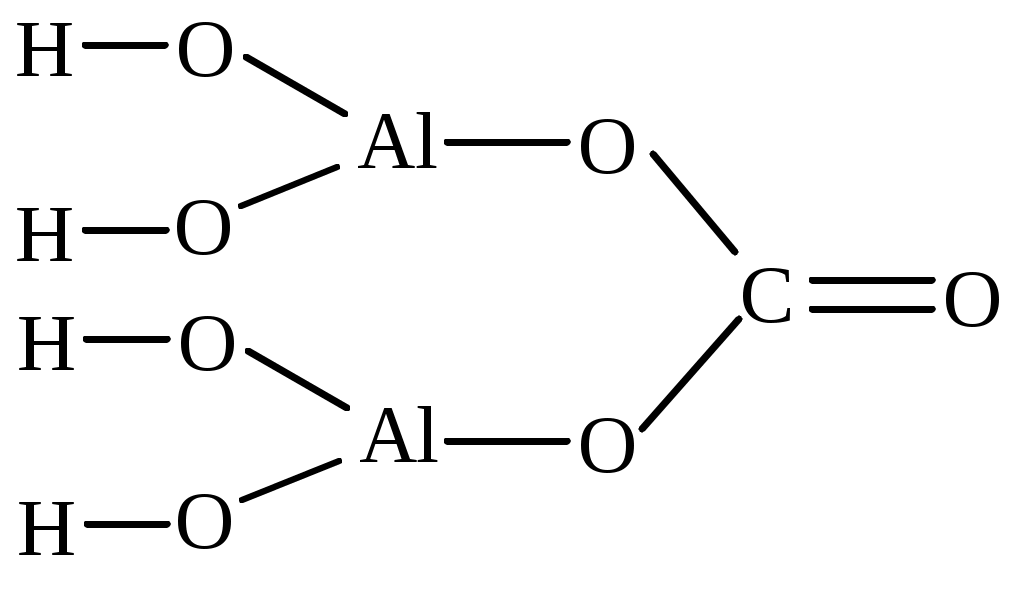
| [Al(OH)2]2CO3 | бис(алюминий дигидроксид) карбонат | алюминий (III) дигидроксид карбонат |
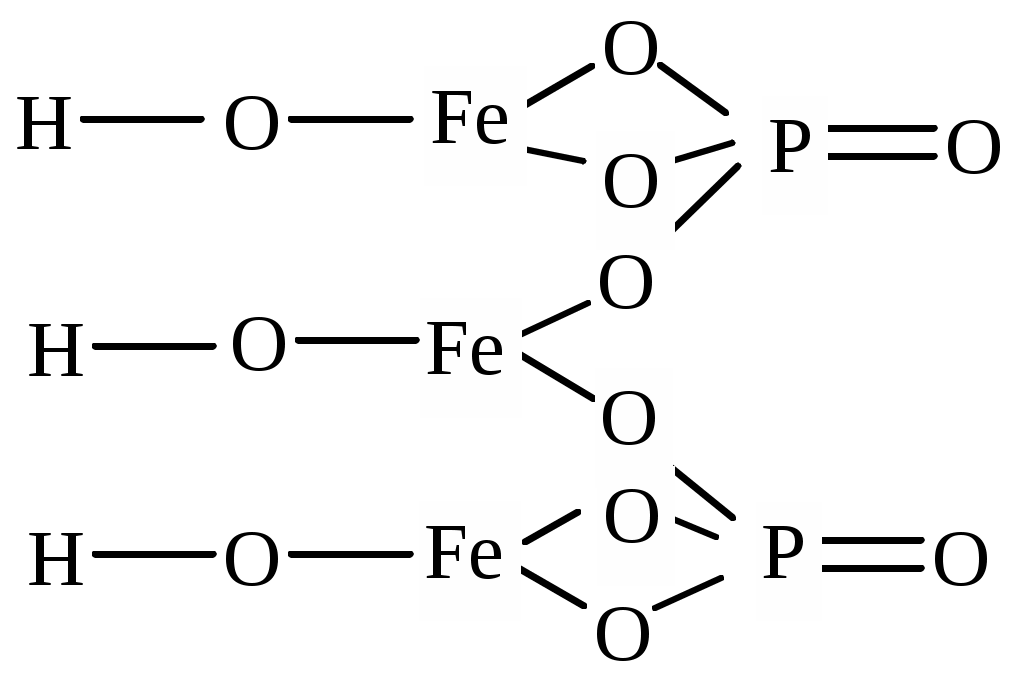
| (FeOH)3(PO4)2 | трис(железо гидроксид) бис(фосфат) | железо (III) гидроксид (орто)фосфат |
| BiOCl | висмут оксид хлорид | висмут (III) оксид хлорид |