Контрольные и лабораторные работы_Вариант 1. Учебнометодическое пособие для студентов 1 курса заочного отделения фармацевтического факультета
 Скачать 1.14 Mb. Скачать 1.14 Mb.
|
Задачи на концентрации растворовДля решения задач необходимо знать определения и математические выражения следующих способов выражения концентраций растворов: массовой доли W(%), молярной концентрации С(моль/л), молярной концентрации эквивалента С( Массовая доля W (процентная концентрация) показывает отношение массы растворенного вещества х, содержащегося в системе, к общей массе этой системы (раствора). W может быть выражена в долях и в процентах: Молярная концентрация С(х) (молярность) – это отношение количества вещества х (в молях), содержащегося в растворе, к объему этого раствора, то есть она показывает, сколько молей растворенного вещества содержится в 1 л раствора. Молярная концентрация эквивалента С(  (моль/л), (3) (моль/л), (3)где Молярная масса эквивалента вещества Например, Количество вещества эквивалента 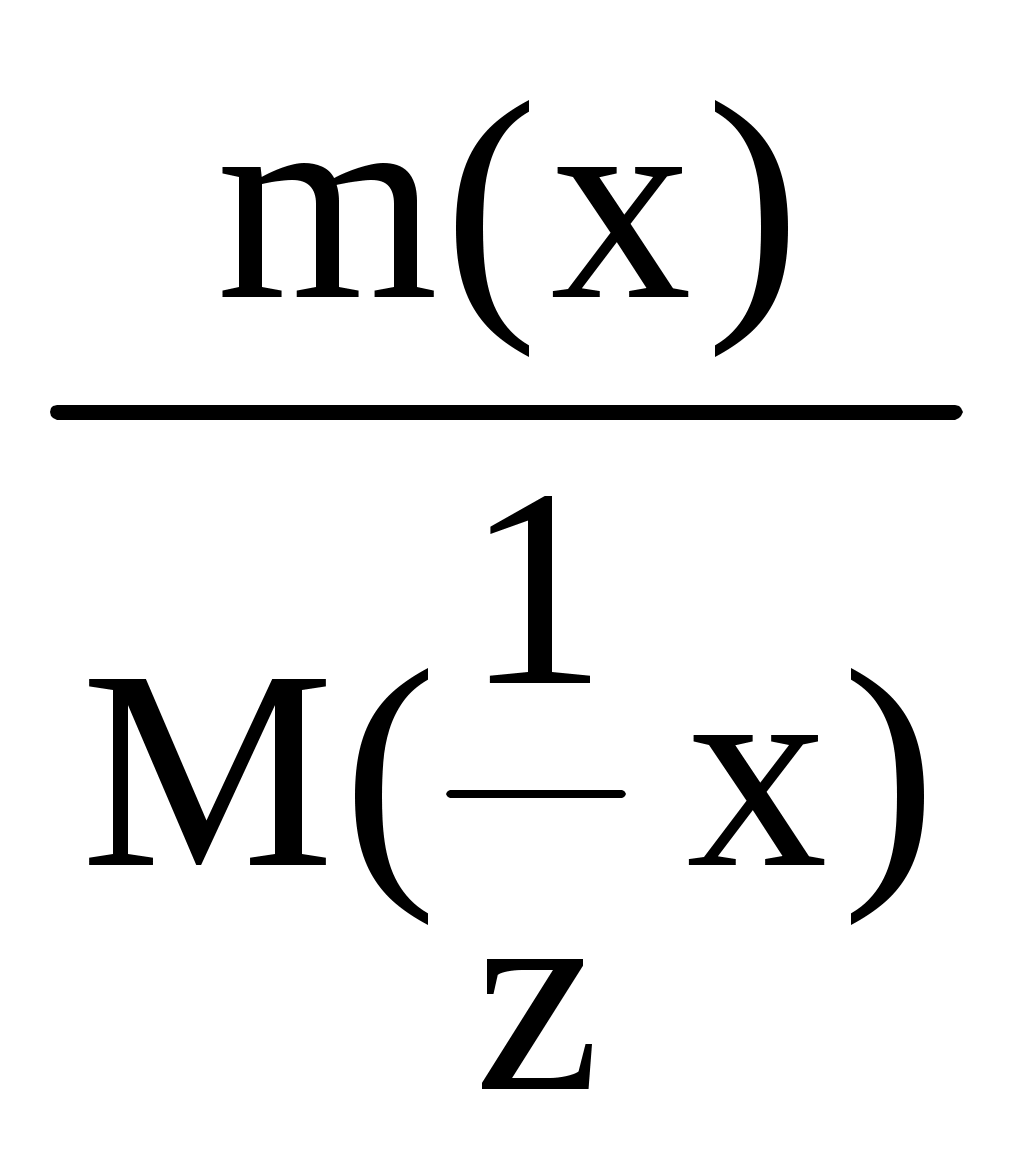 (моль) (5) (моль) (5)Прежнее название молярной концентрации эквивалента – нормальная концентрация или нормальность. Например, раствор с Титр раствора t или T – это масса вещества, содержащегося в 1 мл раствора. Единица измерения – г/мл. Из основных формул можно вывести и вспомогательные. Из формул (2) и (3) выражают массу (в г): и Связь между молярной концентрацией и массовой долей: Вывод формулы (9): поскольку Связь между молярной концентрацией эквивалента и массовой долей: Вывод формулы (10) аналогичен выводу формулы (9). Связь между молярной концентрацией и титром: Вывод формулы (11): Связь между молярной концентрацией эквивалента и титром: Вывод формулы аналогичен выводу формулы (11). Связь между титром и массовой долей: Вывод формулы (13): Связь между молярной концентрацией и молярной концентрацией эквивалента Отсюда Приравняем правые части формул (7) и (8) Вместо |
