ГОРМОНЫ. Учебнометодическое пособие по курсу нормальной физиологии Общие закономерности гормональной регуляции
 Скачать 1.75 Mb. Скачать 1.75 Mb.
|
Механизмы защиты от повреждающего действия стрессаЗащита от стресса проявляется в организме двумя путями. Первый связан с изменением и ограничением активности стресс-реализующих систем в процессе адаптации. Этот механизм обусловлен тем, что при тренировках к стрессирующим воздействиям увеличивается мощность стресс-реализующих систем – на фоне снижения уровней гормонов повышается чувствительность тканей к гормонам. Второй механизм связан с включением специфических систем защиты от стресса, активация которых начинается параллельно с активацией стресс-реализующих и находится от них в прямой зависимости. Эти системы называются стресс-лимитирующими. Начиная обсуждение стресс-лимитирующих систем, вспомним, что АКТГ гипофиза образуется в виде большой молекулы прооопиомеланокортина, из которой затем получается АКТГ и -липотропин. Это вещество обладает собственными эффектами и одновременно является и прогормоном, из него образуются энкефалин и -эндорфин. Эти соединения называются эндогенными опиоидами, они способны регулировать функции мозга и обладают обезболивающими эффектами. Оказалось, что накопление опиатов в головном мозге ограничивает возбуждение САС, ингибирует синаптическую передачу. Например, внутривенное введение этих веществ ограничивает повреждающее действие катехоламинов, снижает их липотропный эффект, уменьшает гиперкальциевые контрактуры в миокарде. Наряду с системой опиоидных пептидов при стрессе возрастает активность ферментов биосинтеза еще одного стресс-лимитирующего фактора головного мозга - аминомасляной кислоты, этот тормозной медиатор ограничивает интенсивность стресса и уменьшает длительность стресс-реакции, обладает обезболивающим эффектом – снижает проводимость по восходящим спинномозговым путям. Существенное значение в защите клеток от повреждающего действия свободнорадикальных продуктов перекисного окисления липидов играет система эндогенных антиокислителей, или антиоксидантов. К таким антиокислителям относятся токоферолы, флавоноиды, стероидные гормоны, лецитин, кефалин, фосфолипиды, простагландины. При снижении уровня антиоксидантов течение адаптации нарушается, не происходит регенерации поврежденных тканей, снижается способность к пролиферации и гипертрофии, в целом повреждение клеток преобладает над их стабилизацией. В системе антиокислителей можно выделить два механизма, с помощью которых ограничивается повреждающее действие свободных радикалов. Первый заключается в способности антиокислителей взаимодействовать с активными формами кислорода и путем отдачи иона водорода переводить их в неактивные. Второй основан на способности антиоксидантов блокировать ферменты свободнорадикального окисления. Суммируем в таблице процессы, от соотношения которых зависит успешность адаптации. Таблица 7 Основные адаптирующие реакции и варианты защиты от возможного повреждающего эффекта
Адаптируемость человека зависит от силы и вида стресса, от того, как эффективно стресс-реализующие системы помогут адаптации, от того велико ли будет повреждающее действие этих систем, от эффективности работы сресс-лимитирующих систем. Вопросы и задания
на белковый обмен на жировой обмен на углеводный обмен Гормоны в регуляции основных параметров гомеостаза Гормональная регуляция обмена веществ Когда мы говорим о регуляции всех видов обмена, мы немного лукавим. Дело в том, что избыток жиров приведет к нарушению их обмена и образованию, например, атеросклеротических бляшек, а недостаток к нарушению синтеза гормонов лишь через длительное время. Это же касается и нарушений белкового обмена. Лишь уровень глюкозы в крови является тем гомеостатическим параметром, снижение уровня которого приведет к гипогликемической коме через несколько минут. Это произойдет в первую очередь потому, что нейроны не получат глюкозы. Поэтому, говоря об обмене веществ, в первую очередь обратим внимание на гормональную регуляцию уровня глюкозы в крови, а параллельно остановимся на роли этих же гормонов в регуляции жирового и белкового обмена. Регуляция углеводного обмена Глюкоза наряду с жирами и белками является источником энергии в организме. Запасы энергии в организме в виде гликогена (углеводы) невелики по сравнению с запасом энергии, представленной в виде жиров. Так, количество гликогена в организме человека весом 70 кг составляет 480 г (400 г – гликоген мышц и 80 г – гликоген печени), что эквивалентно 1920 ккал (320 ккал-гликоген печени и 1600 – гликоген мышц). Количество циркулирующей глюкозы в крови составляет всего 20 г (80 ккал). Содержащаяся в этих двух депо глюкоза является основным и почти единственным источником питания инсулиннезависимых тканей. Так, головной мозг массой 1400 г при интенсивности кровоснабжения 60 мл/100 г в минуту потребляет 80 мг/мин глюкозы, т.е. около 115 г за 24 часа. Печень способна генерировать глюкозу со скоростью 130 мг/мин. Таким образом, более 60% глюкозы, образующейся в печени, идет на обеспечение нормальной активности центральной нервной системы, причем это количество остается неизменным не только при гипергликемии, но даже при диабетической коме. Потребление глюкозы ЦНС уменьшается лишь после того, как ее уровень в крови становится ниже 1,65 ммоль/л (30 мг%). В синтезе одной молекулы гликогена участвуют от 2000 до 20 000 молекул глюкозы. Образование гликогена из глюкозы начинается с процесса фосфорилирования ее с помощью ферментов глюкокиназы (в печени) и гексокиназы (в других тканях) с образованием глюкозо-6-фосфата (Г-6-Ф). Количество глюкозы в крови, оттекающей от печени, зависит в основном от двух взаимосвязанных процессов: гликолиза и глюконеогенеза, которые в свою очередь регулируются ключевыми ферментами фосфофруктокиназой и фруктозо-1, 6-бисфосфатазой соответственно. Активность этих ферментов регулируется гормонами. Регуляция концентрации глюкозы в крови происходит двумя путями: 1) регуляция по принципу отклонения параметра от нормальных значений. Нормальная концентрация глюкозы в крови составляет 3.6 – 6.9 ммоль/л. Регуляция концентрации глюкозы в крови в зависимости от ее концентрации осуществляется двумя гормонами с противоположными эффектами – инсулином и глюкагоном; 2) регуляция по принципу возмущения – эта регуляция не зависит от концентрации глюкозы в крови, а осуществляется в соответствии с необходимостью увеличения уровня глюкозы в крови в различных, как правило, стрессирующих ситуациях. Гормоны, увеличивающие уровень глюкозы в крови, поэтому называются контринсулярными. К ним относятся: глюкагон, адреналин, норадреналин, кортизол, тиреоидные гормоны, соматотропин, потому, что единственный гормон, снижающий уровень глюкозы в крови – инсулин (рисунок 18). Основное место в гормональной регуляции гомеостаза глюкозы в организме отводится инсулину. Под влиянием инсулина активируются ферменты фосфорилирования глюкозы, катализирующие образование Г-6-Ф. Инсулин также повышает проницаемость клеточной мембраны для глюкозы, что усиливает ее утилизацию. При увеличении концентрации Г-6-Ф в клетках повышается активность процессов, для которых он является исходным продуктом (гексозомонофосфатный цикл и анаэробный гликолиз). Инсулин увеличивает долю участия глюкозы в процессах образования энергии при неизменном общем уровне энергопродукции. Активация инсулином гликогенсинтетазы и гликогенветвящего фермента способствует увеличению синтеза гликогена. Наряду с этим инсулин оказывает ингибирующее влияние на глюкозо-6-фосфатазу печени и тормозит, таким образом, выход свободной глюкозы в кровь. Кроме того, инсулин угнетает активность ферментов, обеспечивающих глюконеогенез, за счет чего тормозится образование глюкозы из аминокислот Конечным результатом действия инсулина (при его избытке) является гипогликемия, стимулирующая секрецию контринсулярных гормонов-антагонистов инсулина. ИНСУЛИН - гормон синтезируется клетками островков Лангерганса поджелудочной железы. Основной стимул для секреции - повышение уровня глюкозы в крови. Гипергликемия способствует увеличению выработки инсулина, гипогликемия уменьшает образование и поступление гормона в кровь Кроме того, секреция инсулина усиливается под влиянием. ацетилхолина (парасимпатическая стимуляция), норадреналина через -адренорецепторы, а через -адренорецепторы норадреналин тормозит секрецию инсулина. Некоторые гормоны желудочно-кишечного тракта, такие как желудочный ингибирующий пептид, холецистокинин, секретин, увеличивают выход инсулина. Основной эффект гормона – снижение уровня глюкозы в крови. Под воздействием инсулина происходит уменьшение концентрации глюкозы в плазме крови (гипогликемия). Это связано с тем, что инсулин способствует превращению глюкозы в гликоген в печени и мышцах (гликогенез). Он активирует ферменты, участвующие в превращении глюкозы в гликоген печени, и ингибирует ферменты, расщепляющие гликоген. Таблица 8 Действие инсулина на метаболические процессы
Снижение концентрации глюкозы в крови стимулирует секрецию глюкагона. Под влиянием глюкагона происходит распад гликогена в печени до глюкозы. В результате этого повышается содержание глюкозы в крови. ГЛЮКАГОН - пептидный гормон, участвующий в поддержании углеводного обмена; является физиологическим антагонистом инсулина, а также стимулятором его секреции. Глюкагон секретируется альфа-клетками островков поджелудочной железы животных и человека. Помимо альфа-клеток поджелудочной железы, глюкагон секретируется аргирофильными клетками слизистой оболочки двенадцатиперстной кишки. Биологическое действие глюкагона в огрганизме происходит в трех основных направлениях: а) активное участие в процессе гомеостаза глюкозы; б) стимуляция секреции инсулина и в) липолитическое действие. Гипергликемический эффект глюкагона при введении животным обусловлен его воздействием на процесс распада гликогена в печени. Это связано со стимуляцией глюкагоном перехода неактивной формы фосфорилазы В в активную фосфорилазу А, которая вызывает распад гликогена до глюкозо-6-фосфата. Гликогенолитическое действие глюкагона наступает при концентрации его 1 ммкг/мл. В норме глюкагон предотвращает чрезмерное снижение глюкозы в крови, которое может произойти при усилении секреции инсулина. При снижении уровня сахара в крови выделение глюкагона увеличивается, что приводит к восстановлению содержания глюкозы до исходного уровня. Глюкагон оказывает значительно более выраженное гликогенолитическое действие, чем адреналин; в отличие от адреналина, также усиливающего распад гликогена в печени, глюкагон не влияет на распад гликогена в мышцах. Установлено, что физиологическое действие глюкагона двояко: как антагониста и как стимулятора секреции инсулина. Глюкагон - липолитический гормон, мобилизующий жирные кислоты из жировой ткани. При этом также проявляется его контринсулярный эффект, поскольку инсулин способствует липогенезу. Механизм липолитического действия глюкагона проявляется через систему аденилатциклазы, активирующей ферменты липолиза. 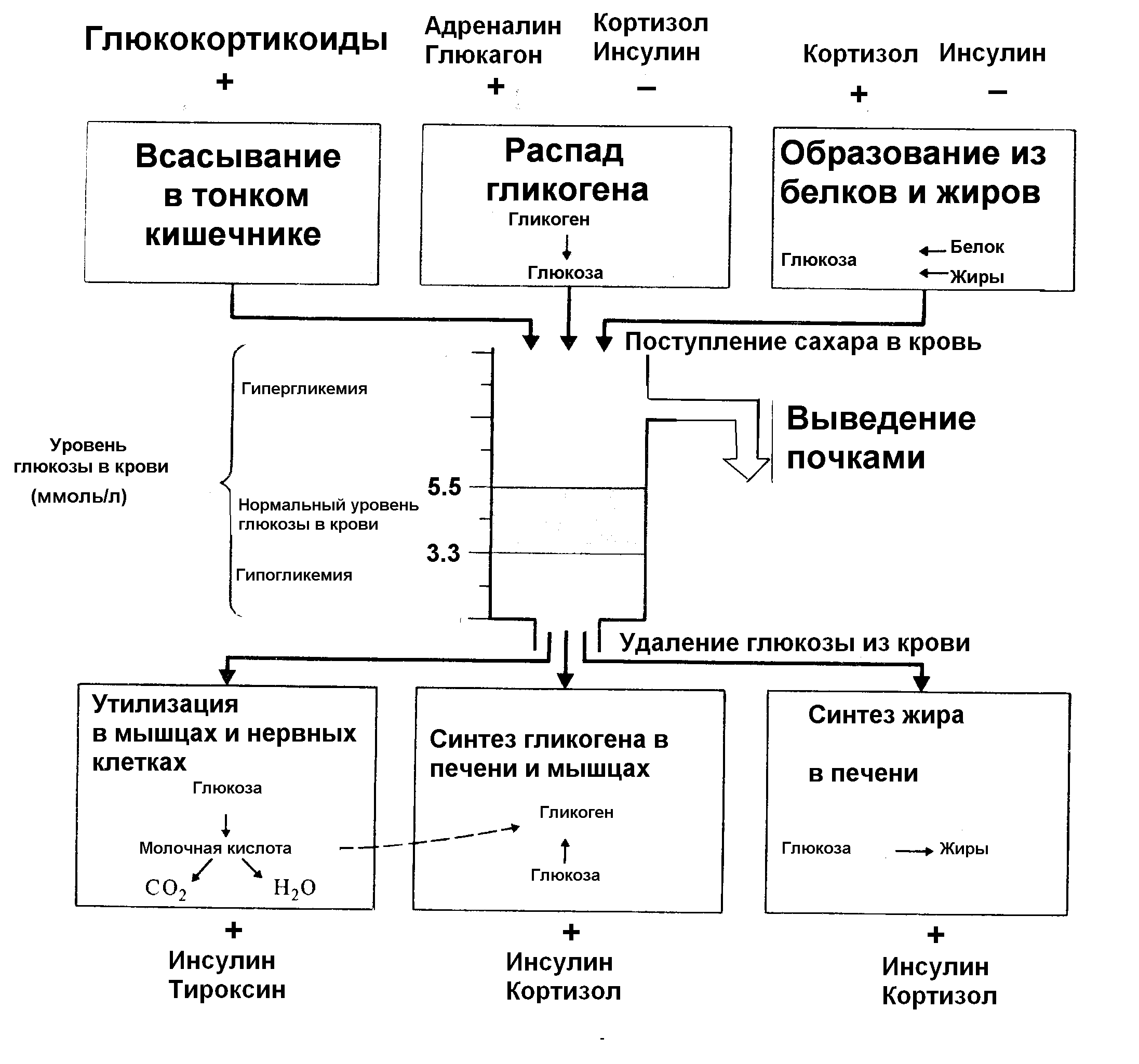 Рисунок 18. Гормональная регуляция уровня глюкозы в крови В экспериментах глюкагон способствует секреции тиреокальциотонина и тем самым вызывает снижение содержания кальция в крови; Глюкагон оказывает положительное хронотропное действие на синусовый ритм, положительное инотропное действие на миокард, ускоряет предсердно-желудочковую проводимость и несколько уменьшает периферическое сопротивление. Это воздействие происходит независимо от действия катехоламинов и обусловлено активированием аденилатциклазы и гликогенолиза в мышце сердца. В состоянии покоя клетки мозгового слоя надпочечников постоянно секретируют небольшие количества адренаналина и норадреналина. Под влиянием внешнего или внутреннего стрессирующего фактора, например в ситуациях, требующих большого физического или умственного напряжения, а также при инфекции и травме, резко повышаются секреция адреналина и норадреналина. Катехоламины стимулируют гликогенолиз в печени и мышцах. Увеличение синтеза цАМФ под влиянием катехоламинов и в большей степени адреналина активирует фосфорилазу печени, распад гликогена и образование большого количества свободной глюкозы. При этом увеличиваются поглощение кислорода, затраты энергии в связи с усилением сердечной деятельности, повышением мышечного тонуса и окислением молочной кислоты в печени. Глюкокортикоиды вызывают повышение содержания глюкозы в плазме крови (гипергликемия). Этот эффект обусловлен стимулированием процессов глюконеогенеза в печени, т.е. образования глюкозы из аминокислот и жирных кислот. Глюкокортикоиды угнетают активность фермента гексокиназы, что ведет к уменьшению утилизации глюкозы тканями. Соматотропный гормон при длительном повышении концентрации становится контринсулярным. Гормон роста увеличивает выход глюкозы в печеночные вены, усиливает глюконеогенез, уменьшает поглощение глюкозы на периферии, а также усиливает липолиз, в результате чего в крови повышается концентрация свободных жирных кислот, которые подавляют действие инсулина на мембранный транспорт глюкозы. Жировой обмен Жиры являются одним из основных источников энергии: 40-50% энергопродукции организма обеспечивается триглицеридами (триацилглицерины), на долю которых приходится более 95% всех липидов. В организме нормального человека с массой 70 кг на долю жировой ткани приходится 12 кг (110 000 ккал). Наряду с этим в крови определяется дополнительно 3 г триглицеридов (30 ккал), 0,3 г свободных жирных кислот (3 ккал) и 0,2 г кетоновых тел (0,8ккал). Липогенез – процесс синтеза жирных кислот, интенсивно протекающий в печени и жировой ткани. При эстерификации жирных кислот с глицерином образуются триглицериды. В печени и жировой ткани инсулин увеличивает синтез жирных кислот и триглицеридов. Липолиз – процесс гидролиза липидов с образованием неэстерифицированных жирных кислот и глицерина – катализируется внутриклеточной гормональнозависимой липазой (триацилглицериновая липаза), которая воздействует на триглицериды и стимулируется цАМФ. Липаза лимитирует скорость липолиза, а образование цАМФ под влиянием аденилатциклазы находится в свою очередь под контролем различных гормонов. Мембрана адипоцитов содержит рецепторы, взаимодействующие с гормонами, обладающими липолитическими свойствами (катехоламины, АКТГ, СТГ), и рецепторы к инсулину. В результате действия липолитических гормонов повышается активность аденилатциклазы, увеличивается образование цАМФ, активизируются гормончувствительная липаза и липолиз. Взаимодействие инсулина с соответствующими рецепторами, наоборот, приводит к угнетению аденилатциклазы, снижению концентрации цАМФ и торможению липолиза. Липолиз увеличивается во время голодания, при продолжительной работе, охлаждении, стрессе. Липолитическое действие катехоламинов (адреналина, норадреналина) и глюкагона осуществляется путем активации аденилатциклазы. С физиологической точки зрения, роль норадреналина в процессе липолиза представляется более важной, чем адреналина. Он образуется в адренергических нервных окончаниях в жировой ткани и обеспечивает мобилизацию жирных кислот. Гормон роста оказывает мощное липолитическое действие, которое отличается от действия катехоламинов. Он вызывает увеличение концентрации свободных жирных кислот в плазме через 2-3 часа. Это действие, отмечающееся при введении даже небольших доз СТГ, по-видимому, связано с торможением процесса реэстерификации свободных жирных кислот. Тем не менее, СТГ оказывает определенное модулирующее влияние и на активность аденилатциклазы. Другие гипофизарные гормоны (АКТГ, ТТГ, меланоцитостимулирующий гормон) также оказывают липолитическое действие, хотя и менее выраженное, чем у СТГ. Тиреоидные гормоны и кортикостероиды оказывают пермиссивное (разрешающее) действие на липолиз, поскольку липолитический и калоригенный эффекты катехоламинов не проявляются в отсутствие кортикостероидов и тиреоидных гормонов. Имеются данные о том, что ТТГ, АКТГ, гормоны щитовидной железы и коры надпочечников индуцируют синтез аденилатциклазы и, следовательно, принимают непосредственное участие в стимуляции липолиза. Как уже отмечалось, инсулин обладает характерным антилиполитическим свойством, и при сахарном диабете вследствие увеличения липолиза повышается концентрация свободных жирных кислот в плазме, снижению которой способствует инсулинотерапия. Белковый обмен. Белки в организме также являются источником энергии. Они содержатся главным образом в мышцах и их количество составляет в организме здорового человека массой 70 кг около 6000 г, что соответствует 24 000 ккал. Циркуляция их в крови в виде аминокислот незначительна и составляет всего 6 г, или 24 ккал. По воздействию на белковый обмен все гормоны можно разделить на две большие группы: 1) гормоны, первичное действие которых – стимуляция процессов транскрипции – проявляется в ядре клетки (стероидные и тироидные гормоны); 2) гормоны, стимулирующие процессы трансляции, происходящие в цитоплазме клетки. Анаболическое действие инсулина заключается в ускорении проникновения аминокислот через мембрану клетки и включения их в белки, что вызывает снижение уровня аминокислот в крови. Это действие инсулина не зависит от синтеза РНК. и не угнетается актиномицином. Инсулин снижает активность аминотрансфераз и ферментов цикла мочевины. Последний эффект инсулина характеризуется повышением активности РНК-полимеразы и концентрации РНК в печени. При этом увеличивается скорость образования полисом и рибосом. Действие инсулина на синтез белка в печени противоположно действию глюкагона, который усиливает катаболизм аминокислот и мобилизует их для процессов глюконеогенеза. Основным эффектом действия гормона роста является стимуляция анаболичесих процессов, чем и обусловливается ускорение роста скелета при гиперсекреции этого гормона. Он, так же как инсулин, стимулирует транспорт аминокислот и их включение рибосомами в белки, повышает скорость образования полисом и рибосом, активность РНК-полимеразы, увеличивает количество РНК в клетках, что сопровождается повышением скорости синтеза белков. Гормон роста угнетает активность ферментов, разрушающих аминокислоты, повышает уровень инсулиноподобных факторов роста I и II (ИФР I и II) в сыворотке крови, стимулирует синтез коллагена в костях, коже, других органах и тканях организма. Тиреоидные гормоны не влияют на транспорт аминокислот. Под действием этих гормонов возрастает активность ферментов, в том числе глицеролфосфатдегидрогеназы, цитохромоксидазы, цитохрома С, NAD-изолимонной дегидрогеназы, а также РНК-полимеразы и увеличивается синтез РНК (включая м-РНК). Под влиянием эстрогенов увеличивается содержание РНК, что приводит к усилению синтеза белка. Андрогены оказывают на белковый обмен такое же действие, как и эстрогены. Кроме того, тестостерон и другие андрогены влияют на развитие мышечной ткани, улучшая транспорт аминокислот и повышая активность РНК-полимеразы. Таким образом, гормоны регулируют все виды обмена веществ (углеводный, жировой, белковый, минеральный и др.), поддерживая постоянство внутренней среды, которое, как установил еще Клод Бернар, является непременным условием жизнедеятельности организма. Регуляция содержания натрия в крови Обсуждая гормональные механизмы регуляции уровня натрия в организме, следует учитывать то что, во-первых, концентрация натрия определяет количество воды в организме, потому, что это основное осмотически активное вещество нашего тела, на долю хлорида натрия приходится 90% осмотической концентрации внутренней среды организма, во-вторых, количество жидкости в организме отражается на объеме циркулирующей крови (ОЦК), который в свою очередь определяет величину артериального давления. От ОЦК зависит систолический объем (СО) сердца – в соответствии с основным законом сердца СО тем больше, чем больше крови возвращается к сердцу. Кроме того, увеличение ОЦК увеличивает сосудистый тонус, что связано со свойствами гладких мышц: сокращаться в ответ на растяжение. Поэтому, регуляция содержания натрия в организме определяет не только его концентрацию в крови, но и ОЦК и АД. Нормальная концентрация натрия в крови составляет 140-150 ммоль/л, это одна из наиболее жестких констант в организме. Уровень натрия в организме регулируется двумя системами с противоположными эффектами: натриуретическая - натриуретические пептиды и антинатриуретическая - ренин-ангиотензин-альдостероновая. Основная гуморальная система, регулирующая концентрацию натрия - антинатриуретическая ренин-ангиотензин-альдостероновая система. Эта система является функционально более мощной по сравнению с системой антагонистом, потому что эволюция позвоночных протекала в постоянной борьбе за соль, и только человек, получив неограниченный доступ к соли, расплачивается за это различными вариантами артериальной гипертензии благодаря высокой мощности антинатриуретической системы. Количество выведенного из организма и задержанного натрия определяется работой почечных канальцев. Оценка уровня артериального давления и концентрации натрия в клубочках тоже происходит в почке – в юкстагломеруллярном аппарате. Таким образом, в почке находится и рецепторная, и эффекторная части антинатриуретической системы. Юкстагломерулярный аппарат почки состоит из приносящих и выносящих артериол клубочка, плотного пятна дистального извитого канальца, которое прилегает к приносящей артериоле и мезангиальных клеток. При стимуляции миоэпителиальных клеток приносящей артериолы клубочка эти клетки секретируют в кровь протеолитический фермент ренин. Активность ренина в плазме крови отражает функуциональную активность ренин-ангиотензин-альдостероновой системы. Результатов деятельности ренина является появление в плазме крови мощного биологически активного вещества – ангиотензина II. АНГИОТЕНЗИН (II и III) - Ангиотензин I - биологически неактивный декапептид, который образуется в плазме крови из предшественника - ангиотензиногена. Эта реакция протекает под действием протеолитического фермента ренина. Ренин синтезируется и секретируется юкстагломерулярными клетками приносящей артериолы почечных клубочков в случаях: 1) снижения давления в приносящей артериоле (кровопотеря, снижение ОЦК, снижение системного артериального давления – снижение минутного объема крови, периферического сосудистого сопротивления, 2) активации симпатической нервной системы ( эффект), 3) снижения концентрации натрия и повышении концентрации калия. Подавляется секреция ренина предсердным натриуретическим фактором и АДГ (вазопрессином). Ангиотензин I превращается в биологически активный октапептид ангиотензин II (АII) под действие ангиотензин превращающего фермента (АПФ) преимущественно в сосудистой системе легких. Основные биологические эффекты оказывает именно этот октапептид (рисунок 19). Ангиотензин III - метаболит А II, который обладает частью эффектов предшественника, преимущественно по отношению к клубочковой зоне надпочечников. У А II несколько эффектов:
Мы перечислили эффекты, которые оказывают физиологические концентрации АII, однако, есть ситуации, в которых уровень этого вещества увеличивается значительно – это нарушения кровоснабжения почек, некоторые варианты артериальной гипертензии. В этих ситуациях проявляются и патологические эффекты АII: гипертрофия и гиперплазия гладкомышечных клеток, гипертрофия кардиомиоцитов, повреждение сосудов клубочка, гибель нефронов. Самый неприятный из этих эффектов - кардиотоксический – этот эффект обусловлен накопление ионов кальция в кардиомиоцитах. 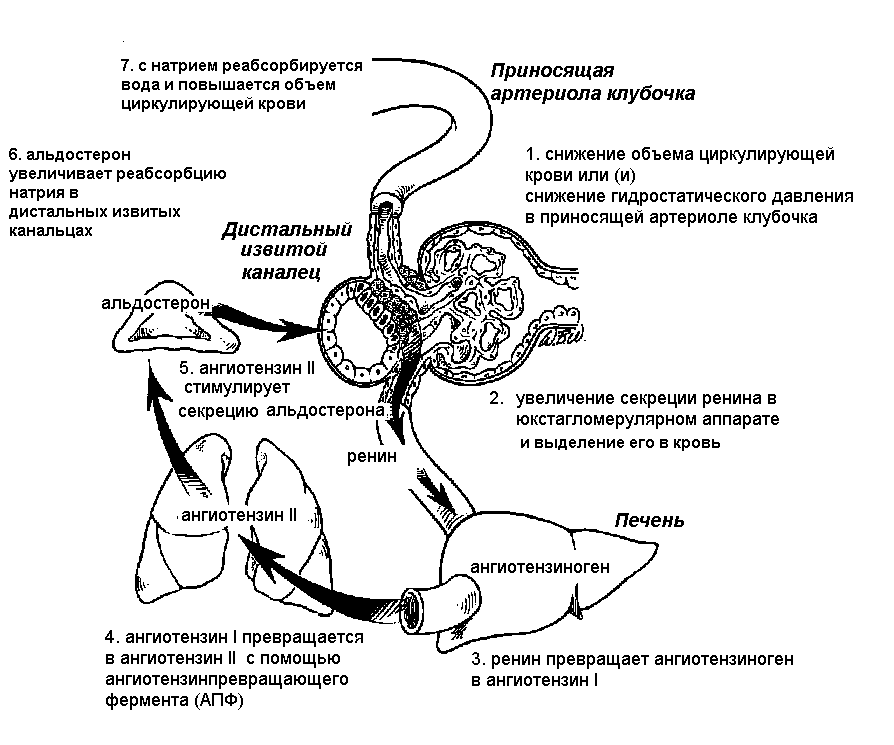 Рисунок 19. Юкстагломерулярный аппарат почки и функциональная организация ренин-ангиотензин-альдостероновой системы Увеличение концентрации альдостерона в крови приводит к задержке натрия и воды в организме и восстановлению АД. АЛЬДОСТЕРОН - гормон клубочковой зоны коры надпочечников. Стимулы для выделения гормона (по значимости) 1 - повышение концентрации ангиотензина II в крови, 2 - повышение концентрации калия в плазме, 3 - снижение концентрации натрия в плазме, 4 - существенное повышение концентрации АКТГ, 5 - простагландин Е. Основные эффекты альдостерон оказывает в дистальных канальцах нефронов, хотя подобные эффекты отмечены, правда в меньшей степени и в проксимальных канальцах, и в протоках слюнных желез, и в кишечнике. Основной эффект альдостерона - увеличение реабсорбции натрия. В результате, натрий задерживается и остается в организме, с ним задерживается эквивалентное количество воды, следовательно, сохраняется объем циркулирующей крови при его снижении, или угрозе кровопотери. Кроме того, альдостерон увеличивает секрецию калия и выведение его из организма, и секрецию водородных ионов. Альдостерон, как стероидный гормон, оказывает свои эффекты, действуя на генетический аппарат клетки (рисунок 20). 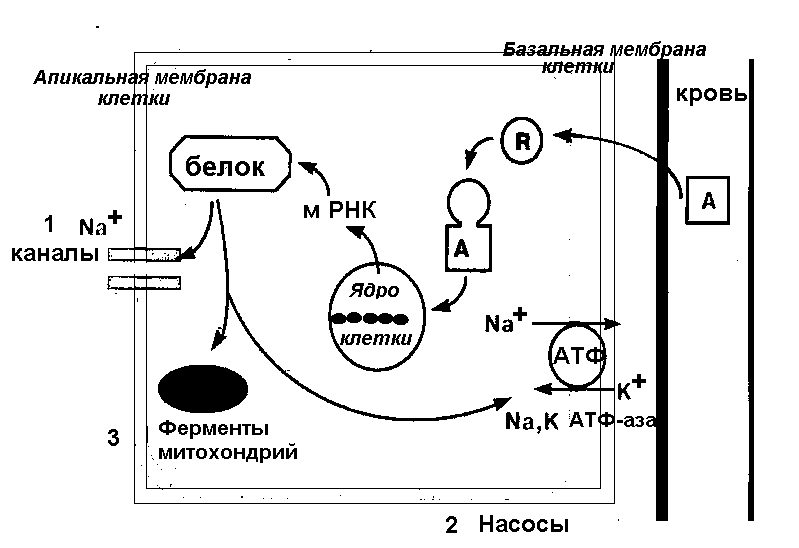 Рисунок 20. Механизм действия альдостерона Под действием альдостерона усиливается синтез м-РНК и, следовательно, белков в клетках-мишенях. Белков, синтез которых индуцируется под действием альдостерона, немного, и их грубо можно разделить на три класса. 1. Увеличивается количество пермеаз - переносчиков, облегчающих диффузию натрия. Этот эффект альдостерона очень быстрый и осуществляется в два этапа: сначала активируются уже имеющиеся переносчики и изменяются свойства клеточной мембраны (отношение фосфатидилхолин/фосфатидилэтаноламин), а затем активируется синтез новых молекул переносчиков. 2. Повышается активность окислительных ферментов митохондрий, следовательно концентрации АТФ. 3. Синтезируются и встраиваются в мембрану клетки новые молекулы Na+K+ - АТФазы. Таким образом, под действием альдостерона усиливается и облегчается транспорт натрия в клетку из просвета канальца и его активное выведение из клетки в интерстиций почки и затем в кровь. При этом активный транспорт натрия увеличивается и за счет количества молекул Na+K+ -АТФазы, и за счет повышения синтеза АТФ для этого активного процесса. Основные эффекты альдостерона
При избытке альдостерона наблюдается гиперволлюмия, артериальная гипертензия, алкалоз, нарушение сердечного ритма, повышение экскреции магния и кальция, при недостатке - гиповолюмия, гипотензия, ацидоз, нарушение сердечного ритма, избыток вазопрессина, нарушения пищеварения. Натриуретическая система реализует свои эффекты с помощью натриуретических пептидов в тех случаях, когда увеличивается ОЦК. НАТРИУРЕТИЧЕСКИЙ ПЕПТИД (НУП) - семейство пептидов, которые образуются в предсердиях, гипоталамусе и сосудистой стенке. Структура пептидов различного происхождения немного отличается, однако эффекты их похожи. Натриуретический пептид, который образуется в предсердиях называется атриальным натриуретическим пептидом. Натриуретические пептиды секретируются популяцией миоэндокринных клеток. Предполагается, что эти клетки имеют механочувствительные кальциевые каналы и пептиды секретируются при растяжении предсердий или сосудов. Основной эффект - усиление выведения натрия и воды почками. Механизм действия противоположен действию альдостерона и заключается в снижении реабсорбции натрия. НУП уменьшает число натриевых каналов на апикальной мембране клеток эпителия почечных канальцев (этот канал называется ENaC), уменьшает скорость Na/H обмена, следовательно, снижается скорость поступления ионов натрия в клетку. Под действием НУП снижается активность Na/K-АТФ-азы, следовательно, снижается активный транспорт натрия из клетки в интерстиций через базолатеральную мембрану. Натриуретические пептиды обладают умеренным вазодилататорным эффектом, этот эффект реализуется тоже путем уменьшения числа натриевых каналов, но уже на мембране гладкомышечных клеток (эти каналы называются ENaS). Таким образом снижается возбудимость гладкой мускулатуры. НУП обладает антипролиферативным эффектом по отношению к гладким мышцам сосудистой стенки, в соответствии с этим свойством, является антагонистом АII (см.), кроме того, подавляет секрецию ренина в почках, снижают частоту сердечных сокращений. В ЦНС подавляет возбудимость центра жажды, снижают солевой аппетит. Таблица 9 Основные эффекты натриуретических пептидов
В регуляции водно-солевого обмена и соотношении в организме натрия и воды, что определяет осмотическую концентрацию внутренней среды важное место принадлежит гормону задней доли гипофиза – вазопрессину, или антидиуретическому гормону (АДГ). ВАЗОПРЕССИН (антидиуретический гормон - АДГ) - нейрогормон, который синтезируется нейронами супраоптического и паравентрикулярного ядер передней области гипоталамуса. Транспортируется по аксонам нейронов в заднюю долю гипофиза и отсюда выделяется в кровь. Вазопрессин - один их компонентов сложного комплекса механизмов, которые обеспечивают постоянство осмотической концентрации внутренней среды и объема жидкости в организме. Эффекты вазопрессина реализуются за счет связывания пептида с двумя видами рецепторов в тканях мишенях: V - 1 рецепторы локализованы в стенке кровеносных сосудов, эффект опосредован инозитол-3-фосфатом и кальций - кальмодулином. V - 2 рецепторы - локализованы в дистальных отделах почечных канальцев и собирательных трубочках, эффект опосредован цАМФ. Вазопрессин, действуя через V - 1 рецепторы, стимулирует сокращение гладкой мускулатуры сосудов и вызывает их сужение. Этот эффект гормона в нормальных условиях практически не осуществляется, сосудосуживающий эффект вазопрессин оказывает только в высоких дозах. Через V - 2 рецепторы осуществляется основной эффект вазопрессина - активация реабсорбции воды, которая является результатом изменения проницаемости эпителия канальцев для воды под действием гормона. Образование гормон-рецепторного комплекса приводит через активацию GS - белка и гуанилового нуклеотида к активации аденилатциклазы и образованию цАМФ у базолатеральной мембраны клеток эпителия (именно там происходит соединение гормона с рецептором). После этого цАМФ переходит к апикальной мембране клетки и активирует там цАМФ - зависимые протеинкиназы. Под влиянием этих ферментов происходит фосфорилирование белков мембраны. В результате: 1) увеличивается поверхность мембраны, 2) в мембрану встраивается специальный белок - аквапорин, который облегчает перенос воды (в действительности это целое семейство белков), 3) образуются специализированные вакуоли, в которых вода переносится от апикальной к базолатеральной мембране не изменяя осмотической концентрации внутри клетки, поэтому клетка не набухает, 4) активируется синтез и выход из клетки гиалуронидаз - ферментов, которые расщепляют гликозаминогликаны соединительной ткани и облегчают транспорт воды. Кроме того, вазопрессин в ЦНС стимулирует центр жажды, участвует в механизмах запоминания и терморегуляции, участвует в регуляции нейроэндокринных функций в качестве нейромедиатора, принимает участие в регуляции биологических ритмов и эмоциональном поведении. В дозах в 1000 раз превышающих физиологические стимулирует выделение АКТГ. |
