Учебное пособие для подготовки к Единому Государственному Экзамену. Под редакцией профессора, доктора педагогических наук, директора моу Лицей 13 С. А. Старченко. Троицк 2016. 124
 Скачать 1.57 Mb. Скачать 1.57 Mb.
|
|
(ответ – 4) В двух последних задачах этого варианта нужно с помощью закона Клапейрона- Менделеева вычислить один из параметров газа, если даны остальные параметры. 9). В задаче 1.3 из закона Клапейрона - Менделеева 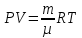 получим  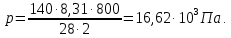 (ответ - 1). 10). В задаче 2.3 при вычислениях следует не забыт перевести температуру газа в Кельвины. Из закона Клапейрона - Менделеева находим 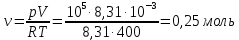 . .(ответ - 1). 11). Задача 4.4. Из уравнения состояния в форме pV = NkT (13.2) следует, что при одинаковых объемах и температурах давление идеального газа определяется только полным числом молекул. Поэтому отношение давления водорода р1 и гелия р2 равно 2. (ответ - 2). 12). Задача 5.4. Поскольку перегородка подвижная и находится в равновесии, давления газа в отсеках сосуда слева и справа от перегородки равны. Применяя к ним при этом условии закон Клапейрона - Менделеева, получим для гелия pVHe= 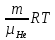 , ,для азота 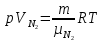 , ,где температуры Т и массы газовm по условию одинаковы. Деля эти уравнения друг на друга, находим отношение объемов частей сосуда 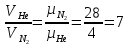 (ответ- 4) 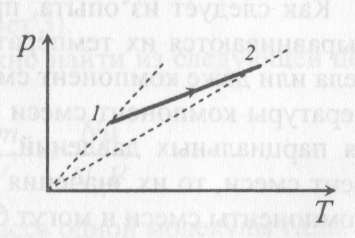 13). Задача 6.4. Если бы точки, отвечающие состояниям 1 и 2 лежали на одной прямой, продолжение которой проходит через начало координат, то эти состояния принадлежали бы одной и той же изохоре, и, следовательно, объем газа в этих состояниях был одинаковым (см. формулу(13.6)). 13). Задача 6.4. Если бы точки, отвечающие состояниям 1 и 2 лежали на одной прямой, продолжение которой проходит через начало координат, то эти состояния принадлежали бы одной и той же изохоре, и, следовательно, объем газа в этих состояниях был одинаковым (см. формулу(13.6)). Поэтому для сравнения объемов этих состояний построим изохоры, проходящие через точки 1 и 2, и сравним отвечающие им объемы (см. рисунок; изохоры, проходящие через точки 1 и 2, показаны пунктиром). Из формулы (13.6) следует, что чем больше объем, тем меньше коэффициент перед Т в зависимости (13.6), и, следовательно, меньше наклон соответствующей изохоры к оси температур. Поэтому изохоре 1 отвечает больший объем, чем изохоре 2, и, следовательно, объем газа в процессе 1-2 уменьшается V1 < V2. (ответ - 2). 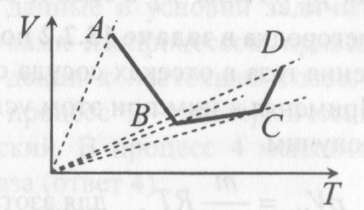 14). Задача 7.4. Аналогичные рассуждения показывают, что наибольшему давлению отвечает изобара, проходящая через точку С (поскольку соответствующая прямая имеет наименьший наклон к оси температур; см. рисунок). 14). Задача 7.4. Аналогичные рассуждения показывают, что наибольшему давлению отвечает изобара, проходящая через точку С (поскольку соответствующая прямая имеет наименьший наклон к оси температур; см. рисунок). ответ - 3. 15). Задача 8.4. В закон Клапейрона - Менделеева входит абсолютная температура газа, поэтому данные в задаче значения нужно перевести в Кельвины. В результате для отношения давлений газа в конечном р2 и начальном p1состояниях получаем 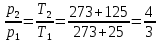 (ответ - 4). 16). Задача 9.4. Как следует из опыта, при приведении тел в тепловой контакт выравниваются их температуры. Это же касается и частей одного тела или даже компонент смеси газов. Поэтому температуры компонент смеси будут одинаковы. (ответ - 1). 17). Задача 10.4. Что касается парциальных давлений, плотностей или концентрации компонент смеси, то их значения зависят от количества молекул каждой компоненты смеси и могут быть различны. Парциальное давление компонент смеси - это давление, которое оказывают только молекулы каждой компоненты. Как следует из формулы (13.8) парциальное давление любой компоненты можно найти, применяя только к ней закон Клапейрона - Менделеева и считая, что она имеет такую же температуру, как и вся смесь, и занимает такай же объем, как и вся смесь газов. Поэтому отношение парциальных давлений отдельных компонент смеси равно отношению количеств вещества (или числа молекул) этих компонент. Поэтому для отношения парциальных давлений углекислого газа р1 и гелия р2 в сосуде имеем р1/р2 =2. (ответ - 2). 18). Задача 1.4. Как следует из закона Дальтона, давление смеси газов определяется полным количеством молекул в ней. Поэтому для анализа изменения давления смеси газов при протекании в ней химической реакции необходимо исследовать изменение числа молекул. Гелий не участвует в химической реакции - один моль гелия был и в начальном, и в конечном состоянии смеси. С озоном происходила реакция 2O3 → 3O2 т.е. из двух молекул озона в результате реакции получились три молекулы кислорода. Поэтому два моля озона превратились в три моля кислорода, и общее количество вещества смеси стало равно четырем молям. Поэтому давление смеси увеличивается в 4/3 раза. (ответ - 2). 19). Задача 2.4. Поскольку объемы и температуры газов одинаковы, для сравнения их давлений необходимо сравнить число молекул в них. По условию в одном сосуде находится один моль азота, в другом 1 г водорода Н2 (т.е. половина моля) и 3·1023 молекул гелия Не (тоже половина моля). Поэтому и в одном и в другом сосуде находятся одинаковые количества молекул, и, следовательно, давление газов в них одинаково. (ответ - 3). 20). Задача 3.4. Плотность газа можно найти из следующей цепочки формул 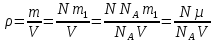 Здесь m - масса газа, m1 - масса одной молекулы газа. (ответ - 4). 3. Задания на проверку элементов знаний и умений по теме: термодинамика. ( Задачи: 5.5; 6.5; 7.5; 8.5; 9.5; 10.5; 1.5; 2.5; 3.5; 4.5; 6.6; 7.6; 8.6; 9.6; 10.6; 1.6; 2.6; 3.6; 4.6; 5.6.) Изучение энергетических превращений в молекулярных системах составляет содержание термодинамики. Для решения задач на термодинамику необходимо знать определения внутренней энергии, количества теплоты, теплоемкости и ряда других величин. Необходимо также понимать и уметь использовать в простейших случаях первый закон термодинамики как балансовое соотношение, описывающее процессы превращения энергии из одних форм в другие. Также нужно знать основные свойства процессов перехода вещества из одних агрегатных состояний в другие. Рассмотрим эти вопросы. Внутренней энергией тела называется сумма кинетической энергии молекул и потенциальной энергии их взаимодействия друг с другом. Для жидкостей и твердых тел из-за сильного взаимодействия молекул друг с другом вычислить внутреннюю энергию не удается. Внутреннюю энергию можно вычислить только для идеальных газов, в которых можно пренебречь энергией взаимодействия молекул друг с другом и считать, что внутренняя энергия равна сумме кинетических энергий молекул. Для одноатомного газа (т.е. газа, каждая молекула которого состоит из одного атома) внутренняя энергияU определяется соотношением 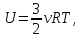 (14.1) (14.1)где ν - количество вещества газа (число молей), R - универсальная газовая постоянная, Т - абсолютная температура. Заметим, что с помощью закона Клапейрона - Менделеева формула (14.1) может быть преобразована к виду 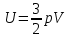 (14.2) (14.2)где р - давление, V - объем газа. Внутренняя энергия тела может измениться при теплообмене, когда молекулы тела сталкиваются с более быстрыми или более медленными молекулами других тел и получают от них или отдают им энергию, или в процессе совершения механической работы над этим телом внешними силами. В связи с эти вводят следующие определения. Количеством теплоты, переданным некоторому телу, называют энергию, переданную этому телу в процессе хаотических столкновений молекул. Процесс передачи энергии в виде теплоты называют процессом теплопередачи. Если внешние силы не совершают над телом работы, для процесса теплопередачи справедливо следующее балансовое соотношение ΔU = Q (14.3) где ΔU - изменение внутренней энергии тела,Q - количество переданной этому телу теплоты. Поскольку изменение внутренней энергии тела может быть и положительным ΔU > 0, и отрицательным ΔU < 0, из закона (14.3) следует, что количеству теплоты следует придать алгебраический смысл: если энергия передается телу, количество переданной этому телу теплоты нужно считать положительным Q > 0, если забирается – отрицательным Q < 0. Внутренняя энергия тела изменяется при сжатии тела, трении и ряде других механических процессах. В этом случае на изменение внутренней энергии расходуется работа А , совершаемая над телом внешними силами ΔU = A (14.4) (конечно, здесь подразумевается, что работа А не расходуется на энергию движения тела как целого, а только на изменение внутреннего движения, т.е. все перемещения тела как целого или его макроскопических частей должны происходить бесконечно медленно). Очевидно, работа внешних сил положительна, если эти силы сжимают тело и его объем уменьшается, и отрицательна - если объем тела увеличивается. В первом случае, как это следует из (14.4), внутренняя энергия тела возрастает (ΔU > 0), во втором убывает (ΔU< 0). 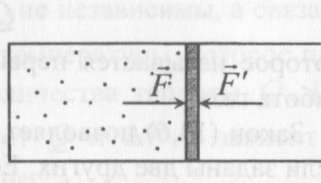 Одновременно с внешними силами при сжатии или расширении тел совершают работу и сами эти тела. Одновременно с внешними силами при сжатии или расширении тел совершают работу и сами эти тела. Рассмотрим, например, газ, находящийся в цилиндрическом сосуде и отделенный от атмосферы поршнем (см. рисунок). И при сжатии, и при расширении газа силы, действующие на поршень со стороны газа, совершают над ним работу А (в первом случае отрицательную, во втором положительную). При этом, поскольку поршень перемещается бесконечно медленно, силы, действующие на него со стороны газа и внешние силы практически равны друг другу как при сжатии, так и при расширении газа (в противном случае в балансе энергии необходимо было учитывать кинетическую энергию, приобретенную поршнем). Поэтому работа, совершенная газом и внешними силами над газом равны по величине, но отличаются знаком. Очевидно, работа газа положительна, если газ расширяется, и отрицательна, если газ сжимается. (В этой связи отметим, что в термодинамике иногда используются следующие обозначения: работа газа обозначается как А,работа внешних сил над газом - как  . Нам кажется, что лучше таких обозначений не использовать – всё равно забудешь, у какой работы надо ставить штрих. Необходимо понимать разницу между этими величинами, а при чтении условия задачи и при проведении термодинамических рассуждений отдавать себе отчет, о какой работе идёт речь). . Нам кажется, что лучше таких обозначений не использовать – всё равно забудешь, у какой работы надо ставить штрих. Необходимо понимать разницу между этими величинами, а при чтении условия задачи и при проведении термодинамических рассуждений отдавать себе отчет, о какой работе идёт речь).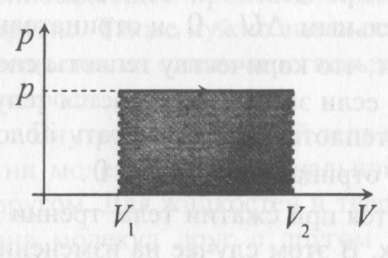 При решении задач на термодинамику следует помнить одно важное свойство работы газа, которое во многих случаях позволяет ее легко вычислить. При решении задач на термодинамику следует помнить одно важное свойство работы газа, которое во многих случаях позволяет ее легко вычислить. Работа газа в некотором процессе численно равна площади фигуры под графиком зависимости давления от объема в этом процессе. В частности в изобарическом процессе при давлении р, в котором объем газа изменился от значения V1 до значения V2, газ совершает работу (см. рисунок; площадь графика, соответствующая работе, выделена): А = p(V2-V1) = pΔV = νRΔT, (14.5) где ν - количество вещества газа, ΔT - изменение температуры в рассматриваемом процессе. Если газ участвует в процессе, в котором одновременно имеет место и теплообмен, и совершается работа, то справедливо соотношение Q = ΔU + A,(14.6) которое называется первым законом термодинамики (здесь А - работа газа). Закон (14.6) позволяет найти одну из входящих в него величин, если заданы две других. Если задается только одна из величин, входящих в закон (14.6), но как-то определяется процесс, происходящий с газом, то две остальные величины могут быть определены. Например, в |
