химия. Семинарские заняти по орган химии. Учебное пособие для студентов химических специальностей и направлений Сургут Издательство Сургу 2007
 Скачать 2.08 Mb. Скачать 2.08 Mb.
|
2. Основные задачиМногие электрофильные реагенты проявляют окислительные свойства в реакциях с ароматическими соединениями. Такое окисление протекает особенно легко для аренов, обладающих повышенной нуклеофильностью (приведите примеры таких соединений). Какие способы понижения нуклеофильности ароматического субстрата вам известны? Реакция толуола с DClв присутствии кислот Льюиса (например, AlCl3) приводит к дейтеротолуолу. Предложите схему механизма реакции и приведите доводы в пользу промежуточного образования σ -комплекса в этом превращении. Принято считать, что электрофильное замещение в ароматическом ряду проходит через следующие стадии: 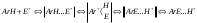 π –комплекс σ –комплекс π -комплекс Какие химические данные или физико-химические методы подтверждают такой взгляд на механизм реакций электрофильного замещения? Установлено, что при нитровании бензола, толуола, бромбензола, нитробензола и нафталина, в молекулах которых атомы водорода заменены на дейтерий, отношение скоростей реакций Кн/ Кр, как правило очень близко к 1. Какие выводы можно сделать о стадии, определяющей скорость реакций на основании приведенных данных? Приведите общую схему механизма взаимодействия бензола с электрофильным реагентом (Е+). Приведите график изменения потенциальной энергии рассматриваемой реакции и качественно охарактеризуйте степень ионности переходного состояния лимитирующей стадии. Опишите делокализацию положительного заряда в бензолониевых ионах приведенных ниже σ -комплексов методом резонанса. У каких атомов углерода по отношению к вошедшему в кольцо заместителю (орто-, мета- или пара) имеется наименьшая π -электронная плотность? а) 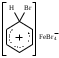 б) б)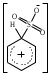 в) в)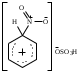 Опишите строение σ-комплексов методом резонанса (набором предельных структур). Объясните появление дополнительных предельных структур для σ-комплексов. Рассмотрите влияние заместителей на термодинамическую стабильность комплексов. В каждом ряду укажите наиболее устойчивый из них и сделайте вывод об ориентирующем характере заместителя и его влиянии на реакционную способность бензольного кольца к электрофильному замещению. а) 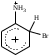 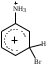  б) 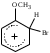 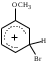  Приведенные ниже заместители отнесите к одной из групп: а) активирующие о-, п-ориентанты; б) дезактивирующие о-, п-ориентанты; в) дезактивирующие м-ориентанты: –OH, –F, –NO2, −O–, −Cl, –CH2Cl, 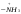 , –OCH3, –CF3, −SO3H, , –OCH3, –CF3, −SO3H,–СН = CH–NO2, –C ≡ N, –NH2, –NH–COCH3, –СНО. Объясните, почему нитрование толуола протекает с большей скоростью, чем нитрование бензола, а продукт реакции представляет собой смесь о-, м- и п- нитротолуолов, в которой преобладают о- и п - изомеры. При проведении нитрования в сульфолане как органическом растворителе толуол оказался в 17, а изопропилбензол в 14 раз активнее бензола. Соотношение изомеров о: м: п: для толуола составляет 62: 3: 35, а для изопропилбензола - соответственно 43: 5: 52. Рассчитайте факторы парциальных скоростей для каждого положения в толуоле и изопропилбензоле. Обсудите их значения. Сравните реакционную способность различных положений в каждой молекуле и объясните наблюдаемые различия. В какой последовательности увеличивается количество параизомеров в реакциях электрофильного замещения для соединений: этилбензол, толуол, изопропилбензол, трет. бутилбензол? Определите положения, по которым преимущественно будет проходить бромирование дизамещенных бензола: о−фторметоксибензол, м-бензолдикарбоновая кислота, п−N,N−диметилтолуол, п-нитрофенол, м-трифторметилтолуол. Отметьте соединения с согласованной ориентацией заместителей. Объясните, почему при хлорировании хлорбензола о- и п - изомеры образуются в соотношении 7:9, а при бромировании - 1:9? Объясните, почему хлорирование 2,6-диметилацетанилида протекает в 15 раз медленнее, чем хлорирование бензола, и образуется преимущественно 2,6 – диметил - 3 - хлорацетанилид? Предскажите строение продуктов алкилирования бензола: а) бутен-2-олом-1 в присутствии фосфорной кислоты; б) 2-метилбутеном-2 в присутствии серной кислоты; в) неопентилхлоридом в присутствии хлористого алюминия. При алкилировании толуола бромистым метилом, бромистым изопропилом и бромистым трет-бутилом в присутствии бромистого алюминия наряду с основными продуктами o- и п-диалкилбензолами получаются также м-изомеры в количествах 9.9; 17.6 и 32.7% соответственно. Как можно объяснить наблюдаемое увеличение выхода м-изомера? При ацилировании толуола хлорангидридом триметилуксусной кислоты в растворе сероуглерода в присутствии хлористого алюминия происходит побочная реакция декарбонилирования хлорангидрида и образования трет-бутилтолуола. Эта побочная реакция протекает тем заметнее, чем больше степень разбавления реакционной смеси. Объясните эта факты. Как должно сказываться на скорости реакции  введение в ядро бензилхлорида следующих заместителей: X = H, n - CH3, n - Cl, м - CH3, м - Cl, n - NO2? Какое значение имеет обратимость реакции сульфирования для синтеза α- и β-нафталинсульфокислот? При обработке сернокислого анилина олеумом образуется м-аминобензолсульфокислота. При нагревании той же соли (в сухом виде) до 100-180 °С происходит замещение в о- и п-положениях бензольного кольца. Чем объяснить различный результат? |
