Учебное пособие рекомендовано Управлением учебных заведений Министерства здравоохранения РФ в качестве учебного пособия для студентов фармацевтических институтов и фармацевтических факультетов медицинских вузов
 Скачать 2.86 Mb. Скачать 2.86 Mb.
|
|
| | |
| | ONa I |
| | н |
| | |
| | |
| но | -сн |
| | |
| | сн он |
=о + н2о
-
Количество натрия гидроксида эквивалентно сумме кислоты хлористоводородной и кислоты аскорбиновой. Далее для определения кислоты аскорбиновой полученный аскорбинат натрия титруют 0,1 н. раствором йода.
ONa он 9 9
но—сн снон
= 0 + I ► \ J^—O+ HI + Nal
2 ^O^
но—сн
сн2он
При титровании кислоты аскорбиновой 0,1 н. раствором йода значение величины «z» при расчете М (1/z) равно 2, а это означает, что на одну и ту же аликвотную долю смеси будет расходоваться 0,1 н. раствора йода в два раза больше, чем 0,1 н. раствора натрия гидроксида. Поэтому при расчете количества раствора, пошедшего на титрование кислоты хлористоводородной, из общего объема 0,1 н. раствора гидроксида натрия следует вычесть 'Лобъема 0,1 н. раствора йода, израсходованного на титрование кислоты аскорбиновой:
С
кислоты
хлористовод. (%)
(VNaOHkNaOH_ Г'V TNaOH/НСГ 100%
см. формулу 17
X = — кислоты аскорбиновой(г)
Т| 2 / к-та аскорб. 1 V пек. ф0рМЫ
Уаликв.
см. формулу 3
Содержание в лекарственных смесях веществ близких по химическому строению и свойствам (соли галогеноводородных кислот, сульфаниламиды и др.) затрудняет их раздельное определение общепринятыми титриметрическими методами. Как исключение в подобных случаях допускается применять средний ориентировочный титр (СОТ) для определения суммы веществ. СОТ - это масса смеси определяемых веществ в граммах, соответствующая 1 мл титранта. Его величина зависит от значений титриметрических факторов пересчета ингредиентов смеси и соотношения этих веществ в лекарственной смеси.
Существует несколько способов расчета СОТ:
> Упрощенный вариант:
СОТ
С/Т,
C2'V
сптп
(19)
где Ci, Сг ...Сп - концентрации веществ, входящих в лекарственную смесь; Т-1, Тг ... Тп - титриметрические факторы пересчета (титры по определяемому веществу) веществ.
> При более точных определениях, а также при расчете СОТ для лекарственных смесей по авторским прописям:
т« -т (С + С,)
СОТ = ——
с,т2 + с2т,
или
М,(—) ■ м ф.(с1+ с2)-с
СОТ = 1Л—!1 Н (21)
(% м2ф * с2- м,ф ) 10ОО
где См - концентрация титрованного раствора, используемого для титрования суммы ингредиентов.
> С учетом прописанной массы ингредиентов:
а - Т. + b • Т
СОТ = г— (22)
а + b
где Ti - титр по определяемому веществу первого ингредиента; Тг - титр по определяемому веществу второго ингредиента; а - прописанная масса первого ингредиента, в г; b - прописанная масса второго ингредиента, в г.
г- С учетом различных количеств ингредиентов:
а + b
СОТ = (23)
_а_ + _Ь_ т т
1 '2
обозначения - см. формулу (22)
(V,
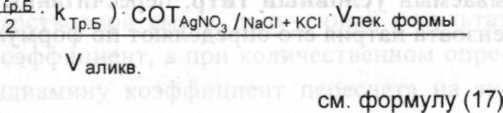
X =
NaCH-KCI(r)
AgN03 К AgN03"
V-
где Vagn03- объем 0,1 н. раствора серебра нитрата, пошедший на титрование суммы хлоридов натрия, калия и кальция; Vtp.s - объем трилона Б, пошедший на титрование кальция хлорида;
TAgN03/NaCi+Kci - средний ориентировочный титр (СОТ) при титровании натрия и калия хлоридов 0,1 н. раствором серебра нитрата.
Значение СОТ 0,1 н. раствора серебра нитрата для суммы натрия и калия хлоридов рассчитывают следующим образом:
0,9
0,005844
СОТ =
AgN03/NaCI + KCI
+
0,9 + 0,02
0,02
0,007456
= 0,005872 г/мл
Условный титр. Некоторые лекарственные вещества представляют собой комплексные соединения, состоящие из двух веществ (кофе-ин-бензоат натрия, эуфиллин, темисал и др.). Такие соединения в лекарственных смесях можно определять по входящим в них компонентам, содержание которых согласно требованиям ГФ и др. НД должно быть в строго определенных пределах.
Например, кофеин-бензоат натрия в экспресс-анализе чаще анализируют по бензоату натрия, которого в препарате должно быть 58 -62%. Если пользоваться титром 0,01441 г/мл, исходя из М.м. натрия бензоата (144,1 г/моль) и титрантом - 0,1 н. раствором кислоты хлороводородной, то в результате получим содержание натрия бензоата в лекарственной форме. Для пересчета на кофеин-бензоат натрия полученный результат нужно дополнительно поделить на фактическое содержание (массовую долю) натрия бензоата в кофеине-бензоате натрия.
Чтобы не делать громоздких расчетов, можно использовать так называемый условный титр, пересчитанный на препарат. Для кофеина-бензоата натрия его определяют по формуле:
0,01441 ■ 100%
"'условн. - а
коф.-бенз.натрия
где а - содержание натрия бензота в данном образце кофеина-бензоата натрия (в %); 0,01441 - масса натрия бензоата (в г), соответствующая 1 мл 0,1 н. раствора кислоты хлороводородной.
Величина Тусловн. может значительно колебаться. При содержании в кофеине-бензоате натрия 58% натрия бензоата Туслов„ = 0,02484, а при 62% Тусловн= 0,02324. Поэтому для определения Тусловн необходимо знать содержание натрия бензоата в препарате.
Если таких данных нет, расчеты следует вести по среднему пределу содержания данного компонента в препарате. Так, при титровании 0,1 н. раствором кислоты хлороводородной эуфиллина по этилендиа-мину (содержание которого в комплексе находится в пределах 14 -18%)
I условн. равен:
Тусловн. = 1 = 0,01878 г/мл
эуфилл. 16 %
где 0,003005 - масса этилендиамина (в г), соответствующая 1 мл 0,1 н. раствора кислоты хлороводородной.
Коэффициент пересчета. При анализе комплексных соединений, состоящих из двух веществ, чаще пользуются коэффициентом пересчета на определяемое вещество. Коэффициент пересчета - частное от деления массы (или 100%) всего комплексного соединения на массу (или массовую долю) определяемого вещества, являющегося компонентом комплекса. Например, если определять эуфиллин титрованием по тео-филлину (содержание в препарате составляет 80 - 85%), то коэффициент пересчета составит 1,212 (100 : 82,5). При расчете количественного содержания эуфиллина в лекарственной смеси полученный результат нужно умножить на данный коэффициент, а при количественном определении препарата по этилендиамину коэффициент пересчета на эуфиллин (при содержании этилендиамина 16%) составит 6,25 (100 : 16).
Предварительный расчет расхода титрованного раствора.
Предварительный расчет объема титрованного раствора (Х/те0рет), который должен быть затрачен на титрование массы (объема) лекарственной смеси, в экспересс-анализе имеет важное значение. Так, при составлении схемы анализа химик-аналитик должен четко представлять теоретические объем титранта, и если VTeopeT составляет менее 0,5 мл, а массу (объем) аликвотной доли увеличить нельзя, следует сделать разведение исходного титрованного раствора. Условия выполнения количественного определения ингредиентов лекарственной смеси необходимо подбирать сучетом того, чтобы VTeopeT. составлял не менее 1 мл (чтобы не увеличивать ошибку определения).
Значение VTe0peT. можно рассчитать по формуле:
V =
V = (25)
теорет. T
где m - содержание лекарственного вещества (в г) в 1 мл смеси. Предварительный расчет массы (объема) лекарственной смеси, необходимый для анализа.
В целях экономии титрованного раствора и для повышения точности анализа перед титрованием целесообразно рассчитывать предварительную массу (объем) лекарственной смеси (а), чтобы при титровании был израсходован определенный объем стандартного раствора (V):
а =
Обозначения - см. формулу (1)
В порошках (мазях, суппозиториях) вместо 100% подставляют величину общей массы порошка (мази, суппозиториев), а вместо С% - X в граммах (формула 4).
5.2. АНАЛИЗ СМЕСЕЙ ЛЕКАРСТВЕННЫХ ВЕЩЕСТВ БЕЗ РАЗДЕЛЕНИЯ КОМПОНЕНТОВ
Составление схемы количественного определения ингредиентов смеси.
При разработке схемы анализа смеси целесообразно привести все существующие методики количественного определения (фармакопейные и нефармакопейные) каждого ингредиента смеси в отдельности. В качестве примера составим схему количественного определения ингредиентов прописи 19.
ПРОПИСЬ 19 Калия йодида 4,0
Натрия гидрокарбоната 2,0 Воды очищенной 200,0 мл
| Калия йодид | Натрия гидрокарбонат |
| 1. Аргентометрия (метод Фаянса- | 1. Ацидиметрия, титрант - 0,1 н. |
| Ходакова), титрант - 0,1 н. рас- | раствор кислоты хлороводород- |
| твор серебра нитрата, индикатор - | ной, индикатор - метиловый |
| эозинат натрия. | оранжевый. |
| 2. Аргентометрия (метод Фольгар- | |
| да), титрант - 0,1 н. раствор ам- | |
| мония роданид, индикатор - желе- | |
| зоаммониевые квасцы. | |
| 3. Меркуриметрия, титрант - 0,1 н. | |
| раствор ртути (II) нитрата, инди- | |
| катор - дифенилкарбазон. | |
| 4. Йодатометрия, титрант - 0,1 н. | |
| раствор калия йодата | |
| 5. Броматометрия, титрант - 0,1 н. | |
| раствор калия бромата, индикатор | |
| - крахмал. | |
| 6. Перманганатометрия, титрант - | |
| 0,1 н. раствор калия перманганата. | |
Как видно из приведенной таблицы, для калия йодида и натрия гидрокарбоната нет общих методов количественного определения, поэтому для их анализа можно применить любой из указанных методов.
Схема анализа:
Определение калия йодида:
Аликвотная доля -» любой из указанных методов
Определение натрия гидрокарбоната:
Аликвотная доля -> ацидиметрия (титрант - 0,1 н. раствор раствор кислоты хлороводородной).
Предварительные расчеты:
1. Расчет V-георет. стандартного раствора, который пойдет на титрование 1 мл лекарственной смеси.
Предположим, что для определения калия йодида используют метод аргентометрии по Фаянсу - Ходакову:
AgNQ3 + KI = AgU + KN03
cnAgNo3' M Фк, 0,1 • 166,01
W,= —ш = —^0—= °'01660 г/мл
M(KI) = 166,01 г/моль ; z = 1 см. формулу (2)
Для определения VTe0peT. необходимо рассчитать массу калия йодида в 1 мл смеси. 4,0 г калия йодида содержится в 200 мл смеси, следовательно 1 мл смеси содержит 0,02 г препарата. Отсюда:
0,02
agn03asn03/K|
1,20 мл
те°Рет- Тд„мо 0,01660
см. формулу (25)
2. Расчет аликвотной доли смеси, необходимой для количественного определения калия йодида.
Поскольку \/теорет. 0,1 н. раствора серебра нитрата (необходимый для титрования 1 мл смеси) больше 1 мл, то оптимальный объем аликвотной доли смеси равен 1 мл.
Количественное определение натрия гидрокарбоната проводится методом ацидиметрии:
NaHC03 + НС1 = NaCI + C02t + Н20
С(-у)м(у) ...
-г не! NaHco, 0,1 ■ 84,1
