М.м. С9Н804 (кислота ацетилсалициловая) 180,16 г/моль 0,1 ■ 180,16
"ЧаОН/к-та ацетилсалиц.""
= 0,01802 г/мл см. формулу (2)
0,17
х/маОН(теоретич.) = = 9,51 мл см. формулу (25)
0,01802
- определить теоретический объем 0,1 н. раствора натрия гидроксида, эквивалентный количеству фенобарбитала:
0,05 г фенобарбитала содержится в 0,35 г порошка
у q 2 г у = 0,028 г фенобарбитала
-
м.м. с,2H12N203 (фенобарбитал) 232,24 0,1 232,24
ТМаОН/фенобарбитал =
= 0,02322 г/мл см. формулу (2)
0,028
v NaOH (теоретич.) = = 1,23 мл см. формулу (25)
0,02322
%
Теоретический расчет показывает, что на связывание кислоты ацетилсалициловой и фенобарбитала должно расходоваться 9,51 мл (на первое титрование) и 1,23 мл (на второе титрование) 0,1 н. раствора 80 u , 1 nK + — lq С
рм2 - I + 2 Р^а фенобарб. 2 а фенобабитал-Na
Для определения концентрации натриевой соли фенобарбитала необходимо сделать дополнительные расчеты:
- определить теоретический объем 0,1 н. раствора натрия гидроксида, эквивалентный количеству кислоты ацетилсалициловой:
0,3 г к-ты ацетилсалиц. содержится в 0,35 г порошка
х q2r х = 0,17 г к-ты ацетилсалиц.
М.м. С9Н804 (кислота ацетилсалициловая) 180,16 г/моль 0,1 ■ 180,16
ТМаОН/к-та ацетилсалиц. =
= 0,01802 г/мл см. формулу (2)
0,17
v NaOH (теоретич.) = = 9,51 мл см. формулу (25)
0,01802
- определить теоретический объем 0,1 н. раствора натрия гидроксида, эквивалентный количеству фенобарбитала:
0,05 г фенобарбитала содержится в 0,35 г порошка
у q 2 г у = 0,028 г фенобарбитала
-
М.м. C,2H12N203 (фенобарбитал) 232,24 0,1 ■ 232,24
ТЫаОН/фенобарбитал = ^ = 0,02322 г/мл см. формулу (2)
0,028
v NaOH (теоретич ) = = 1,23 мл см. формулу (25)
0,02322
Теоретический расчет показывает, что на связывание кислоты ацетилсалициловой и фенобарбитала должно расходоваться 9,51 мл (на первое титрование) и 1,23 мл (на второе титрование) 0,1 н. раствора
РН2 - I + 2 Р^а фенобарб. 2 а фенобабитал-Na
Для определения концентрации натриевой соли фенобарбитала необходимо сделать дополнительные расчеты:
- определить теоретический объем 0,1 н. раствора натрия гидроксида, эквивалентный количеству кислоты ацетилсалициловой:
0,3 г к-ты ацетилсалиц. содержится в 0,35 г порошка
х Q2r х = 0,17 г к-ты ацетилсалиц.
М.м. С9Н804 (кислота ацетилсалициловая) 180,16 г/моль 0,1 ■ 180,16
ТМаОН/к-та ацетилсалиц. =
= 0,01802 г/мл см. формулу (2)
0,17
V NaOH (теоретич.) = = 9,51 мл см. формулу (25)
0,01802
- определить теоретический объем 0,1 н. раствора натрия гидроксида, эквивалентный количеству фенобарбитала:
0,05 г фенобарбитала содержится в 0,35 г порошка
-
М.м. C,2H12N203 (фенобарбитал) 232,24
q 2 г у = 0,028 г фенобарбитала 0,1 ■ 232,24TNaOH/фенобарбитал = ^ = 0,02322 г/мл см. формулу (2)0,028V NaOH (теоретич.) = = 1,23 мл см. формулу (25)0,02322%Теоретический расчет показывает, что на связывание кислоты ацетилсалициловой и фенобарбитала должно расходоваться 9,51 мл (на первое титрование) и 1,23 мл (на второе титрование) 0,1 н. раствора 80 u , 1 „К +J_|q Cрм2 - I+ 2 Н^а фенобарб. 2 а фенобабитал-Na Для определения концентрации натриевой соли фенобарбитала необходимо сделать дополнительные расчеты: - определить теоретический объем 0,1 н. раствора натрия гидроксида, эквивалентный количеству кислоты ацетилсалициловой: 0,3 г к-ты ацетилсалиц. содержится в 0,35 г порошках Q2r х = 0,17 г к-ты ацетилсалиц.М.м. С 9Н 804 (кислота ацетилсалициловая) 180,16 г/моль 0,1 ■ 180,16ТМаОН/к-та ацетилсалиц. = = 0,01802 г/мл см. формулу (2)0,17V NaOH (теоретич.) = = 9,51 мл см. формулу (25)0,01802- определить теоретический объем 0,1 н. раствора натрия гидроксида, эквивалентный количеству фенобарбитала: 0,05 г фенобарбитала содержится в 0,35 г порошкаУ q 2 г у = 0,028 г фенобарбитала- М.м. C, 2H, 2N 20 3 (фенобарбитал) 232,24 0,1 ■ 232,24ТNaOH/фенобарбитал = ^ = 0,02322 г/мл см. формулу (2)0,028V NaOH Iтеоретич ) = = 1,23 мл см. формулу (25)0,02322Теоретический расчет показывает, что на связывание кислоты ацетилсалициловой и фенобарбитала должно расходоваться 9,51 мл (на первое титрование) и 1,23 мл (на второе титрование) 0,1 н. раствора m 0,028 П (фенобарбитал) = = = 0,00012 моль QjHjNA М 232,24 п (фенобарбитал-натрий) = п (фенобарбитал) = 0,00012 моль „ п 0,00012 С = = = 0,00581 моль/л (фенобарбитал- V 0,02074 натрий) отсюда: рН 2 = 7 + \ ■ 7,43 + — lg 0,00581 = 9,597 Этой величине рН соответствует индикатор тимолфталеин (интервал изменения окраски 9,3 - 10,5). Методика. Кислота ацетилсалициловая. 0,2 г порошка растворяют в 10 мл 95% спирта, прибавляют 5-6 капель раствора метилового красного и титруют 0,1 н. раствором натрия гидроксида до желтого окрашивания. 1 мл 0,1 н. раствора натрия гидроксида соответствует 0,018016 г С 9Н 804 (кислоты ацетилсалициловой). V • к ■ Т ■ п 3 е; 1 NaOH 1NaOH NaOH/к-та ацетилсалиц. х = кислота 0 2 j. ,л\ацетилсалициловая СМ- Ф°РМУЛУ (4) (г/ 1 порошок) где Vi - объем 0,1 н. раствора натрия гидроксида, пошедший на титрование кислоты ацетилсалициловой по индикатору метиловому красному. m 0,028 п (фенобарбитал) = = = 0,00012 моль Q 2H 2NA М 232,24 п (фенобарбитал-натрий) - п (фенобарбитал) - 0,00012 моль „ п 0,00012 С - = = 0,00581 моль/л (фенобарбитал- V 0,02074 натрий)отсюда: рН 2 = 7 + у ■ 7,43 + у lg 0,00581 = 9,597 Этой величине рН соответствует индикатор тимолфталеин (интервал изменения окраски 9,3 - 10,5). Методика. Кислота ацетилсалициловая. 0,2 г порошка растворяют в 10 мл 95% спирта, прибавляют 5-6 капель раствора метилового красного и титруют 0,1 н. раствором натрия гидроксида до желтого окрашивания. 1 мл 0,1 н. раствора натрия гидроксида соответствует 0,018016 г С 9Н 80 4 (кислоты ацетилсалициловой). V • к • Т ■ л зч 1naoh 1naoh naoh/к-та ацетилсалиц. UiOJ х = кислота 0 2 _и ,а\ацетилсалициловая СМ- Ф °рму>"у (4) (г/1 порошок)где Vi - объем 0,1 н. раствора натрия гидроксида, пошедший на титрование кислоты ацетилсалициловой по индикатору метиловому красному.
V,
X = фенобарбитал (г/1 порошок)
2 naoh
0,2
naoh naoh/фенобарбитал ' 0,35
см. формулу (4)
где V 2 - объем 0,1 н. раствора натрия гидроксида, пошедший на титрование фенобарбитала по тимолфталеину. Определение смесей основанийОрганические основания, применяющиеся в медицине, представляют собой слабые основания. При титровании слабых оснований растворами сильных минеральных кислот образуются гидролизующиеся соли, рН растворов которых меньше 7. Выбор индикатора для фиксирования конечной точки титрования определяется значением рН раствора соли, образующейся при титровании. При расчете рН следует учесть, что для оснований приводят значение рК ь, которое связано с рК а соотношением: 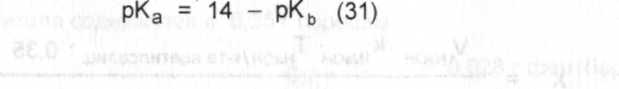 Рассмотрим титрование смеси лекарственных веществ, обладающих основными свойствами, на примере прописи 28, содержащей кодеин и амидопирин. ПРОПИСЬ 28 Кодеина 0,015Амидопирина 0,25Кодеин как более сильное основание (рК ь = 6,05) титруется стандартным раствором кислоты первым (см. рис.^[): Значение рН в первой точке эквивалентности рассчитывают по формуле 30 с учетом соотношения по формуле 31: (14 - pK bl) + (И - pK b2) pK bi+ pK b2
рН, = - = 14 - -- см. формулы (30,31) где рКы- значение рКь кодеина, равное 6,05; рК Ь2 - значение рК ь амидопирина, равное 9,0
рН,
14
6,05 + 9,0
6,47
Этой величине рН соответствует область изменения окраски индикатора бромтимолового синего (6,0 - 7,6).
Для определения второй точки эквивалентности (при титровании амидопирина) необходимо рассчитать рН раствора образующегося гидрохлорида амидопирина по реакции (см. рис. 1):
н,с ,
Н N
/
н,с
-сн,
н,с
н,с
N
I
-сн,
-N— СН,
+ HCI
^\ СН,
а
о 1
Определение значения рН проводят на основе методики: 0,05 г по рошка растворяют в 1 мл спирта, добавляют 5 мл воды и титруют ко деин 0,01 н., а амидопирин - 0,1 н. раствором кислоты хлороводород ной. рН раствора гидрохлорида амидопирина вычисляют по формуле 28:РН2 = 7 - — Р^ьамидоприн-hci 2 ^ амидоприн hciДля определения концентрации гидрохлорида амидопирина необ ходимо сделать дополнительные расчеты: - определить теоретический объем 0,01 н. раствора кислоты хлоро водородной, эквивалентный количеству кодеина: 0,015 г кодеина содержится в 0,265 г порошках 0 05 г х = °'0028 г кодеинаM.m.C ieH2,N03■ Н20 (кодеин) 317,39 0,01 317,39Тнс1/ко Де„н - — = 0,003173 г/мл см. формулу (2)0,0028Vi hci (теоретич.) - - 0,88 мл0,003173- определить теоретический объем 0,1 н. раствора кислоты хлороводородной, эквивалентный количеству амидопирина: 0,25 г амидопирина содержится в 0,265 г порошкау 0,05 г У = 0,04716 г амидопиринаМ.м. С ,3Н17 М30(амидопирин) 231,300,01 ■ 231,30ТнС1 /амидоприн - = 0,02313 г/мл см. формулу (2)1UUU щ0,04716V. hci (теоретич.) - Q2313 2'04 МЛТеоретический расчет показывает, что на титрование кодеина и амидопирина должно быть израсходовано 0,88 мл 0,01н. раствора кислоты хлороводородной и 2,04 мл 0,1 н. раствора кислоты хлороводородной. Общий объем раствора после титрования составит 8,92 мл (0,88 + 2,04 + 1,0 + 5,0). Отсюда молярную концентрацию гидрохлорида амидопирина можно вычислить следующим образом: m 0,04716 п = = = 0,000204 моль (амидопирин) М 231 3 n = п = 0,000204 моль (амидопирин-HCI) (амидопирин) п 0,000204С (ouannminuu • нгп _ 0,0228 моль/л (амидопирин ни) v 0,00892 отсюда: рН 2 = 7 - у ■ 9,0 - у- lg 0,0228 = 3,321 Значение рН в точке эквивалентности при титровании амидопирина попадает в интервал перехода окраски индикатора бромфенолового синего (рН 3,0 - 4,6). Методика. Кодеин. 0,05 г порошка растворяют в 1 мл спирта, прибавляют 1 - 2 капли раствора бромфенолового синего, 5 мл воды до ясного синего окрашивания и титруют 0,01н. раствором кислоты хлороводородной до появления желтого с зеленоватым оттенком окрашивания. 1 мл 0,01н. раствора кислоты хлороводородной соответствует 0,003174 г C 18H 21N0 3 • Н 20 (кодеина). V, нс1 ■ к, нс1 ■ Тнс/кодеин > 0,265 кодеин 0,05 , ... (г /1 порошок) см. формулу (4) Амидопирин. К оттитрованной жидкости прибавляют 3-4 капли раствора бромфенолового синего до фиолетового окрашивания раство- 1 Несмотря на то, что отношение константы ионизации кислоты бен- зойной (К а = 6,35 • 10" 5) к константе ионизации кислоты угольной (К а = г 4,2 • 10" 7) меньше чем 10 4, ступенчатое титрование данной смеси, тем не менее, возможно, благодаря тому, что кислота угольная удаляется из смеси в процессе титрования, разлагаясь с выделением С0 2. Значение рН в первой точке эквивалентности составляет: 6,35 + 4,20 рН, = = 5,27 Поэтому при определении натрия гидрокарбоната используют в качестве индикатора метиловый красный (интервал перехода окраски при рН 4,2 - 6,3; см. рис. 1). Для определения значения рН раствора кислоты бензойной, соответствующей второй точке эквивалентности, необходимо рассчитать теоретический расход титранта (объем аликвотной части микстуры - 5 мл): • •• н " • ' . . i 1 ' > • 4,0 г натрия бензоата содержится в 200,0 мл микстуры х г : 5,0 мл х = 0,1 г натрия бензоата М.м. С 7Н 5Ма0 2(натрия бензоат) 144,11 0,1 ■ 144,11 0,01441 г/мл на/натрия бензоат 1000 см. формулу (2) V °'1 „ -. hci (теоретич) = = 6,94 мл0,01441 см. формулу (25) pa и титруют 0,1 н. раствором кислоты хлороводородной до появления золотисто-желтого окрашивания. 1 мл 0,1 н. раствора кислоты хлороводородной соответствует 0,02313 г C| 3H| 7N 20 (амидопирина). |
 Скачать 2.86 Mb.
Скачать 2.86 Mb.