Натрия гидрокарбоната 0,3
Так как содержание фосфат-иона в данной смеси незначительно, его открывают по реакции образования «бензидиновой сини».
При взаимодействии аммония молибдата с каким - либо фосфатом образуется аммония фосфоромолибдат, обладающий более высоким окислительным потенциалом, чем аммония молибдат, вследствие чего происходит окисление бензидина (сам аммония молибдат бензидин не окисляет). Синее окрашивание связано с появлением продуктов окисления бензидина («бензидиновая синь») и восстановления молибдена («молибденовая синь»).
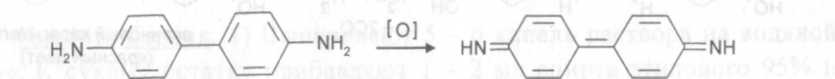
бензидин "бензидиновая синь"
При достаточном содержании фосфат-иона можно провести реакцию с серебра нитратом.
Подлинность. Натрий-ион. См. пропись 1.
Гидрокарбонат-ион и кодеин. К 0,01 г порошка прибавляют 2-3 капли реактива Марки; выделяются пузырьки газа (гидрокарбонат-ион) и появляется сине-фиолетовое окрашивание (кодеин).
Фосфат-ион. На фильтровальную бумагу наносят по одной капле растворов лекарственной смеси, аммония молибдата, бензидина и насыщенного раствора натрия ацетата. Появляется синее окрашивание.
Пропись 5 является примером смеси, где находится лекарственное вещество, содержащее фенольный гидроксил (натрия салицилат) и соединение, образующее при кислотном гидролизе формальдегид (гекса-метилентетрамин). Такое сочетание позволяет открыть оба вещества одним реактивом (серная кислота концентрированная) по реакции образования ауринового красителя.
ПРОПИСЬ 5 Гексаметилентетрамина Натрия салицилата по 2 Воды очищенной 100 мл
• Подлинность. Натрий-ион. См. пропись 1
Гексаметилентерамин и натрия салицилат. 2-3 капли микстуры выпаривают досуха, прибавляют 3-4 капли кислоты серной концентрированной и слегка нагревают; появляется малиново-красное окрашивание:
(CH2)6N4 + 2 H2S04 + 6 Н20 = 2 (NH4)2S04 + 6 CH20
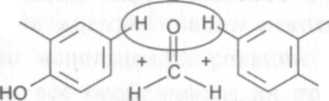 ноос соон конц H 2S0 4ОН -н20;-н2 -2со,
г. Если в прописи одновременно содержатся лекарственные вещества из групп ароматических аминов и фенолов, то возможно их определение по реакции образования азокрасителя.ПРОПИСЬ 6 Новокаина 0,05 Резорцина 0,1 Кислоты борной 0,2 Воды для инъекций до 10 млПодлинность. Новокаин и резорцин. К 5 каплям раствора прибавляют по 2 - 3 капли кислоты хлороводородной разведенной и 1% раствора натрия нитрита, а затем 10 капель раствора натрия гидроксида. Появляется вишнево-красное окрашивание:
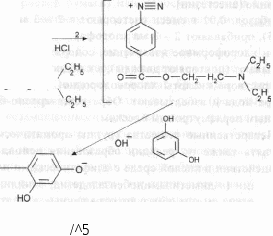

NaNO
HCI
0 = C О—CH,— H,C—N
N = N
0 = C О — CH,— H,C — N
\
азокраситель вишнево-красного цвета С^Н^
Кислота борная. 1) Выпаривают 5-6 капель раствора на водяной бане. К сухому остатку прибавляют 1 - 2 мл спирта этилового 95% и поджигают. Спиртовой раствор горит пламенем с зеленой каймой.
2) К 2 - 5 каплям раствора прибавляют 1-2 капли раствора фенолфталеина и 4 - 6 капель 0,1 М раствора натрия гидроксида. Появляется ярко-розовое окрашивание, исчезающее после добавления 0,5 - 1 мл глицерина.
Хлорид-ион. См. пропись 1
Проводя реакцию с натрия нитритом, одновременно с первичными ароматическими аминами можно открыть также анальгин (быстро исчезающее сине-фиолетовое окрашивание) и антипирин (зеленое окрашивание).
ПРОПИСЬ 7 Дибазола 0,03 Анальгина Анестезина по 0,3
Подлинность. Анальгин и анестезин. К 0,01 г смеси прибавляют по 0,5 мл воды, раствора кислоты хлороводородной разведенной и 2 - 3 капли 1% раствора натрия нитрита. Появляется быстро исчезающее синее окрашивание (анальгин). Затем 0,1 мл полученной смеси вливают в
1 мл щелочного раствора р-нафтола. Появляется красно-оранжевое окрашивание (анестезин).
Дибазол. 0,01 г смеси растворяют в 2 - 3 мл буферного раствора (рН 6,5), прибавляют 2 - 3 мл хлороформа, взбалтывают в течение 2 -3 мин и хлороформное извлечение, содержащее анестезин и анальгин, отбрасывают (повторяют дважды), а к водному остатку добавляют 2-3 капли раствора кислоты хлороводородной разведенной, 3-5 капель раствора йода и взбалтывают. Образуется красно-бурый осадок с характерным перламутровым блеском.
/ Лекарственные вещества группы ароматических аминов можно определять также по реакции образования оснований Шиффа. При взаимодействии в кислой среде с алифатическими или ароматическими альдегидами (и-диметиламинобензальдегид, ванилин и др.) первичные ароматические амины образуют окрашенные в желтый цвет основания Шиффа (азометины):
r с^^-С^ r_но- r c=n r
н2н
основание Шиффа
Ингредиенты прописи 8 иллюстрируют этот пример.
ПРОПИСЬ 8 Стрептоцида
Гексаметилентетрамина по 0,25
Подлинность. Стрептоцид и гексаметилентетрамин. К 0,01 г смеси прибавляют 2-3 капли раствора кислоты серной разведенной и нагревают. Появляется желто-оранжевое окрашивание. J)
В прописи 9 новокаин взаимодействует с альдегидными группами углеводов, составляющих лигнин бумаги. При этом также образуется окрашенное основание Шиффа.
ПРОПИСЬ 9 Раствор новокаина 2%
Состав: Новокаина 2
Раствора кислоты хлороводородной
разведенной 0,9 мл
Воды для инъекций до 100 мл
Подлинность. Новокаин. 2-3 капли раствора помещают на бумажную капсулу (из простой бумаги) или полоску газетной бумаги и прибавляют 1-2 капли раствора кислоты хлороводородной разведенной. Появляется пятно желто-оранжевого цвета.
Кислота хлороводородная. К 1 мл раствора прибавляют 1 каплю раствора метилового красного. Раствор окрашивается в красный цвет. """"^"Некоторые лекарственные смеси содержат бромиды и вещества ароматического ряда, содержащие заместители I рода (фенолы, ароматические амины) с незамещенными орто- или пара- положениями. В подобных случаях невозможно проводить идентификацию бромид-иона по реакции окисления их до свободного брома, окрашивающего хлороформный слой в желто-бурый цвет, так как идет бромирование ароматического ядра и бром в хлороформном слое практически не обнаруживается. Бромид ион в таких смесях следует открывать по реакции образования бурого осадка меди (I) бромида в присутствии кислоты серной концентрированной.
4 NaBr + 2 CuS04 = Cu2Br2 i+ Br2 + 2 Na2S04
ПРОПИСЬ 10 Кофеина-бензоата натрия Гексаметилентетрамина Натрия салицилата по 1 Натрия бромида 0,5 Воды очищенной до 100 мл
Подлинность. Натрий-ион. См. пропись 1
Бромид-ион. К 2 каплям раствора прибавляют 1 каплю раствора меди (II) сульфата и 3 - 4 капли кислоты серной концентрированной. Появляется бурый осадок.
Гексаметилентетрамин и натрия салицилат. См. пропись 5
Салицилат-ион и бензоат-ион. См. прппис.ь 11
Пропись 11 иллюстрирует пример обнаружения лекарственных веществ с использованием различной растворимости продуктов реакции в воде и органических растворителях.
Для обнаружения анионов кислот используют реакцию образования медных солей, которые отличаются по цвету и растворимости в различных растворителях.
ПРОПИСЬ 11 Натрия салицилата Натрия бензоата по 2 Воды очищенной 100 мл
Подлинность. Натрий-ион, См. пропись 1
Салицилат-ион и бензоат-ион. В пробирку вносят 1 - 2 мл смеси, прибавляют 3-4 капли раствора меди (II) сульфата, 1 мл хлороформа или эфира и встряхивают. Водный слой окрашивается в зеленый цвет (салицилат-ион), а слой органического растворителя - в голубой (бензоат-ион).
Салицилат- и бензоат-ионы при совместном присутствии можно определить и на импрегнированной фильтровальной бумаге. На фильтровальную бумагу наносят каплю раствора железа (III) хлорида, после чего в центр полученного пятна помещают каплю анализируемой смеси. Образуется пятно розовато-желтого цвета (бензоат-ион), окаймленное кольцом фиолетового цвета (салицилат-ион).
Также на принципе различной растворимости комплексных соединений с меди (II) сульфатом в различных растворителях основано обнаружение эфедрина и эуфиллина в смеси.
ПРОПИСЬ 12 Димедрола 0,005
f Эфедрина гидрохлорида 0,002
\ I Эуфиллина 0,005
Глюкозы 0,1
■
Подлинность. Эфедрин и теофиллин. 0,05 г порошка растворяют в 1 мл воды при нагревании, охлаждают, прибавляют 0,5 мл 0,1 М раствора натрия гидроксида, 2 мл 0,01 М (0,25%) раствора меди (II) сульфата, 2 мл хлороформа и встряхивают. После разделения слоев наблюдают зеленоватое окрашивание хлороформного слоя (эфедрин и теофиллин) и фиолетовое окрашивание водного слоя (этилендиамин).
">V"'c-,
сн
Си
НС
2 +
(ОН ),
I
NH2 H2N Си
СН2 СН,
SO.
\
н.с
комплекс эфедрина с Си (экстрагируется в эфир и хлороформ)
NH, HjN
комплекс этилендиамина с Си
Димедрол. К 0,01 г порошка прибавляют 5-6 капель кислоты серной концентрированной. Появляется ярко-желтое окрашивание, переходящее в кирпично-красное (оксониевая соль димедрола), исчезающее при добавлении нескольких капель воды (разрушение оксониевой соли). Глюкоза. К 0,02 г порошка прибавляют по 1 мл воды, реактива Фе-линга и нагревают до кипения. Образуется кирпично-красный осадок. Для определения хлоридов в присутствии бромидов возможно использование различной растворимости их серебряных солей в растворе аммиака. ПРОПИСЬ 13 Натрия хлоридаНатрия бромида по 3 Воды очищенной 200 мл■ Подлинность. Натрий-ион. См. пропись 1 Хлорид- и бромид-ионы. К 1 - 2 каплям раствора прибавляют 1 - 2 капли раствора серебра нитрата. Образуется бело-желтый осадок (хлорид- и бромид-ионы). Затем добавляют 1 - 2 капли раствора аммиака и осадок отфильтровывают (в осадке - серебра бромид). К прозрачному фильтрату добавляют 2-3 капли раствора кислоты азотной .разведенной; образуется белый осадок серебра хлорида. Обнаружение лекарственных веществ возможно и с использованием их различий в окислительных или восстановительных свойствах. ПРОПИСЬ 14 Кальция хлорида 5 Калия йодида Калия бромида по 2 Воды очищенной до 100 млДля обнаружения хлоридов, бромидов и йодидов при совместном присутствии целесообразно использовать их способность окисляться до свободных галогенов. Чтобы определить каждый из перечисленных галогенидов, реакцию необходимо проводить поэтапно, поскольку у них разные величины окислительно-восстановительных потенциалов (Е 0 С12/2СГ=1,359 V; Е° Вг 2/2Вг"= 1,087 V; Е° 1 2/2Г= 0,536 V). В качестве окислителя используют калия перманганат (строго определенное количество), который в среде кислоты серной в первую очередь вступает в реакцию с йодидом (наиболее сильным восстановителем среди галогенидов) и окисляет его до свободного йода, окрашивающего хлороформный слой в красно-фиолетовый цвет: 10 KI + 2 КМп0 4 + 8 H 2S0 4 = 5 1 2 + 2 MnS0 4 + 6 K 2S0 4 + 8 Н 20 При дальнейшем прибавлении калия перманганата идет более глубокое окисление йода до бесцветного йодат-иона: h+2KM11O4 + 3 H 2S0 4 = 2 HIO3 + K 2S0 4 + 2 MnS0 4 + 2 Н 20 Затем в реакцию вступает бромид-ион, и вследствие образования молекулярного брома хлороформный слой окрашивается в желто-бурый цвет: 10 КВг + 2 КМп0 4 + 8 H 2S0 4 = 5 Вг 2 + 2 MnS0 4 + 6 K 2S0 4 + 8 Н 20 После полного окисления бромидов избыток калия перманганата разрушают прибавлением по каплям раствора водорода пероксида: 2 КМп0 4 + 5 Н 20 2 + 3 H2SO4 = 2 MnS0 4 + K 2S0 4 + 8 Н 20 + 5 0 2Хлорид-ион, как самый слабый восстановитель в ряду анализируемых галогенидов, в данных условиях не взаимодействует (или не полностью взаимодействует) с калия пермаганатом и может быть обнаружен в водном слое по реакции с серебра нитратом. Подлинность. Хлорид-, бромид- и йодид- ионы. К 2 каплям раствора прибавляют по 10 капель воды и кислоты серной разведенной, 1 каплю 0,1% раствора калия перманганата и встряхивают. Хлороформный слой окрашивается в фиолетовый цвет (йодиды). Затем продолжают прибавлять раствор калия перманганата (при встряхивании) до перехода фиолетового окрашивания хлороформного слоя в желто-бурое (бромиды). После окрашивания водного слоя в устойчивый розовый цвет его сливают в другую пробирку и прибавляют к нему 10 капель хлороформа. Последний не должен окрашиваться. Если же хлороформный слой окрашивается в желтый цвет, добавляют по каплям раствор калия перманганата. После полного окисления бромидов избыток калия перманганата разрушают прибавлением по каплям раствора водорода перок-сида и далее прибавляют 2 капли раствора серебра нитрата. Образуется белый творожистый осадок (хлориды), растворимый при добавлении раствора аммиака. Сочетание глюкозы и кислоты аскорбиновой относится к часто встречающимся прописям в экстемпоральной рецептуре. Однако обнаружение глюкозы в присутствии аскорбиновой кислоты затруднительно, так как оба вещества проявляют восстановительные свойства. Кислота аскорбиновая является более сильным восстановителем, чем глюкоза, поэтому обнаружение последней возможно только после полного окисления кислоты аскорбиновой в мягких условиях. Кислоту аскорбиновую окисляют раствором водорода пероксида в присутствии раствора аммиака при нагревании, а затем проводят обнаружение глюкозы с реактивом Фелинга или аммиачным раствором серебра нитрата. ПРОПИСЬ 15 Кислоты аскорбиновой 0,1 Глюкозы 0,5Подлинность. Кислота аскорбиновая. 0,05 - 0,1 г смеси растворяют в 1 - 2 мл воды, прибавляют 1 - 2 капли аммиачного раствора серебра нитрата. Выпадает темный осадок:
но он
hJ
2 AgNO
nh.
+ 2Agi + 3hn03
ho—сн
но —сн
сн он
2 снрн
Глюкоза. 0,05 - 0,1 г смеси растворяют в 1 - 2 мл воды, прибавляют по 2 - 3 капли пергидроля и раствора аммиака и кипятят 2-3 мин. После охлаждения добавляют 1 мл реактива Фелинга и снова нагревают. Образуется кирпично-красный осадок:
5. КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ ЛЕКАРСТВЕННЫХ ВЕЩЕСТВ В СМЕСЯХ В экспресс-анализе для количественного определения ингредиентов смесей применяются титриметрические и физико-химические методы. Из титриметрических, методов для указанных целей применяется большинство известных способов титрования (см. таблицу 1). Из физико-химических методов наиболее часто используется рефрактометрия, реже - спектрофотометрия в УФ- и видимой областях. Несмотря на большое разнообразие в химическом строении лекарственных веществ, многие соединения, имеющие одинаковые функциональные группы или элементы структуры, можно определить одними и теми же методами. При количественном анализе нужно не только выбрать наиболее точный и удобный метод, исходя из индивидуальных свойств анализируемого вещества, но и учесть вид лекарственной формы, установить, позволят ли сопутствующие ингредиенты обеспечить необходимую точность, учесть реакцию среды, наличие электролитов, веществ, анализируемых аналогично, и т.д. Поэтому знание альтернативных вариантов определения различными титриметрическими методами, особенностей взаимодействия индикаторов, титрованных растворов при анализе смесей приобретает особое значение. 5.1 Расчеты при анализе титриметрическими методами При анализе многокомпонентных лекарственных форм используют различные варианты титрования: прямое, обратное, заместительное, с контрольным опытом и др. (см. табл. 1). Способы расчета концентраций определяемого ингредиента зависят от вида лекарственной формы, величин эквивалентов (особенно при определении по разности) и т.д. Для самостоятельного составления схемы количественного анализа, а также в целях обеспечения точности определения и экономного расходования реактивов провизору-аналитику необходимо уметь производить предварительные расчеты массы (объема) лекарственной формы, необходимой для анализа, величины разведения, среднего ориентировочного титра, коэффициентов пересчета, теоретического объема титранта, оценивать результаты анализа и делать выводы. |
 Скачать 2.86 Mb.
Скачать 2.86 Mb.