УЧЕБНИК Детская анестезиология и реаниматология. Михельсон В.А., Гребенников В.А. 2001. УЧЕБНИК Детская анестезиология и реаниматология. Михельсон В.А. В. А. Михельсон В. А. Гребенников оглавление предисловие к 1 изданию 5 Часть первая. Общие вопросы детской анестезиологии и реаниматологии 6 Глава краткий исторический очерк
 Скачать 3.14 Mb. Скачать 3.14 Mb.
|
|
Глава 16. ИНТЕНСИВНАЯ ТЕРАПИЯ НАРУШЕНИЙ КИСЛОТНО-ОСНОВНОГО СОСТОЯНИЯ Общие принципы. Буферная система является одной из саморегулирующихся систем организма, поддерживающая постоянство внутренней среды. Под кислотно-основным состоянием (КОС) понимают определенное соотношение между водородными (Н+) и гидроксильными (ОН) ионами крови. Следует отметить, что водород находится в крови в виде Н3О+, а не в форме свободного иона Н+. Внутриклеточная концентрация Н+ в 4 раза выше внеклеточной. Для своей защиты организм использует различные механизмы выделения накапливающихся кислых продуктов жизнедеятельности. В основном это взаимодействие буферных систем, удаление СО2 при дыхании и кислых продуктов почками. Обычно саморегулирующие буферные системы поддерживают почти постоянную внеклеточную концентрацию ионов водорода. Концентрацию водородных ионов отражает показатель рН крови, колеблющийся в пределах 7,35 – 7,45. Границы изменений рН совместимые с жизнью 6.8 - 7.8. У здоровых людей в покое значения рН артериальной и капиллярной крови совпадают. Сдвиг рН крови в обе стороны более чем на 0,4 несовместим с жизнью, поэтому для оценки состояния больного и правильного выбора методов интенсивной терапии важны сведения о показателях определяющих КОС. рН - это отрицательный десятичный логарифм концентрации ионов водорода; ВВ – (буферные основания), отражает все 4 системы буферов крови (ммоль/л): карбонатный,.фосфатный, белки крови, гемоглобин и оксигемоглобин. ВЕ – (избыток/дефицит оснований) - это избыток нелетучих кислот в изучаемой пробе крови (ммоль/л); SВ – (стандартный бикарбонат) - это концентрация гидрокарбоната в плазме изучаемой пробы крови при стандартных условиях (ммоль/л); АВ – (актуальная концентрация бикарбонатов) - соответствует концентрации бикарбонатов в крови при действительных значениях рН, рС02 и SaO2 (ммоль/л); рСО2 - парциальное давление углекислого газа (мм рт. ст.); р02 - парциальное давление кислорода (мм рт.ст.). Главной буферной системой крови является гемоглобиновая (Hb-HbO2), составляющая 35-75% буферной емкости. Гемоглобиновая буферная система функционирует как в клеточном, так и во внеклеточном пространствах. Во внеклеточном пространстве основной буферной системой является бикарбонатная (H2CO3/NaHCO3), на долю которой приходится 13-15% буферной емкости. Буферная система крови при поступлении или накоплении в организме кислых продуктов реагирует заменой сильной кислоты на слабую, что приводит к уменьшению числа свободных ионов водорода. В клетках основными буферными системами являются белковая (NH2-R-COOH=NH3-R-COO-+H+) - 7-10% буферной емкости и фосфатная (NaH2PO4/NaHPO4), составляющая от 1 до 5% буферной емкости. Необходимо отметить, что при всей мощности буферных систем крови в стрессовых ситуациях они не могут поддерживать КОС на нормальном уровне, так как обладают только одной пятой частью общей буферной емкости организма. Кроме буферной системы крови, в коррекции КОС участвуют легкие, почки, печень, желудочно-кишечный тракт. рН крови поддерживается в очень узком интервале благодаря буферным системам крови, изменениям вентиляции и почечным компенсаторным механизмам. Ежедневно дети потребляют с пищей 1-2 мэкв/кг кислотных остатков: сульфатов – из аминокислот, фосфатов - из фосфопротеинов, нитратов. Кроме того, в результате неполного окисления жиров и углеводов образуются органические кислоты (например, молочная). Химические буферные системы крови и легкие обеспечивают быструю защиту от повышения рН, а почки осуществляют долговременное поддержание кислотно-основного баланса. При изменении рН на 0,1 концентрация ионов Н+ меняется лишь на 10 нэкв/л. В норме в процессе альвеолярной вентиляции выделяется значительное количество СО2, (тысячи ммоль/л ежедневно), таким образом предотвращается накопление слабой кислоты Н2СО3, образующейся при растворении СО2, в плазме. Почки регулируют содержание НСО3, за счет реабсорбции НСО3, из ультрафильтрата и образования НСО3, при общей канальцевой секреции кислот. Общая канальцевая секреция кислот слагается из выделения титруемых кислот и ионов аммония. Образование НСО3, возмещает потери НСО3, обусловленные эндогенной продукцией кислот. Кислотно-основной баланс оценивают, измеряя рН крови и уровень бикарбоната плазмы либо уровни бикарбоната, СО2 плазмы и способность плазмы связывать СО2. Разница между способностью плазмы связывать СО2 и уровнем СО2 плазмы составляет 1-2 ммоль/л. Для диагностики нарушений КОС желательно исследовать артериальную кровь. При нарушении периферического кровообращения, местном повреждении тканей или стазе крови исследование венозной крови может дать неточные результаты. В клинической практике пользуются показателями карбонатной системы, так как они проще определяются лабораторными методами и отражают динамику изменений всех буферных систем.
Нарушения кислотно-основного баланса в зависимости от значений рН разделяют на ацидоз (уменьшение рН) и алкалоз (увеличение рН). Эти нарушения принято делить на респираторные и метаболические, острые и хронические, простые и смешанные, компенсированные и некомпенсированные (Рис.16.1). При респираторных нарушениях первичный сдвиг рН обусловлен изменением РаСО2, а при метаболических - смещением уровня НСО3 . Отношение между этими величинами определяется уравнением Гендерсона – Гассельбальха: рН = рК + lg НСО3 /Н2СО3 = 6.1 + lg НСО3 /0.03 х раСО2 , где рК – отрицательный десятичный логарифм константы диссоциации для бикарбонатного буфера. Нормальное соотношение основание/кислота (НСО3 /Н2СО3 ) равно 20:1. Рис. 16.1. Характеристика нарушений кислотно-основного состояния. 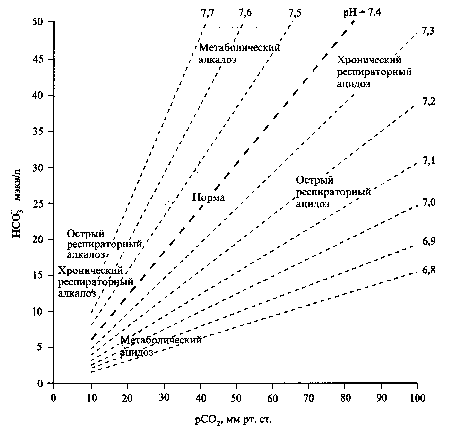 Если соотношение сохранено, то рН находится в пределах 7,40. Изменение соотношения в сторону увеличения или уменьшения ведет к развитию алкалоза или ацидоза. При повышении раСО2, увеличивается знаменатель дроби, и рН снижается – возникает респираторный ацидоз. И наоборот, при снижении РаСО2, знаменатель уменьшается, и рН возрастает – возникает респираторный алкалоз. Аналогично, накопление НСО3, вызывает метаболический алкалоз, а снижение уровня НСО3 метаболический ацидоз. Первичное изменение рН запускает компенсаторные механизмы, которые сдвигают рН в сторону нормы, но обычно не полностью. В результате кислотно-основные нарушения становятся компенсированными. Ацидоз и алкалоз могут иметь две формы: 1) метаболическую – уменьшение (ацидоз) или увеличение (алкалоз) НСО3-, 2) дыхательную (респираторную) – повышение (ацидоз) или снижение (алкалоз) рСО2. Поскольку величина рН зависит от соотношения НСО3-/рСО2, ацидоз может возникать при уменьшении содержания НСО3- или повышении рСО2, а алкалоз – при увеличении содержания НСО3- или снижении рСО2. Организм очень чувствителен к изменению рН и старается удержать этот показатель на относительно нормальном уровне, используя все компенсаторные возможности. Так, при снижении содержания НСО3- удержать показатель рН без существенных сдвигов можно, лишь уменьшив рСО2, и наоборот. Метаболический ацидоз - нарушение метаболизма, приводящее к некомпенсированному или частично компенсированному падению рН крови (ацидемия). При этом всегда отмечается дефицит оснований. Концентрация гидрокарбоната в плазме падает. Метаболический ацидоз развивается при снижении содержания НСО3- , что уменьшает соотношение НСО3-/рСО2 и ведет к снижению рН. Основные причины метаболического ацидоза:
При накоплении в организме большого количества недоокисленных продуктов обмена и органических кислот включаются компенсаторные механизмы. Сильная кислота при реакции с бикарбонатом переходит в слабую угольную кислоту. Угольная кислота возбуждает дыхательный центр, а продукты ее диссоциации удаляются через легкие (рСО2) и почки (Н2О). Израсходованный бикарбонат восполняется путем соответствующих реакций в эритроцитах и почках. Почки усиленно выводят Н+. В отсутствие патологических изменений в почках общая экскреция Н+ и синтез НСО3- могут увеличиться в 10 раз. Большинство авторов считают, что метаболический ацидоз должен обязательно сопровождаться так называемым анионным провалом, или анионным несоответствием. Суть его заключается в том, что в норме в плазме существует равновесие между катионами (Na+, К+, Мg2+, Са2+) и анионами (Сl-, НСО3- , белки, остаточные анионы). При истощении бикарбонатных буферных оснований их место занимают органические кислоты и создается несоответствие между концентрацией Na+ и суммой НСО3- и Сl- . Величину "анионного несоответствия" можно определить по формуле: Анионное несоответствие = Na+ пл. – (Сl- пл. + НСО3- ). В норме "анионный интервал" составляет 124 ммоль/л. Все виды метаболического ацидоза, за исключением солянокислого, сопровождаются увеличением "анионного интервала", так как для нейтрализации кислых продуктов используются буферные системы крови. Патофизиологические реакции при метаболическом ацидозе выражаются в:
Клинически метаболический ацидоз проявляется следующими симптомами:
Диагностика метаболического ацидоза основывается на данных анамнеза, клинической картине, резко кислой реакции мочи, показателях КОС: рН <7,35, ВЕ < – 2,5, АВ <19, ВВ <40, SВ <20. Наиболее распространен метаболический ацидоз, развивающийся вследствие накопления в организме кислых продуктов обмена. При накоплении молочной кислоты (лактата) возникает лактат-ацидоз. Уровень молочной кислоты при этом возрастает (свыше 2-4 ммоль/л). Различают лактат-ацидоз типа А (классический) и типа В. Лактат-ацидоз типа А, развивающийся у больных со сниженной перфузией тканей и выраженной гипоксией, чаще у больных с сердечной недостаточностью, гиповолемией, при развитии сепсиса, шока и др. Лактат-ацидоз типа В отмечается у больных с выраженными метаболическими нарушениями (диабет, инфекционные заболевания, почечно-печеночная недостаточность, почечная потеря бикарбонатов – почечный тубулярный ацидоз 2-го типа, терапия диакарбом, желудочно-кишечные потери бикарбонатов, энтеростомия, синдром короткой кишки, ацидоз разведения, почечный тубулярный ацидоз 1 типа, синдром Фанкони, а также при назначении хлорида кальция, аммония хлорида и др.). Развитие ацидоза этого типа наблюдается при диаррее новорожденных и грудных детей, наследственных аномалиях обмена веществ с органической ацидемией и лактат-ацидозом, при назначении индометацина, салицилатов, отравления некоторых видах отравлений (салицилаты, этиленгликоль, метанол, антифриз, паральдегид и др.). Интенсивная терапия метаболического ацидоза. Выделяют два типа метаболического ацидоза: «Дельта – ацидоз» - с повышенной анионной разностью (более 15 ммоль/л) и «Не дельта – ацидоз» – отсутствие анионной разницы (менее 15 ммоль/л). Показания для введения гидрокарбоната натрия: 1.рН ниже 7.25 у детей с «Не дельта – ацидозом»; 2.Смешанный ацидоз не компенсируемый ИВЛ; 3.Остановка дыхания более 20 сек. или состояние после остановки сердца; Гидрокарбоната натрия вводится из расчета 1-2 ммоль/кг со скоростью 1 ммоль/кг/ мин (в 1 мл 4% раствора гидрокарбоната натрия содержится 0,5 ммоль). Стандартная формула расчета натрия гидрокарбоната для полной коррекции ацидоза: Количество 4.2%раствора NaНСОз (ммоль/л) = ВЕ Мт 0.3, Где: Мт - масса тела ; 0.3 – коэффициент(для недоношенных детей – 0,5; для новорожденных и детей первых 6 мес. – 0,4) При использовании гидрокарбоната натрия следует помнить, что в результате его взаимодействия с кислотами крови увеличивается образование угольной кислоты, а для ее удаления необходима достаточная вентиляция легких. При передозировке существует опасность развития метаболического алкалоза. У больных с хронической почечной недостаточностью может углубиться исходная гипокальциемия за счет более активного связывания Са2+ белками, что нередко приводит к развитию судорог. Введение натрия может вызвать гиперосмолярное состояние с развитием симптомов сердечно-сосудистой недостаточности, судорог и отека мозга. Противопоказания и применению гидрокарбоната натрия: гиповентиляция, склонность к отекам, отек легких, сердечная недостаточность, гипертония, эклампсия. Трисамин - используется при необходимости корригировать ацидоз у детей с гиперкапнией (РаС02 выше 60 мм.рт.ст) или гипернатриемией (Nа+ выше 152 ммоль/л). Основное показание к применению трисамина - ацидоз с задержкой натрия. Используется 0.3 М раствор трисамина (3.63 %). Формула расчета: Общее количество трисамина (мл) = (ВЕ - 5 ) Мт 1.1; (У детей старше 7 суток от значения ВЕ не вычитать коэффициент равный 5). Скорость введения 1 мл/кг/мин. Противопоказания: почечная недостаточность, гипогликемия, олигурия, гиперкалиемия. При использовании трисамина необходимо иметь в виду, что он: 1)Обладает способностью проникать в клетку и корригировать внутриклеточный метаболический ацидоз; 2) Способствует выведению СО2 почками, и его можно применять при дыхательном ацидозе; 3) Снижает содержание глюкозы и кальция в плазме. Кроме того, при введении трисамина клетки теряют К+, а в плазме уровень его возрастает. Трисамин оказывает выраженное диуретическое действие. Он выделяется почками, и его можно использовать только при сохраненной их функции. Отсутствие натрия в трисамине позволяет отдавать ему предпочтение у больных с гипернатриемией. При применении растворов лактасола и Рингера- лактата следует учитывать, что они метаболизируются в печени с образованием гликогена, в связи с чем введение их противопоказано при нарушении функций печени. Инфузия лактасола сопровождается лактацидемией, поэтому при состояниях, сопровождающихся тканевой гипоксией (сердечно-сосудистая недостаточность, шок и др.) его использование ограничивают. Показания к коррекции метаболического ацидоза с помощью бикарбонатных буферов в последние годы пересмотрены. Рекомендуется коррекцию метаболического ацидоза осуществлять только при критических показателях рН и не доводить ее до нормальных величин, так как метаболические процессы адаптированы к низким цифрам рН и быстрая ее нормализация может привести к срыву процессов компенсации. Важно учитывать, что метаболический ацидоз в начальном периоде развития - это компенсаторная реакция организма на патологический процесс, направленная на сохранение оптимальной оксигенации тканей. Шаблонный подход к коррекции КОС может привести к нарушениям осмолярности, электролитного обмена, тканевого дыхания. В настоящее время ведутся исследования с целью обоснования так называемой стресс-нормы, т.е. тех минимальных значений КОС, при которых необходимо начинать коррекцию ацидоза буферными растворами. По мнению большинства авторов, для рН она находится в диапазоне 7,15 – 7,20, но может быть и ниже этих цифр. Для коррекции метаболического ацидоза применяют методы направленные на нормализацию микроциркуляции, устранение гиповолемии, улучшение реологических свойств крови, оптимальную оксигенацию. Необходимо помнить, что при выраженном метаболическом ацидозе действие многих фармакологических препаратов не проявляется или сильно извращено. Респираторный ацидоз обусловлен накоплением СО2, ведущим к повышению уровня Н2СО3. Повышение рСО2 происходит при снижении легочной вентиляции. В норме увеличение рСО2 стимулирует легочную вентиляцию, направленную на устранение гиперкапнии. В острой фазе респираторного ацидоза буферные и почечные механизмы компенсации не включаются, и по мере возрастания рСО2 выше 50 мм рт. ст. рН быстро падает. Если гиперкапния сохраняется, то усиливается общая канальцевая секреция кислот (в основном за счет ионов аммония), возрастает канальцевая реабсорбция бикарбоната и снижается реабсорбция хлорида. В результате повышается концентрация бикарбоната плазмы. При выраженной гиперкапнии она может превышать 40 мэкв/л. При повышении РаСО2 на 1 мм рт. ст. концентрация бикарбоната плазмы возрастает примерно на 0,3 мэкв/л. У новорожденных почечные механизмы компенсации незрелые, поэтому дыхательные нарушения у них сопровождаются выраженным ацидозом. Причинами дыхательного ацидоза могут быть:
Компенсаторные реакции организма при этом протекают следующим образом. Повышается выработка бикарбоната натрия в эритроцитах и клетках почечных канальцев. При этом концентрация его в плазме возрастает на 1 ммоль/л при увеличении рСО2 на 10 мм рт.ст. Почечный механизм компенсации включается позже эритроцитарного. Более быстро осуществляется переход НbО2 в Нb. Кривая диссоциации оксигемоглобина смещается вправо и облегчается отщепление кислорода. Внутриклеточный К+ замещается внеклеточным Н+, усиливается выведение Н+ и хлоридов почками. Клинические проявления дыхательного ацидоза характеризуются снижением объема вентиляции, нарушением ритма дыхания, увеличением ударного объема сердца, расширением периферических сосудов и снижением периферического сосудистого сопротивления. Кожные покровы и слизистые оболочки гиперемированы, АД повышено или не изменено, увеличено пульсовое давление, пульс учащен. Из-за расширения мозговых сосудов повышается внутричерепное давление, появляются признаки отека мозга. Диагностика дыхательного ацидоза основывается на данных клинической картины и показателях КОС (рН менее 7.35, рСО2 выше 46 мм рт.ст.). Выявляются дефицит оснований и кислая реакция мочи. Интенсивная терапия. Прежде всего, необходимо определить, не является ли дыхательный ацидоз компенсаторной реакцией на метаболические нарушения. Если это подтвердилось, то следует проводить лечение основного заболевания. Одновременно применяют меры по улучшению параметров вентиляции (стимуляция дыхательного центра - налоксон, налорфин), а при показаниях – вспомогательная вентиляция или ИВЛ. При интенсивной терапии необходимо учитывать, что в некоторых ситуациях целесообразно поддерживать умеренную гиперкапнию для улучшения оксигенации тканей (например, у больных бронхиальной астмой). Важно помнить, что быстрое выведение СО2 может вызвать изменения рН цереброспинальной жидкости, артериальную гипотензию, периферический спазм сосудов, судороги. Метаболический алкалоз - это нарушение обмена веществ, которое не компенсируется или частично компенсируется повышением рН крови (алкалемия), имеется избыток оснований и концентрация гидрокарбоната плазмы превышает норму. При метаболическом алкалозе обычно имеется потеря анионов кислоты (как правило потери ионов хлора (менее 90 ммоль/л), но может быть и гипопротеинемия (менее 35 г/л у новорожденных) и повышение плазменной концентрации бикарбоната ( в норме - 20 - 25 ммоль/л). Возникает при повышении соотношения НСО3-/рСО2 за счет увеличения НСО3- . Метаболический алкалоз развивается при:
Компенсация метаболического алкалоза происходит за счет угнетения дыхания и увеличения рСО2 (10 ммоль/л НСО3- сверх нормы повышают рСО2 на 6 мм рт.ст.) и за счет усиленного выведения НСО3- с мочой. Патофизиологические изменения при метаболическом алкалозе характеризуются:
Клинически метаболический алкалоз проявляется гиповолемией, гипокалиемией, полиурией, полидипсией, мышечной слабостью, иногда развитием судорог (связывание Са2+ белками). Диагностика метаболического алкалоза основывается на оценке клинических данных, показателей КОС (рН >7,46, рСО2 >46 мм рт.ст., ВЕ > – 2,5 ммоль/л, АВ >25 ммоль/л) и водно-электролитного баланса (гипокалиемия, гипохлоремия). Интенсивная терапия. Метаболический алкалоз встречаетсяреже ацидоза, но более трудно поддается коррекции. Он всегда сопровождается выраженными электролитными нарушениями, которые в свою очередь вызывают угнетение функции миокарда, гипотонию,мышечную слабость, иногда судороги. Метаболический алкалоз во внеклеточном пространстве часто сопровождается внутриклеточным ацидозом, крайне трудно поддающимся коррекции. Обычно коррекцию начинают с нормализации уровня калия плазмы. Растворы калия хлорида (0,5-1 %) вводят медленноодновременно с глюкозо-инсулиновыми смесями. При декомпенсированных формах метаболического алкалоза у взрослых применяют растворы соляной кислоты (100 мл 4 % НСl на 1000 мл 5 % раствора глюкозы) и 0,9 % раствор хлористого аммония. За сутки можно вводить не более 250-300 ммоль Н+. Метаболический алкалоз делится на:
В некоторых случаях следует выделять два вида метаболического алкалоза - солезависимый и соленезависимый. Причинами солезависимого метаболического алкалоза чаще всего являются большие потери желудочного содержимого (со рвотой, через зонд), избыточное введение натрия гидрокарбоната, длительное применение диуретических средств. Он протекает с уменьшением объема внеклеточной жидкости, гипокалиемией и снижением выведения почками НСО3- . Введение солевых растворов в данной ситуации, увеличивая объем внеклеточной жидкости, активизирует диурез и экскрецию бикарбоната почками. Желательно проводить коррекцию содержания натрия для увеличения объема внеклеточной жидкости и Cl- для устранения дефицита хлоридов. При большом дефиците калия (К+ плазмы меньше 2 ммоль/л) наблюдается снижение чувствительности к инфузии солевых растворов. Этот фактор может быть временным, и после коррекции уровня калия, чувствительность к солевым растворам восстанавливается. Соленезависимый метаболический алкалоз является результатом избытка в организме минералокортикоидов (альдостерон) и дефицита калия. При этом виде метаболического алкалоза объем внеклеточной жидкости увеличен, реабсорбция натрия в почках снижена. Коррекцию проводят инфузией калия, введением антагонистов альдостерона (верошпирон). Метаболический алкалоз, развившийся у больных с сердечной недостаточностью, хронической почечно-печеночной недостаточностью, при лечении диуретиками также сопровождается увеличением объема внеклеточной жидкости, отеками. Лечение рекомендуется проводить введением диакарба как ингибитора карбоангидразы (увеличивается выведение Nа+, НСО3-, К+ почками). Введение солевых растворов противопоказано. Респираторный алкалоз у детей встречается довольно редко. Гипервентиляция при отсутствии заболеваний легких возможна на фоне ИВЛ, истерии и чувства тревоги, на ранней стадии отравления салицилатами, при состояниях, сопровождающихся усилением обмена веществ. Быстрая коррекция метаболического ацидоза может вызвать респираторный алкалоз. Дело в том, что рН спиномозговой жидкости возвращается к норме позже, чем рН внеклеточной жидкости, продолжая стимулировать дыхательный центр продолговатого мозга. Возможно развитие дыхательного алкалоза при активизации дыхательного центра (травма и опухоли ЦНС, гипертермия). Острый респираторный алкалоз может вызвать судороги и головокружение. В случае психогенного респираторного алкалоза преобладает общее возбуждение. Компенсация происходит за счет уменьшения диссоциации оксигемоглобина, усиления функции почек с удалением избытка бикарбоната, снижения реабсорбции и образования НСО3- в эритроцитах и клетках почечных канальцев, развития метаболического ацидоза. При дыхательном алкалозе снижается почти на треть мозговой кровоток, а при снижении рСО2 ниже 21 мм рт. ст. развивается спазм сосудов головного мозга. При респираторном алкалозе снижается уровень кальция в крови, что нередко приводит к развитию судорожного синдрома; развивается внутриклеточный алкалоз в результате перемещения ионов калия и натрия из внеклеточного пространства в клетку для замещения Н+. При диагностике дыхательного алкалоза основываются на данных клинического обследования и показателях КОС (рН >7,46, рCО2 <34 мм рт.ст.). Интенсивная терапия. Прежде всего, необходимо убедиться в том, что дыхательный алкалоз не является компенсаторной реакцией в ответ на метаболические нарушения. Если это подтверждается, то интенсивная терапия должна быть направлена на коррекцию метаболического ацидоза. ИВЛ проводят под контролем параметров вентиляции и газового состава крови (дыхательный мониторинг), позволяющим избежать развития респираторного алкалоза; рСО2 в артериальной крови следует поддерживать в пределах 33-36 мм рт.ст. Для устранения гипервозбудимости дыхательного центра целесообразно использование седативных средств и опиатов, а для коррекции гипертермии - жаропонижающих средств и физического охлаждения. Для устранения повышенной механической работы дыхания решается вопрос об использовании управляемой ИВЛ. Глава 17. ИНТЕНСИВНАЯ ТЕРАПИЯ ОСТРОЙ ПОЧЕЧНОЙ НЕДОСТАТОЧНОСТИ Развитие острой почечной недостаточности (ОПН) может сопровождать различные заболевания. Она может выявляться неожиданно для пациента и врача, который должен уметь провести дифференциальную диагностику и знать принципы современной консервативной и оперативной терапии. Образование и выведение мочи – процесс не настолько простой, как это может показаться на первый взгляд. Почечный эпителий стоит на втором месте после клеток ЦНС по ранимости под влиянием гипоксии и нарушения кровотока. Для нормального функционирования почечной ткани необходимо не менее 8 мл/мин/100 г ткани кислорода и 25 % сердечного выброса. Мочевыделительная система принимает участие в регуляции многих функций организма:
Макроскопическая ткань почки подразделяется на корковое вещество, основную часть которого составляют клубочки, и мозговое вещество, основу которого составляют почечные канальцы. Необходимо отметить, что у новорожденные соотношение толщины коркового и мозгового слоев 1:4, а у взрослых людей (начиная с пубертатного периода) – 1:2. В клубочковых канальцах происходит фильтрация первичной мочи (фильтруется безбелковая часть плазмы, 75% миоглобина и 3% свободного гемоглобина). Экзогенное введение вазопрессоров резко снижает величину фильтрации. Подобный же эффект оказывает и использование индометацина, являющегося ингибитором простагландинов. Отрицательно на уровень фильтрации влияет и повышение иптерстициального (внутрикапсульного) давления, которое имеет место при развитии отека в ткани почки, обтурации просвета мочевыводящих путей. Как видно из всего вышеперечисленного процесс фильтрации в почечных клубочках является пассивным, поэтому эндотельальные клетки данного региона относительно примитивны (ее имеют сложной структуры и высокого уровня метаболизма), вследствие этого их функция, а, значит, и функция клубочков при адекватном лечении должна восстанавливаться первой (по сравнению с функцией почечных канальцев). Суммарная длина всех почечных канальцев у взрослого человека приблизительно составляет 120 км. В зависимости от расстояния от коркового слоя все канальцы делятся на проксимальные и дистальные. Главной функцией проксимальных канальцев является реабсорбция всех веществ, попавших в первичную мочу, но необходимых для организма. Здесь реабсорбируются из фильтрата 99% воды, натрий, хлор, ионы бикарбоната, глюкоза, аминокислоты, 93% К+, 45% мочевины. Необходимо помнить о том, что новорожденные дети реабсорбируют натрий гораздо интенсивнее, чем взрослые, что обуславливает склонность к отекам у данного контингента больных, а также наличие у них гипоосмолярной мочи даже на фоне сниженного диуреза. Секреция является одной из основных функций дистальных канальцев. В просвет канальцев из окружающих тканей секретируются органические чужеродные вещества и медикаменты, ионы водорода, кислые соли сильных кислот, ионы аммония, К+. Необходимо отметить, что и реабсорбция и секреция – процессы активные, протекающие с большим потреблением энергии, поэтому и эпителий почечных канальцев высокоорганизован, что обуславливает медленное восстановление его функции даже на фоне адекватного лечения. Особый интерес представляет собой проблема кровотока в почке. Его развитие и стабилизация в человеческом организме совпадает по времени с концом периода полового созревания. В ткани почки одновременно функционируют:
Регуляция всех трех типов кровотока происходит в основном на местном уровне. Сложность строения гемодинамического аппарата почки объясняет, почему самым частым повреждающим фактором для этого органа является ишемия. Острая почечная недостаточность – неспецифический синдром, развивающийся в результате транзиторной или необратимой утраты гомеостатических функций почек, обусловленной в большинстве случаев гипоксией почечной ткани с последующим преимущественным повреждением канальцев и отеком интерстициальной ткани. Наиболее частыми причинами развития ОПН являются:
Особенностью течения синдрома ОПН является его цикличность с возможностью полного восстановления функций почек. Необходимо отметить, что этиологические особенности проявляются только в самой начальной стадии. Этапное течение острой почечной недостаточности: 1 стадия – преданурическая или стадия функциональных нарушений. На этом этапе течения ОПН на первое место выходит сиптоматика основного заболевания, сопровождающаяся снижением диуреза до величины, не превышающей 25-33% от нормальной или даже до анурии. 2 стадия – олиганурии, развивающаяся в результате прогрессирования следующих патофизиологических процессов:
Именно на этой стадии начинают появляться и получают дальнейшее развитие признаки, характерные для почечной недостаточности. К ним в первую очередь относятся олиго- и анурия, которые, естественно сопровождаются синдромом гипергидратации. Увеличение объема жидкости сопровождается нарастанием массы тела. Одновременно с накоплением внутрисосудистой жидкости в сосудистом русле происходит снижение ее осмолярности, и вода начинает выходить в интерстициальное пространство и накапливаться в тканях. При этом увеличивается нагрузка на сердце, развиваются симптомы сердечной недостаточности, появляются отеки, жидкость накапливается в полостях. Появляются самые разнообразные изменения в клинических анализах мочи. В крови нарастает уровень мочевины (не только из-за снижения ее выведения почками, но и в результате катаболизма) и креатитнина. Снижается концентрация белка. В результате несоответствия между скоростью поступления в кровоток ионов калия и их выведением развивается гиперкалиемия. Клинически гиперкалиемия проявляется, главным образом, брадикардией, изменениями на ЭКГ, пароксизмальными аритмиями и может закончиться остановкой сердца. Отмечается резкая мышечная слабость, боли в животе. Необходимо отметить, что у большинства больных с ОПН, как следствие уремии, развивается полисерозит и соответственно, рвотно-диарейный синдром. Как правило, у подобных пациентов на фоне массивной рвоты и профузной диареи концентрация калия в плазме крови бывает не только не повышена, но и снижена. Ацидоз, одной из главных причин которого, является гиперкалиемия (повышение уровня К+ на 0,5 ммоль/л в плазме крови способствует снижению pH на 0,1) – непременный спутник ОПН. Его развитию способствуют также прекращение синтеза Н+ в почечных клубочках и высокий уровень катаболизма. Гипокальциемия, гипохлоремия и гипонатриемия сопровождают данную патологию.Выходящий в большом количестве из клеток в сосудистое русло магний обуславливает сонливость, присущую пациентам с ОПН. Быстро развивается анемия, вызванная снижением синтеза эритропоэтина, гипопротеинемией, нарушением утилизации железа в кишечнике и уменьшением продолжительности жизни самих эритроцитов. В клинических анализах крови обращают на себя внимание нейтрофильный лейкоцитоз со сдвигом влево, лимфоцитопения, моноцитопения, эозинофилопения, повышение СОЭ. Все случаи ОПН сопровождаются синдромом диссеминированного внутрисосудистого свертывания, в основном на стадии гиперкоагуляции и фибринолиза. Артериальная гипертензия при острой почечной недостаточности встречается всего лишь в 10-15% случаев. С другой стороны, артериальная гипотония – практически постоянный признак ОПН, обусловленной экстраренальными причинами. Необходимо отметить, что стойкое снижение артериального давления может свидетельствовать о возникновении у пациента сепсиса, который может развиваться очень медленно - много часов и даже суток. Поражения легких и плевры при ОПН носят разнообразный характер. Наиболее часто имеет место тахипноэ, с помощью которой организм больного пытается компенсировать развивающийся метаболический ацидоз. Проявлением уремического полисерозита выступает плеврит, иногда продуктивный, который определяется при аускультации наличием шума трения плевры или, при скоплении выпота в плевральной полости, глухостью дыхательных шумов. При тяжелой уремии часто можно видеть на рентгеновском снимке значительное усиление сосудистого рисунка в виде характерной «бабочки»; при этом над легкими выслушивается жесткое дыхание с множественными разнокалиберными влажными хрипами. Развитие плеврита обычно происходит параллельно с появлением перикардита, который раньше называли «похоронным звоном» для пациента с уремией. Морфологически в полости перикарда имеется картина асептического воспаления с массивными отложениями фибрина. Клинически при фибринозном перикардите имеется скудная симптоматика, редко встречается болевой синдром, выслушивается нарастающий (иногда за часы) пансистолический шум трения обычно над всей поверхностью сердца, иногда проводящийся на заднюю поверхность грудной клетки. Продолжительность олигоанурической стадии от нескольких дней до 1 месяца (крайне редко – дольше), в среднем ее продолжительность составляет 12-14 дней. 3 стадия - полиурическая. Она характеризуется нарастанием диуреза, что свидетельствует о восстановлении функции эпителия почечных клубочков, но не канальцев. В начале анурия сменяется олигурией, затем в течение 2-5 дней диурез нарастает настолько, что может достигать 10-12 литров в сутки (признак того, что ребсорбция еще «не работает»). Быстрого улучшения состояния больного, равно как и его самочувствия, нет. Несколько уменьшаются признаки интоксикации, выраженность ДВС-синдрома, но еще долго сохраняются анемия, астенический синдром. На этот период приходится 37% всех летальных исходов от ОПН (80% из них – от вторичной инфекции). У всех больных имеется инфекция мочевых путей. В этой стадии наиболее опасной является гипокалиемия, обусловленная полиурией. Полиурическая стадия продолжается от нескольких дней до нескольких месяцев. 4 стадия - выздоровление. Характеризуется исчезновением клинических признаков почечной недостаточности, анемии, ДВС-синдрома. Однако, как правило долго наблюдается картина хронической инфекции мочевыводящих путей. Терапия ОПН. Лечение преданурической стадии должно быть направлено на восстановление ОЦК, снятие периферического вазоспазма, устранение гипоксии. Больному должна быть налажена ингаляция обогащенной кислородом смеси. Инфузионная терапия проводится по следующей схеме: первоначально инфузируется объем жидкости, равный 2% от массы тела больного. В ее состав как правило включают полиионный солевой раствор и 10% раствор глюкозы с инсулином. При условии, что на подобную водную нагрузку диурез получен не был, то необходимо стимулировать его образование внутривенным введением лазикса в дозе 1 мг/кг (суточная доза может достигать 5-10 мг/кг). Необходимо отметить, что лазикс не только салуретик, он также улучшает микроциркуляцию в паренхиме почек. В дальнейшем продолжают инфузию, избегая применения растворов, содержащих К+. Хороший эффект дает инфузия малых доз допамина (2-5 мкг/кг/мин). С дезагрегационой целью показано использование гепарина в суточной дозе 90-100 ед/кг (под контролем коагулограммы или времени свертываемости крови по Ли-Уайту). Возможно однократное переливание свежезамороженной плазмы в объеме 10 мл/кг. Во время проводимого лечения необходим тщательный мониторинг за параметрами гемодинамики (в том числе и ЦВД), дыхания, скоростью выделения мочи. Желательно не реже, чем 4 раза в сутки производить забор крови для определения концентраций электролитов, азотистых шлаков, белка. При развитии стойкой анурии продолжают парентеральное ввденение лазикса (до 10 мг/кг/сут) в сочетании с инфузией донамина. Объем жидкости вводимой за сутки определяется суммированием перспирационных потерь, текущих патологических потерь и объема мочи, выделенной за предыдущие сутки. В состав инфузионной терапии входят концентрированные (15-30%) растворы глюкозы с инсулином, 0,9% раствор NaCl и свежезамороженная плазма. Анемию корригируют трансфузией взвеси отмытых эритроцитов. Уровень гиперкалиемии снижают введением 10% раствора глюконата кальция по 30 мг/кг, а также гидрокарбоната натрия в стандартных дозировках. Причем, необходимо помнить, что сода окажет желаемый эффект только при условии, что образующиеся молекулы СО2 будут эффективно удаляться через легкие (контроль газов крови). Под контролем показателей свертывающей системы крови продолжают применение гепарина. Очень часто пациентам во 2 стадии ОПН приходится назначать антибиотики для профилактики и лечения вторичной инфекции, при этом надо помнить, что сульфаниламиды, нитрофураны и тетрациклины подобным больным противопоказаны. Питание детей с ОПН является чрезвычайно важной проблемой, так как у них преобладает катаболизм. Восстановления почек требует адекватного поступления калорий для усиления энергетического метаболизма. Отмечено, что внутривенное введение эссенциальных аминокислот и глюкозы приводит к положительному азотистому балансу, улучшению репарации, поддержанию веса, снижению уровня мочевины и смягчению уремических симптомов. При анурии, продолжающейся на фоне лечения более суток необходимо начинать проведение операции по очищению крови, вне зависимости от показателей креатинина, мочевины, калия. Могут быть использованы гемодиализ, артериовенозная гемофильтрация, гемодиафильтрация, перитонеальный диализ. Показаниями к экстренному диализу являются:
Следовательно, в настоящее время решение о начале диализа не зависит от лабораторных критериев, таких как мочевина или креатинин плазмы, а больше опирается на общее состояние больных с учетом клинического течения ОПН. Главным в лечении полиурической стадии ОПН является поддержание баланса воды и электролитов (для чего нужен тщательный мониторинг ВЭБ) и постепенное увеличение пероральной белковой нагрузки. | ||||||||||||||||||||
