химия Вайс 2. В. Ф. ВойноЯсенецкого Министерства здравоохранения России Кафедра биохимии с курсами медицинской, фармацевтической и токсикологической химии Вайс Е. Ф., Салмина А. Б. Общая и неорганическая химия Учебное пособие
 Скачать 1.22 Mb. Скачать 1.22 Mb.
|
|
Задание №10 «d-металлы» 1.Охарактеризовать свойства хрома, указав:
2. Можно ли приготовить раствор, который содержал бы одновременно:
3. Напишите уравнения реакций:
Вариант №5 Задание №1 «Основные классы неорганических соединений»
а) угольной кислотой; б) мышьяковистой кислотой. Задание №2 «Общие закономерности протекания химических процессов».
а) при замене одного катализатора другим; б) при изменении концентраций реагирующих веществ.
2Н2 (г.) + O2 (г.) ↔2H2O (г.); ∆Н0 = -483,6 кДЖ CaCO3 (k) ↔CaO + CO2 (г.) ∆Н0 = 179 кДЖ а) повышение давления; б) повышение температуры. Задание№3 «Строение атома»
Задание№4 «Растворы электролитов»
Задание №5 «Окислительно-восстановительные реакции». 1. Какие из перечисленных веществ и за счет, каких элементов проявляют обычно окислительные свойства, а какие восстановительные? Укажите те из них, которые обладают окислительно-восстановительной двойственностью: Н2S; SO2; СО; Zn; F2; NaNO2; KMnO4; НОCI; H3SbO3.
а) PbО2 + H2O2 → Pb(OH)2 + O2 ; б) KCIО3 + H2O2 →KCI + O2 + H2O . Задание №6 «Приготовление растворов и определение концентрации веществ» 1. Из 400 г. 50%-го (по массе) раствора H2SO4 выпариванием удалили 100 г. воды. Чему равна массовая доля H2SO4 в оставшемся растворе? 2 В какой массе воды надо растворить 67,2 л. HCI (н.у.), чтобы получить 9%-ный (по массе) раствор HCI?
Задание №7 «Химическая связь»
Задание №8 «s-металлы»
2. Закончить уравнения реакций:
Задание №9 «р-металлы» 1. Объяснить почему AgCI, AgВr, AgI хорошо растворяются в растворе КСN, а в растворе аммиака растворимы только AgCI и AgВr. 2. Закончить уравнения реакций: Zn + NaNO3 + NaОН → NH3 + Mg + НNO3 (разб.) → AL2 (SO4)3 + Na2 S + H2O → 3. Какие из перечисленных газов при пропускании их через раствор щелочи вступают с ней в реакцию:
4. С какими из перечисленных ниже веществ будет взаимодействовать концентрированная HNO3: а) В; б) AI; в) AI(OH)3; г) Na2B4O7? Задание №10 «d-металлы»
Вариант №6 Задание №1 «Основные классы неорганических соединений» 1. Определите степень окисления железа в следующих соединениях: FеS; FеS2; Fе3O4; Fе2O3; FеO. 2. Какие из указанных веществ реагируют с гидроксидом натрия: CuSO4; HNO3; СаO; СО2; Р2O5; Сd(OH)2. Написать уравнения реакций. 3. Назвать соли: SbONO3; [Fe(OH)2]2; CrO4; (ALOH)SO4; Cd(HS)2; Ca(H2PO4)2 . Задание №2 «Общие закономерности протекания химических процессов».
2 N2 (г.) + O2 (г.) → 2 NO (г.); ∆Н = -566 кДж 2CO (г.) + O2 (г.) → 2CO2 (г.) ∆Н = 180 кДж При повышении давления? При понижении температуры? Задание№3 «Строение атома» 1. Указать порядковый номер элемента, у которого: заканчивается заполнение электронами орбиталей 4d;
а) В; б) S; в) As; г) Cr; д) Hg; е ) Eu.
Задание№4 «Растворы электролитов»
К AL(SO4)2; Na3PO4; H3РО4: K3[AL(OH)4 (H2O)2]; ZnOHNO3.
ZnBr2; K2S; Fe2(SO4)3; MgSO4, Сr(NO3)3, K2CO3, Na3PO4, CuCI2. Для каждой из гидролизующихся солей написать уравнение гидролиза в молекулярной и ионно-молекулярной форме по каждой ступени и указать реакцию водного раствора соли. 3. Сравнить степень гидролиза соли и рН среды 0,1 и 0,001м растворах цианида калия. 4. Индикатор метиловый оранжевый изменяет окраску от красной до желтой в интервале рН от 3,2 до 4,4. Какова будет окраска 0,1м водного раствора ацетата аммония (СН3СООNH4), содержащего метиловый оранжевый: красная; оранжевая; желтая. Задание №5 «Окислительно-восстановительные реакции».
Задание №6 «Приготовление растворов и определение концентрации веществ»
3. Сколько граммов СаCO3 выпадает в осадок, если к 400 мл 0,5э раствора СаCL2 прибавить избыток раствора соды?
Задание №7 «Химическая связь» 1. Указать тип гибридизации атомных орбиталей кислорода в молекуле  , указать форму молекул? , указать форму молекул?2. Сероводород при обычной температуре –газ, а вода – жидкость. Чем можно объяснить это различие в свойствах? 3. Какой атом или ион служит донором электронной пары при образовании иона [Fe(NH3)3 (OH)2]+? 4. Фторид кальция не диссоциирует на атомы даже при 10000С, а иодид меди (II) неустойчив уже при комнатной температуре. Чем объяснить различную прочность этих соединений? Задание №8 «s-металлы» 1. Написать электронное строение иона Ва2+? 2. Добавление, каких из указанных веществ усилит гидролиз карбоната калия: а) KОН; б) Zn(NO3)2; в) H2O; г) K2S. 3. Закончить уравнение реакций:
Задание №9 «р-металлы» 1. С какими из перечисленных веществ будет взаимодействовать соляная кислота: а) AL; б) Zn(NO3)2; в) HgS; г) N2. 2. Закончить уравнение реакций:
3. Добавление, каких веществ усилит гидролиз AICI3:
4. Может ли произойти реакция между ВF3 и NH3 ? Задание №10 «d-металлы» 1. Что произойдет при добавлении раствора сульфида натрия к растворам:
Написать уравнение реакций. 2. Какой объем хлора (н.у.) выделится при взаимодействии 1 моля дихромата натрия с избытком соляной кислоты? 3. Закончить уравнения реакций:
Вариант №7 Задание №1 «Основные классы неорганических соединений» 1. Определить степень окисления селена в следующих соединениях: H2Sе; H2SеO3; СаSеO4; SеO3. 2.Написать формулы ангидридов указанных кислот: H2SO4; H3ВO3; НMnO4; НОCL; Н4Р2O7. 3.Какие из указанных газов вступают в химическое взаимодействие с раствором щелочи: НCL; NO2; N2; CL2; CH4; SO2; NH3. Написать уравнения реакций. Задание №2 «Общие закономерности протекания химических процессов». 1. Как изменится скорость реакции: 2NO(г.) + O2 (г.) → 2NO2 (г.), если: а) увеличить давление в системе в 3 раза; б) уменьшить объем в 3 раза; в) повысить концентрацию NO в 3 раза? 2.Во сколько раз следует увеличить концентрацию вещества В2 в системе: 2А2 (г.) + В2 (г.) = 2А2В(г.) , чтобы при уменьшении концентрации вещества А2 в 4 раза скорость прямой реакции не изменилась?
Задание№3 «Строение атома»
Задание№4 «Растворы электролитов»
|

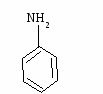 и тип связи, какое строение имеет молекула?
и тип связи, какое строение имеет молекула? NO3 Нагревание
NO3 Нагревание