Вирусология. вирь. Вакцин требует знаний структурных и функциональных особенностей вирусных антигенов, различаемых иммунной системой организма. Вирусными антигенами
 Скачать 2.43 Mb. Скачать 2.43 Mb.
|
|
Антигены вирусов и роль поверхностных белков вирионов. Совершенствование или создание новых вакцин требует знаний структурных и функциональных особенностей вирусных антигенов, различаемых иммунной системой организма. Вирусными антигенами называются продукты вирусспецифического синтеза, несущие признаки чужеродной генетической информации и вызывающие иммунный ответ. К ним относятся структурные и неструктурные вирусные белки. Защита от вирусной инфекции зависит от выраженности иммунного ответа на антигены, расположенные на поверхности вирионов или инфицированных клеток. Иммунный ответ на неструктурные вирусные антигены играет меньшую роль в защите от инфекции. Однако у герпесвирусов, например, клеточный иммунный ответ индуцируется множеством вирусспецифических белков, не входящих в структуру вирионов. Белки герпесвирусов эксперссируются каскадно и большинство нестук-турных белков синтезируется на ранней стадии репликации вируса. После про-цессинга они презентируются МНС классом I (главным комплексом гистосов-местимости, класс I) на плазматической мембране инфицированных клеток и распознаются специфическими цитотоксическими Т-клетками. Поэтому инфицированные клетки могут различаться эффекторными цитотоксическими Т-лимфоцитами до завершения цикла вирусной репликации.  Каждый вирус представляет собой сложную смесь антигенов, определяемую в первую очередь структурными белками. Являясь сложными корпускулярными антигенами вирусы обычно вызывают выраженный иммунный ответ и большая часть их белков способна вызывать синтез специфических антител. Вирусные белки неравнозначны по своей антигенной активности. Наиболее явные и доступные мишени для иммунного ответа — белки, расположенные на поверхности вирусных частиц. Это прежде всего относится к вирусным гликопротеинам, расположенным на поверхности вирусных частиц, и экспрессированным на поверхности зараженных клеток. Гликопротеины поверхности оболочечных вирусов и капсидные белки безоболочечных вирусов являются главными протективными антигенами. Под специфичностью вирусного антигена подразумевают его способность избирательно реагировать с антителами или сенсибилизированными лимфоцитами, являющимися ответом на введение данного антигена. Участок антигена, который узнается специфическим лимфоцитом, и с которым впоследствии взаимодействует специфическое антитело, называется антигенной детерминантой. Иммунологическая специфичность определяется не всей молекулой антигена, а лишь входящими в ее состав антигенными детерминантами (эпитопами). Участки вирусного белка, индуцирующие образование антител и специфически связывающиеся с ними, принято называть антигенными участками (доменами). Антитела соответствующей специфичности образуются к каждой антигенной детерминанте. Антитела к определенной детерминанте реагируют только с ней или с другой очень сходной структурой. Специфичность антигена определяется совокупностью детерминант, а его валентность — количеством однородных антигенных детерминант. Антигенность детерминант зависит от их пространственной структуры и размера молекулы антигена. Антигенные детерминанты состоят обычно из 10—20 аминокислотных остатков и содержат гидрофильные группы. Наиболее гидрофильными аминокислотами являются лизин, аргинин, аспарагиновая кислота и глютаминовая кислота. Считается, что те участки молекулы белка, в которых их содержание относительно велико, предпочитают водное окружение и поэтому располагаются на поверхности. Различают линейные (непрерывные) и конформационные (прерывистые) детерминанты. Антитела образуются преимущественно к конформационным детерминантам, расположенным, как правило, на поверхности вирионов, и зависят от третичной структуры молекулы антигена. Антигенная и иммуногенная активность вирусов определяется, главным образом, конформационными эпитопами. Разные антитела различают специфические антигенные участки вирусных антигенов. Например, прикрепительный гликопротеин (HN) вируса парагриппа имеет, по крайней мере, 6 антигенных сайтов, три из которых различаются нейтрализующими антителами. Денатурация белков приводит к потере некоторых конформационных детерминант, обнажая ранее экранированные детерминанты. В результате денатурации белки частично или полностью изменяют антигенную специфичность, что может отразиться на иммунном ответе. Вирионные белки разных вирусов различаются типоспецифичностью и вариабельностью. Одни из них обладают высокой вариабельностью, другие характеризуются консервативностью. Группоспецифические антигены являются высококонсервтивными, находятся обычно внутри вирионов и могут быть сходными у нескольких представителей рода данного семейства вирусов. Например, субвирусные частицы 12S вируса ящура содержат высококонсервативный белок, который выявляется моноклональными антителами одной специфичности у шести из семи известных типов вируса. Однако иммунизация ими не сопровождалась образованием ВН-антител. Типоспецифические антигены связаны с вариабельными областями белков, обычно расположенными в наружных частях вирионов, и обладают узкой специфичностью, присущей одной группе вирусов. Ветеринарная вирусология, ее достижения и задачи. «Ветеринарная вирусология» является профилирующей, формирующей у студента врачебное мышление дисциплиной. Поскольку преобладающее большинство инфекционных болезней всех видов животных имеет вирусную этиологию, и они наносят огромный экономический ущерб отечественному животноводству, изучение дисциплины имеет целью: – Овладение теоретическими основами вирусологии; – Приобретение знаний и навыков профилактики и диагностики вирусных болезней животных. Задачей: – Изучить особенности биологии вирусов и взаимодействия их с заражаемым организмом; – Усвоить принципиальный подход к установлению предварительного диагноза; – Научиться составлять планы лабораторных исследований при диагностике вирусных болезней; – Овладеть современными вирусологическими методами диагностики. В результате обучения студенты должны уметь: – Правильно взять патологический материал; – Правильно консервировать и транспортировать патологический материал в лабораторию; – Обнаруживать и идентифицировать вирусы в патологическом материале; – Поставить диагноз на вирусную болезнь; – Овладеть навыками: – Выполнения методов индикации вируса в патологическом материале; – Работы с куриными эмбрионами для обнаружения и выделения вирусов; – Изготовления культуры клеток и использования ее для диагностики; – Проведения серологических исследований; – Применения методов обнаружения и титрования антител в сыворотках животных; – Выполнения методов лабораторной диагностики ящура, бешенства, оспы, лейкоза КРС и других вирусных инфекций. Вирусы -- возбудители болезней животных, растений, а также человека. По- добно другим инфекционным агентам они содержат генетическую информацию в форме последовательности нуклеотидов в молекулах нуклеиновых кислот (ДНК или РНК), реализуют ее с помощью триплетного кода, обладают наслед- ственностью и изменчивостью, поддаются естественному и искусственному от- бору. Но в отличие от других инфекционных агентов вирусы не имеют своего обмена веществ, и поэтому они ничем не питаются, не дышат и ничего не выде- ляют, у них нет белоксинтезирующих и энергообразующих систем. Вирусы размножаются только в живых клетках, поэтому их можно рассматривать как биологические образования, несущие генетическую информацию, которую они реализуют только в живых клетках животных и растений. В хозяйствах промышленного типа широко распространены острые респи- раторные и кишечные заболевания, вызываемые вирусами парагриппа (пара- миксовирусы), инфекционного ринотрахеита (герпесвирусы), вирусной диареи (флавивирусы), аденовирусами и др. 8 Вирусы могут быть причиной внутриутробной патологии животных. Среди рациональных мер борьбы с вирусными болезнями лабораторная ди- агностика занимает ведущее место. Вирусологические отделы. Вирусологические отделы лабораторий и на- учно-исследовательских ветеринарных станций призваны осуществлять ла- бораторную диагностику вирусных инфекций, контролировать заболевае- мость животных, вызываемую вирусами в межэпизоотический период. Вирусология зародилась в конце XIX столетия после опубликования рабо- ты (1892) Д. И . Ивановского о мозаичной болезни табака, где приводятся убедительные доказательства о том, что мозаичная болезнь табака вызывает- ся мельчайшим микроорганизмом, невидимым в световые микроскопы и проходящим через бактериальные фильтры. Вскоре Д. И. Ивановский доказал, что болезнь заразна и передается от по- раженного ею растения к здоровым. 0, Ивановский делает новое открытие: в листьях, пораженных возбудителем табачной мозаики, обнаруживает мелкие кристаллы. Через сорок лет амери- канский вирусолог У. Стенли изучил эти кристаллы и доказал, что они пред- ставляют собой скопление вируса табачной мозаики. Между тем все новые и новые факты подтверждают, что Д. И. Ивановский открыл новый мир живых существ -- вирусы. Ф. Леффлер и П. Фрош (1898-1899), применив методику ультрафильтрации Д. И. Ивановского, уста- новили, что ящур также вызывается вирусом. В 1911 г. П. Раус доказыва- ет, что саркома кур -- вирусное заболевание. Туорт (1915) и Д'Эррель (1917) обнаруживают, что бактерии могут поражаться вирусами - бактерио- фагами. Последние, размножаясь в бактериях, лизируют и вызывают их ги- бель. Величайшая заслуга Д. И. Ивановского заключается не только в том, что он открыл первый вирус и первым понял, что встретился с особой катего- рией возбудителей, болезней, но также и в том, что он первым сформулиро- вал основные признаки вирусов (мельчайшие размеры и проходимость через бактериальные фильтры, внутриклеточный паразитизм и неспособность раз- множаться на искусственных питательных средах), которые долгое время были основными критериями при определении вирусной природы возбуди- телей болезни. Д. И . Ивановский не только открыл новую форму существования жизни - вирусы, но своими выдающимися исследованиями заложил основы ряду на- правлений, разработка которых сыграла огромную роль в формировании и развитии современной вирусологии . Им были заложены основы цитопатоло- гии вирусных инфекций. Впервые было установлено важное значение латент- ного вирусоносительства. В последние годы установлено, что вирусы, ранее считавшиеся возбуди- телями только острых заболеваний, часто являются причиной хронических инфекций (корь, краснуха, паротит, клещевой и японский энцефалиты, бе- шенство, грипп и др.). В настоящее время известно свыше 500 болезней, вызываемых зоопатогенными вирусами. Многие из них являются возбудителями широко распространенных болезней приносящих огромный ущерб человече- ству; ущерб от вирусных заболеваний намного превышает ущерб, наноси- мый бактериями, грибками и простейшими). К особо опасным вирусным бо- лезням животных относят ящур, чуму рогатого скота, чуму свиней, птиц и др. Вирусология имеет не только большое практическое значение для здра- воохранения и сельского хозяйства, но и представляет огромный теоретиче- ский интерес для биологии, генетики, биохимии и других отраслей естество- знания Вирионы - наиболее известная форма существования вирусов. Вирусы устроены очень просто. Они состоят из фрагмента генетического материала, либо ДНК, либо РНК, составляющей сердцевину вируса, и окружающей эту сердцевину защитной белковой оболочкой, которую называют капсидом. Полностью сформированная инфекционная частица называется вирионом. У некоторых вирусов, таких, как вирусы герпеса или гриппа, есть еще и дополнительная липопротеидная оболочка, которая возникает из плазматической мембраны клетки-хозяина. В отличие от всех остальных организмов вирусы не имеют клеточного строения. Оболочка вирусов часто бывает построена из идентичных повторяющихся субъединиц – капсомеров. Из капсомеров образуются структуры с высокой степенью симметрии, способные кристаллизироваться. Это позволяет получить информацию об их строении с помощью рентгеновских лучей и с помощью электронной микроскопии. Как только в клетке-хозяине появляются субъединицы вируса, они сразу же проявляют способность к самосборке в целый вирус. Самосборка характерна и для многих других биологических структур, она имеет фундаментальное значение в биологических явлениях. Непременным компонентом вирусной частицы является какая-либо одна из двух нуклеиновых кислот, белок и зольные элементы. Эти три компонента являются общими для всех без исключения вирусов, тогда как остальные липиды и углеводы - входят в состав далеко не всех вирусов. Вирусы, в состав которых наряду с белком и нуклеиновой кислотой входят также липиды и углеводы, как правило, принадлежат к группе сложно устроенных вирусов. Кроме белков, входящих в состав нуклеопротеидного «ядра», вирионы могут содержать еще вирус - специфические белки, которые были встроены в плазматические мембраны зараженных клеток и покрывают вирусную частицу, когда она выходит из клетки или «отпочковывается» от ее поверхности. Кроме того, у некоторых вирусов с оболочкой существует субмембранный матриксный белок между оболочкой и нуклеокапсидом. Вторую большую группу вирус-специфических белков составляют некапсидные вирусные белки. Они в основном имеют отношение к синтезу нуклеиновых кислот вириона. Ещё одним компонентом являются углеводы (в количестве, превышающем содержание сахара в нуклеиновой кислоте). Парамиксовирусы, размножающиеся в различных клетках, могут содержать и соответственно разные липиды. Поэтому специфика вирусной оболочки зависит от вирусных гликопротеидов, находящихся на ее поверхности. У бактериофагов и вирусов животных и растений обнаружены полиамины. Возможно, что их единственная физиологическая функция состоит в нейтрализации отрицательного заряда нуклеиновой кислоты. Например, вирус герпеса содержит достаточно спермина, чтобы нейтрализовать половинку вирусной ДНК, а в вирусной оболочке, кроме того, присутствует спермидин. Вирусы как инфекционные агенты. Принципиальные отличия вирусов от других инфекционных агентов. Вирусы – неклеточные формы жизни, которых относят к царству Вира, невидимые в световой микроскоп частицы, паразиты эукариотической и прокариотической клетки, вне клетки не проявляют никаких признаков жизни. Вирусы являются облигатными паразитами, т.к. вирусы не способны размножаться вне клетки. Вне клетки вирусные частицы ведут себя как химические вещества. В настоящее время известны вирусы, размножающиеся в клетках растений, животных, грибов и бактерий (вирусы бактерий - бактериофаги). Обнаружены также вирусы, поражающие другие вирусы (вирусы-сателлиты). Вирус представляет собой молекулы нуклеиновых кислот (ДНК или РНК, некоторые, имеют оба типа молекул - мимивирусы), заключённые в белковую оболочку и способны инфицировать живые организмы. От других инфекционных агентов вирусы отличает капсид. Капсид — это внешняя оболочка вируса, состоящая из белков. Капсид выполняет несколько функций: - Защита генетического материала вируса от механических и химических повреждений. - Определение к возможности заражения клетки. - На начальных стадиях заражения клетки: прикрепление к клеточной мембране, разрыв мембраны и внедрение в клетку генетического материала вируса. В зависимости от структуры и хим. состава оболочки различают простые и сложные вирусы. Простые вирусы состоят из НК и капсида. Имеют различную форму: палочко-, шаро-, и нитевидную. Сложные вирусы покрыты дополнительно липопротеидной мембраной, для распознавания рецепторов клетки. Могут ещё содержать углеводы и ферменты. Это вирусы полиомиелита, гепатита В, оспы. Могут выдерживать высокую температуру вне клетки. Генетические признаки вирусов и их использование в характеристике штаммов. Мутации у вирусов и их механизмы. Вирусы имеют полифилетическое происхождение. В связи с этим, 20% вирусов несут в качестве генетического материала ДНК, 80% — РНК. Как генетический материал ДНК и РНК обладают разным эволюционными возможностями, так как с разной эффективностью реализуют внутренние источники наследственной изменчивости. Внутренними источниками изменений являются спонтанные генные мутации и рекомбинационные процессы, включающие интеграционные взаимодействия с геномом хозяина. Мутации (точковые и множественные) представляют собой изменение генетического кода в результате замены (транзиции, трансверсии), выпадения (делеции) или вставки (инсерции) одного или нескольких нуклеотидов в геномной последовательности. Большинство мутаций носит нейтральный характер. К изменению фенотипа ведут только мутации, затрагивающие функционально активные последовательности белковой молекулы. По изменению фенотипа различают летальные, условно-летальные и нелетальные мутации. Примером летальных делеционных мутантов вирусов служат ДИ-частицы, условно-летальных — температурочувствительные (ts) мутанты. Нелетальные мутации обеспечивают антигенный дрейф и определяют существование различных серотипов и генетических вариантов вирусов. В естественных условиях размножения движущей силой изменчивости вирусов являются спонтанные мутации, частота которых существенно варьирует внутри различных генетических групп вирусов. Скорость спонтанных мутаций в ДНК-геномах чрезвычайно мала и составляет 10 Различают два механизма мутагенеза — ошибка включения и ошибка репликации. В первом случае причиной мутаций является присутствие в клетке веществ, обладающих мутагенным действием — аналогов нуклеотидных оснований, свободных радикалов, перекисей и т. д. Во втором случае причина заложена в точности воспроизведения геномной нуклеиновой кислоты в процессе репликации. В отличие от ДНК-содержащих вирусов, РНК-содержащие обладают повышенной мутабельностью. Это свойство определяется химическим составом, структурой и способом репликации РНК, исключающим возможность исправления ошибок на неповрежденной комплементарной цепи. Вследствие отсутствия репарационного механизма при репликации РНК в каждом репликационном цикле около 10% потомства РНК-содержащих вирусов имеет мутации. У вирусов гриппа и ВИЧ замещается около 1% последовательности в год. Сами по себе мутации, изменяющие генетические признаки отдельных вирусных частиц не могут привести к изменению наследственных свойств вирусной популяции в целом. Для этого необходим второй фактор — селекция, или направленный отбор мутантов, обладающих преимуществами для размножения в измененных условиях. Классическим примером выживания вируса за счет присутствия в популяции мутантов является выработка устойчивости к противовирусным препаратам. Другим широко известным проявлением естественной изменчивости вирусов является изменение антигенной структуры вируса гриппа A. В этом случае основной причиной изменчивости являются мутации в гене гемагглютинина, и как следствие — антигенный дрейф, который используется вирусом как механизм ухода из-под иммунологического надзора. Рекомбинация — физическое взаимодействие между вирусными геномами в смешанно-зараженной клетке, при котором потомство, называемое рекомбинантами, содержит последовательности нуклеотидов, происходящие от обоих родителей. Различают два вида взаимодействий между геномами — внутримолекулярную рекомбинацию и реассортацию. Внутримолекулярная рекомбинация представляет собой перераспределение последовательностей внутри одной молекулы геномной нуклеиновой кислоты. Установлена как для непрерывных, так и для сегментированных геномов, независимо от вида нуклеиновой кислоты. У ДНК-содержащих вирусов внутримолекулярная рекомбинация является основной причиной эволюционных изменений и происходит обычным образом по механизму разрыв-воссоединение. Кроме этого, источником наследственной изменчивости вирусов может служить включение в вирусный геном генетического материала хозяина, которое наблюдается при интегративной вирусной инфекции. У РНК-геномных вирусов в основе внутримолекулярной рекомбинации лежит механизм смены матрицы путем так называемого «прыжка» РНК-полимеразы на гомологичную область нуклеотидной последовательности. Рекомбинационные взаимоотношения могут наблюдаться на уровне одного вируса, между разными серотипами вируса и между разными вирусами. Описана внутримолекулярная рекомбинация между сегментами РНК трипартитного бромовируса растений, когда дефектный 3'-конец одной нити РНК был восстановлен за счет рекомбинации с 3'-концом другого РНК-сегмента. Подтверждением межтиповой рекомбинации служит обнаружение природных штаммов полиовируса вакцинного происхождения, геном которых содержал последовательности генома всех трех серотипов вируса. Такие рекомбинанты возникают при вакцинации живой пероральной поливалентной полиовирусной вакциной, что создает возможность заражения одной клетки кишечника всеми тремя полиовирусами с последующей сменой матрицы РНК-полимеразой в процессе их репликации. В качестве примера рекомбинационных взаимоотношений между разными вирусами может быть приведен вирус западного энцефалита лошадей (Alphavirus), который является гибридом вируса восточного энцефаломиелита лошадей и вируса Синдбис, от которого он приобрел регион, кодирующий поверхностный гликопротеин. РНК-содержащие вирусы могут изменяться путем приобретения последовательностей генома клетки-хозяина как за счет интегративных взаимоотношений (ретровирусы), так и без них. Так, пестивирус вирусной диареи быка рекомбинирует с клеточными мРНК, в результате чего нецитопатогенный вирус может стать цитопатогенным и вызвать смертельную мукозальную болезнь у хозяев. Реассортация — перераспределение фрагментов сегментированного генома, является разновидностью рекомбинации. При реассортации вирусы с сегментированным геномом обмениваются сегментами, в результате у потомства, называемого реассортантами, в геном входят гены каждого из родителей. У вирусов с сегментированным геномом при реассортации сегменты перемешиваются случайным образом. Наиболее вероятно, что обмен происходит на стадии морфогенеза при условии двойного инфицирования клетки разными штаммами вируса. Явление реассортации в естественных условиях широко распространено у реовирусов, ротавирусов, бирнавирусов, вирусов гриппа. В том случае, если в результате реассортации произошла замена гена, определяющего антигенные характеристики вируса, и образовавшееся потомство приобретает новые антигенные свойства, речь идет об антигенном шифте. Реассортация генов при смешанном инфицировании клеток вирусами разной видовой специфичности может служить причиной возникновения реассортантов не только с новыми антигенными свойствами, но и с новым эпидемическим потенциалом, дающим возможность реассортантам преодолевать межвидовые барьеры (межвидовая трансмиссия, переход от одного вида хозяина к другому). В общебиологическом смысле межвидовая трансмиссия — процесс смешения популяций, приводящий к нарушению их изоляции, влекущий за собой одно-, или двусторонний обмен генами и приводящий к увеличению запасов наследственной изменчивости популяций за счет поступления генов из генофонда другой популяции. Явление межвидовой трансмиссии широко распространено в природе у вируса гриппа и ротавирусов. Для вируса гриппа преодоление межвидового барьера является одним из источников формирования пандемичных штаммов. Известные в .настоящее время пандемичные штаммы вируса гриппа A возникли в результате реассортации генов вируса гриппа человека и вируса гриппа птиц при смешанной инфекции в организме свиней. Для ротавирусов человека показано появление новых штаммов, связанных с трансмиссией от кошек, свиней, собак, овец, крупного рогатого скота. Реассортанты, несущие гены ротавирусов животных, привнесли в популяции ротавирусов человека новые серотип-определяющие гены. Действие на вирионы вирусов различных температур, УФЛ, кислот, щелочей, спиртов, дезинфектантов, окислителей и восстановителей, жирорастворителей, антибиотиков. Диагноз на основе анализа клинических симптомов, патологоанатомических изменений и эпизоотологических данных. Живые и инактивированные вакцины, их достоинства и недостатки. 18. Инактивированные вакцины. Инактивированные вакцины. -наработка вирус содержащего материала с использованием злых полевых штаммов. -Инактивация вируса (формалин, бета-пропиолактон, препараты азадинового ряда, температура, УФО, гамма-лучи, сульфат меди. -Добавление адьюванта в инактивтрованную вакцину. Адьювант адсорбирует на своей поверхности частицы разрушенного вируса. (сорбент-адьюванты: Al-Al(OH)3, SiO2 или масляные адьюванты). -Добавление сапонинов для суперраздражающего действия при в/м и п/к инъекциях. Применяют в очень малых концентрациях для образования воспаления в месте введения. Инактивированные вакцины готовятся из инактивированных вирулентных штаммов бактерий и вирусов. Хранение и применение инактивированных вакцин: эта группа препаратов теряет свою иммуногенность и увеличивает реактогенность при замораживании; вакцины должны храниться при температуре 4-8 °С; для создания длительной защиты требуется неоднократное введение инактивированных вакцин (так как их эффективность ниже, чем у живых). Инактивированные вакцины обеспечивают создание в крови высоких концентраций антител. Однако клеточный иммунитет от инактивированных вакцин активируется в меньшей степени, чем от живых. Для предотвращения заболевания, вызываемого вирусами типа А и В, чаще всего используются инактивированные вакцины (ваксигрипп, флюарикс, инфлювак), которые, в отличие от живых гриппозных вакцин, имеют меньшее число противопоказаний и менее реактогенны. 19. Живые вакцины. Живые противовирусные вакцины представляют собой лиофилизированные взвеси вакцинных штаммов вирусов, выращенных в разл. био системах (КЭ, КК, в лаб жив.). Основным свойством является стойкая утрата способности вызывать в организме привитого жив. типичное инф. заболевание, также обл. способностью «приживляться» в орг. жив., т.е размножатся. Пребывание и размножение вакцинного штамма продолжается обычно 5-10дн. до нескольких недель и не сопр. клин. проявлениями, хар. для данной б., приводят к форм. иммунитета против инф. забл. Преимущества: высокая напряженность и длительность создаваемого ими иммунитета, приближающегося к постинфекц. Возможность для большинства однократного введения. Введение не только подкожно, но и перорально и интерназально. Недостатки: чуств к неблагоприятным факторам. Строгие рамки хранения и транспортировки – темпер – 4-8С. Недопустимо наруш. вакуума в апулах с вакцинами. Строгие соблюдения правил асептики. Контроль качества: 1)всестороние обслед. доноров тк. 2)оценку качества пит. среды и КК на стерильность. 3)Надзор за качеством производственных штаммов вирусов. 4)Создание оптим. усл. для сохр. биоматериалов. 5)опрация готового материала. Значение вирусов для решения общебиологических проблем. Индикация вирусов в патологическом материале по обнаружению вирионов и вирусных телец-включений. 3.1 Методы прямого обнаружения вируса в исследуемом материале. Многие вирусные белки, которые называются структурными, обладают свойством самопроизвольно под действием межмолекулярных сил собираться в комочки, агрегаты (процесс самосборки). В каждый такой агрегат включается обычно по одной молекуле вирусных ДНК или РНК. Иногда в них могут включаться еще и липиды клеточного происхождения. Образующиеся таким путем частицы называются вирионами. В вирионах молекулы белков так взаимно ориентированы, что на них не могут действовать протеолитические ферменты, а молекулы вирусных ДНК или РНК оказываются недоступными для нуклеаз и защищенными ох действия физических факторов среды. Формирование вирионов каждого отдельного вируса возможно только в клетках определенного типа. Вирионы можно рассматривать как покоящуюся неактивную форму существования вирусов. Поэтому в форме вирионов вирусы могут определенное время находиться и вне клеток без потери биологической активности. Крупные вирусы (оспа, эктима), видимые в иммерсионной системе светового микроскопа получили название элементарные тельца. Внутриклеточные тельца-включения – это обломки скоплений вирусных частиц или продукт реакции клетки на вирусную инфекцию. Их классифицируют по месту локализации в клетке, по гомогенности, по составу нуклеиновой кислоты, по тинкториальным свойствам. При ряде вирусных инфекций обнаружение телец - включений имеет диагностическое значение. Многие из них настолько типичны, что обнаружение их стало одним из основных экспресс-методов диагностики бешенства, оспы, ринопневмонии лошадей, ринотрахеита крупного рогатого скота. 3.2 Методы окраски вирионов. Существует много методов окраски мазков, мазков - отпечатков. Самым распространенным является метод окраски по Морозову. Метод окраски прост, не требует дефицитных реактивов, выполним на занятиях. Приготовленные мазки сушат на воздухе, помещают в вертикальном положении в дистиллированную воду на 10-15 минут и красят. Для окраски по Морозову готовят три реактива. 1) жидкость Руге. 2) протраву 3) красящий раствор аммиачного серебра. Рассматривают препарат в иммерсионной системе. Элементарные тельца на светло - коричневом фоне препарата имеют вид темно - коричневых почти черных мелких зерен, образований. Тельца-включения, образуемые рядом вирусов, получили специальные названия. Так, цитоплазматические тельца - включения, образуемые в нервных клетках млекопитающих вирусом бешенства, называют тельца Бабеша-Негри, в эпителиальных клетках овец - вирусом оспы овец - тельца Борреля, вирусом оспы кур - тельца Болингера. Как правило, РНК-содержащие вирусы образуют цитоплазматические, а ДНК-содержащие – внутриядерные тельца-включения Небольшая группа вирусов вызывает образование телец-включений обоих типов. Наибольшее практическое значение приобрели тельца Бабеша-Негри в диагностике бешенства. Из кусочков определенных отделов головного мозга (Аммоновых рогов, мозжечка, продолговатого мозга) готовят гистологические срезы. Полученные препараты окрашивают по методу Муромцева, Туревича, Селлерса и др. Каждый метод окраски дает свою характерную картину. 3.3 Устройство и принципы работы электронного и люминесцентного микроскопов. При любых микроисследованиях необходимо именно точные сведения о морфологических особенностях интересующего нас организма. Эти сведения не могут быть получены иначе, как путем изучения данного организма под микроскопом. В силу этого микроскоп становится важнейшим орудием для практического изучения микроорганизмов, и знакомство с ним является первым условием успеха в этой работе. Целью различных видов микроскопии являются дальнейшее изучение морфологии вирусов и дифференциальная диагностика инфекционных болезней. По схеме строения электронный микроскоп аналогичен световому. В отличие от светового в электронных микроскопах изображение получается с помощью потока электронов. П 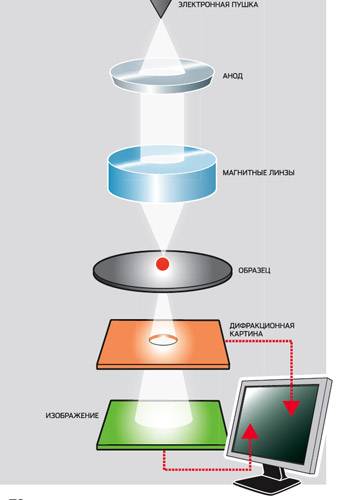 Рисунок 7. Схема работы просвечивающего электронного микроскопа учок электронов проходит через исследуемый препарат и его изображение проецируется на люминесцентный экран. Источником электронов является электронная пушка (вольфрамовая нить), нагреваемая электротоком. Электроны ускоряются и направляются вниз по колонке, проходя через несколько магнитных линз (конденсорная, объективная, проекционная). На экране возникает видимое изображение объекта, которое можно сфотографировать или просматривать на экране монитора (рис.7). Чтобы предотвратить поглощение электронов воздухом, из микроскопа откачивают воздух вакуум - насосом. Основные части микроскопа: колонка, панель управления, пишущее устройство, вакуумная система, соединительные кабели. В нижней части электронного микроскопа расположены масляные и диффузные насосы. Максимальная разрешающая способность электронного микроскопа 2А°. По характеру исследования объектов различают микроскопы просвечивающего типа, сканирующие, эмиссионные, теневые. При работе с электронным микроскопом важное значение имеет подготовка препаратов. Для просвечивающего электронного микроскопа исследуемые объекты должны быть в виде тонких срезов или вирусных суспензий. Объекты помещают на медные сеточки с подложками. 3.4 Методы подготовки препаратов: метод негативного контрастирования, метод отпечатков, метод напыления, метод ультратонких срезов. Материалом для электронно-микроскопических исследований вирусов могут быть смывы со слизистых оболочек, содержимое кишечника, кожные поражения, корочки, кусочки органов и тканей, аллантоисная жидкость куриного эмбриона, вируссодержащая культуральная жидкость культуры клеток. При подготовке препаратов большое значение имеет концентрация вируса в материале и степень его контаминации балластными веществами. В зависимости от этих факторов и выбирают методику подготовки исходного материала. С помощью электронного микроскопа в отдельных случаях в считанные минуты по морфологии вирусных частиц можно определить таксономическое положение вируса. Метод иммунофлуоресценции называют еще РИФ, метод меченых антител. Принцип РИФ основан на использовании явления флюоресценции, который состоит в испускании света атомами вещества, поглотившими избыточную внешнюю энергию и пришедшими в состояние возбуждения. При этом используют люминесцентную микроскопию (рис. 7) 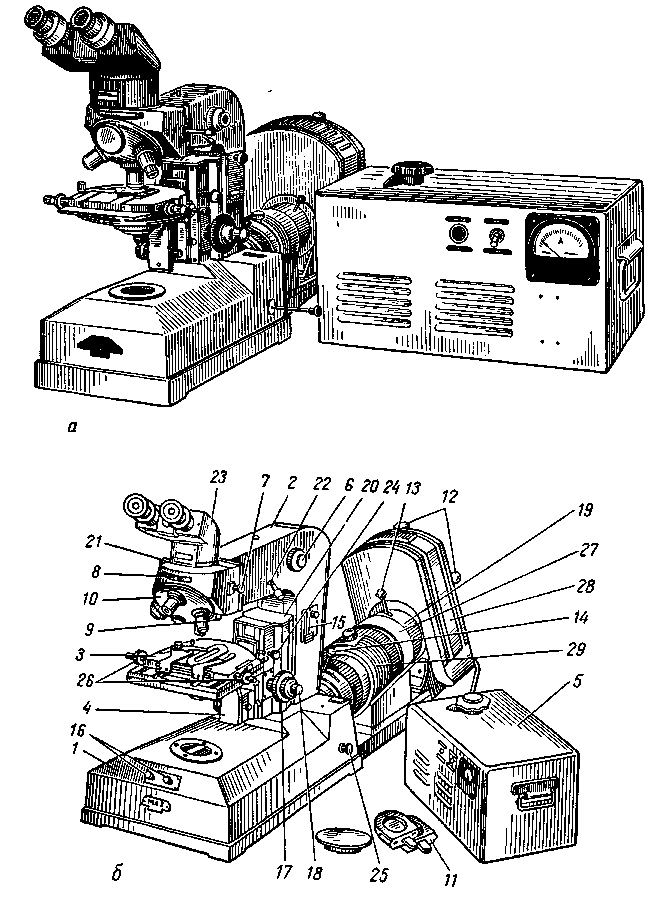 Рисунок 7. Люминесцентный микроскоп МЛ-2 В диагностических исследованиях методом РИФ в качестве объекта исследования могут быть мазки – отпечатки, срезы органов и тканей, соскобы, гистологические срезы, препараты тканевых культур. При прямом методе РИФ мазок - отпечаток обрабатывают сывороткой, меченной антителами, гомологичными тому вирусу, наличие которого предполагается. Если в мазке содержится антиген, гомологичный антителам сыворотки, то образуется комплекс антиген + антитело. Препараты отмывают, сушат и исследуют под люминесцентным микроскопом, который устроен так, что на препарат падает пучок сине-фиолетовых лучей, а в глаз наблюдателя попадают только желто-зеленые лучи, которые испускает комплекс антиген + антитело. По этому свечению и судят о наличии в материале антигенов, гомологичных антителам меченой сыворотки. Непрямой метод состоит в том, что мазок - отпечаток обрабатывают дважды: вначале немеченой антивирусной сывороткой, а затем после отмывания - меченной антивидовой. После второго отмывания препарат высушивают и исследуют под люминесцентным микроскопом. Обнаружение в препарате специфической флюоресценции указывают на наличие в материале антигенов, гомологичных использованной противовирусной сыворотке. По эффективности непрямой метод имеет преимущества перед прямым методом. В целом метод флюоресцирующих антител обладает рядом достоинств перед другими методами. Индикация, выделение и идентификация вирусов. В лаборатории часть материала берут для исследования, оставшуюся часть хранят на случай дополнительных исследований. Затем составляют план исследования присланного материала, которые включапет следующие задачи: |
