Вирусология. вирь. Вакцин требует знаний структурных и функциональных особенностей вирусных антигенов, различаемых иммунной системой организма. Вирусными антигенами
 Скачать 2.43 Mb. Скачать 2.43 Mb.
|
|
Персистенция вирусов. Роль факторов иммунитета на этапах патогенеза вирусной болезни. Получение патологического материала, его транспортировка. 2.1 Получение и обработка патологического материала В лабораторной диагностике вирусных болезней точность диагноза прежде всего зависитот правильности взятия патологического материала, его транспортировки, качества приготовления и техники исследования вируссодержащего материала, которые имеют свои особенности. Материал для исследований от заболевших, павших или вынужденно убитых животных следует брать как можно быстрее после появления четких признаков болезни или не позднее 2–3 ч после клинической смерти или убоя. Это связано с тем, что сразу после заболевания или в первые 1–2 дня значительно ослабевает барьерная роль кишечника, что наряду с повышенной проницаемостью кровеносных сосудов способствует диссеминации кишечной флоры. Кроме того, по мере продолжения и даже углубления инфекционного процесса количество вируса может уменьшаться в результате воздействия защитных механизмов организма. При взятии материала для выделения вируса следует исходить из патогенеза изучаемой инфекции (входные ворота, пути распространения вируса в организме, места его размножения и пути выделения). Так, при респираторных инфекциях для выделения вирусов берут носоглоточные смывы, мазки из носа и глотки, соскобы трахеи и кусочки легкого трупов; при энтеровирусных – кал; при нейротропных – кусочки головного или спинного мозга; при дермотропных инфекциях – свежие поражения кожи и т. п., т. е. отбирают тот материал, в котором предполагается наибольшая концентрация вируса. Материалом для выделения вируса могут служить различные экскреты и секреты, кусочки органов, кровь, лимфа и пр. Кровь берут из яремной вены, у свиней – из кончика хвоста или уха. Лучше кровь у свиней брать из венозного сплетения глаз. При этом пользуются шприцем «Рекорд» (на 20 мл) и иглой № 12–30, которую вводят по внутреннему углу костной орбиты (скосом иглы к костной орбите) к противоположному уху до упора, затем оттягивают на 1–1,5 см и набирают кровь. Для выделения вируса может быть использована либо цельная дефибринированная, либо «лаковая» кровь (смесь крови с дистиллированной водой в соотношении 1:1), либо отдельные элементы крови (эритроциты, лейкоциты, плазма, сыворотка). Для обнаружения противовирусных антител кровь берут у одного и того же животного дважды с интервалом 2–3 нед (для получения парных сывороток в объеме не менее 5,0 мл каждой). Смывы с конъюнктивы, со слизистой оболочки носа, с задней стенки глотки, прямой кишки и клоаки у птиц берут стерильными ватными тампонами и погружают их в пенициллиновые флаконы или пробирки, содержащие 3–5 мл соответствующей жидкости. Наиболее часто для этого используют раствор Хенкса или среды для культур клеток (ГЛА, 199, Игла) с антибиотиками (пенициллин и стрептомицин по 500 ЕД и нистатин по 20 ЕД на 1 мл среды) и белковым стабилизатором, например 0,5%-ным раствором желатина или 0,5–1%-ным раствором альбумина бычьей сыворотки. Присутствие стабилизаторов необходимо для предотвращения быстрой инактивации некоторых вирусов (например, парагриппа). При взятии материала из носоглотки можно пользоваться прибором, сконструированным Томасом и Стоком. Он состоит из трубки диаметром 9 мм и длиной 30 см, внутри которой помещается вторая тонкая трубка с нержавеющим стержнем, оканчивающимся нейлоновой щеткой (диаметр 9 мм). Прибор вводят глубоко в носовые ходы (хоаны) или в горло через носовой ход, выдвигая щеточку, а затем вновь задвигая ее в трубку, перед тем как вынуть прибор из органа. Щеточку тщательно отмывают от слизи и клеток в 2 мл жидкости. Слюну имеет смысл брать при наличии признаков поражения ротовой полости или слюнных желез. Вытекающую изо рта слюну можно собрать прямо в пробирку. Если ее выделяется мало или она не вытекает, необходимо пропитать слюной стерильный тампон из ваты на палочке, а затем поместить в пробирку с небольшим количеством физиологического раствора и закрыть резиновой пробкой. Для усиления слюноотделения животному можно ввести пилокарпин из расчета 0,02–0,05 г на 1 кг массы. Мочу собирают при помощи катетера в стерильную посуду. Фекалии берут из прямой кишки шпателем или палочкой и помещают в стерильную пробирку или пенициллиновый флакон. Везикулярную жидкость можно собрать шприцем или пастеровской пипеткой в стерильную пробирку. Стенки афт, корочки с поверхности кожи снимают пинцетом. 2.2 Получение патологоанатомического материала Вирусы из трупа животного выделяют из ткани или органов, в которых предположительно происходит наибольшее их накопление. Материал для исследования берут по возможности скорее (во избежание аутолиза). Иногда целесообразно провести диагностический убой больного животного на стадии максимального проявления клинической картины болезни. При этом необходимо составить подробный протокол вскрытия и получить пробы. Получение проб органов нервной системы.Такие пробы исследуют при подозрении на бешенство, энцефалиты, болезнь Ауески, энцефаломиелит птиц и другие инфекции, сопровождающиеся поражением центральной нервной системы. У крупных животных (рогатый скот, лошади, овцы, свиньи, собаки, дикие звери) после удаления шерстного покрова, дезинфекции и удаления кожи и мышц делают распил черепной коробки, снимают твердую мозговую оболочку и обнаженный головной мозг целиком извлекают в стерильную посуду. Кролика для извлечения головного мозга фиксируют на станке или специальном лотке. Затем рассекают кожу от носа до шеи, если нужно взять и спинной мозг – до хвоста и отпрепаровывают. Череп смазывают йодом. Вскрывают черепную коробку костотомом. Крышку черепной коробки откидывают, твердую мозговую оболочку рассекают и удаляют, спинной мозг пересекают на уровне foramenoccipitalemagnum и весь головной мозг извлекают вместе с мозжечком. Извлечение спинного мозга.Рассекают вдоль позвоночника мышцы спины, специальными костными щипцами или большими остроконечными ножницами пересекают с обеих сторон остистые отростки позвонков, снимают твердую мозговую оболочку, обнаженный спинной мозг вынимают целиком или сегментами вместе с корешками и помещают в стерильную чашку Петри. При извлечении спинного мозга по методу Ошида позвоночник пересекают на уровне шейных и поясничных позвонков и стерильным зондом с ватным тампоном, введенным в спинномозговой канал с поясничного конца, выталкивают спинной мозг в стерильную посуду. У морских свинок, крыс и мышей принцип взятия мозга такой же, как у кроликов. Для вскрытия черепной коробки морских свинок и крыс применяют остроконечные хирургические ножницы, для вскрытия черепа мышей – глазные. Спинной мозг мелких животных получают также методом выдавливания. Позвоночник вместе с ребрами и мышцами пересекают в шейной части, затем двумя пинцетами, начиная с хвостовой части, попеременно пережимают позвоночник, постепенно передвигаясь к головному концу. Спинной мозг выдавливают из пересеченного шейного конца позвоночника. Головной и спинной мозг не рекомендуется промывать растворами. При извлечении их необходимо также соблюдать все предосторожности (работа в защитной спецодежде, в резиновых перчатках, защитной маске и очках, быть предельно аккуратным). Периферические нервы редко используют для выделения вируса. Метод получения нерва обусловливается анатомическим его расположением. Для исследования необходимо брать небольшой отрезок нерва. Извлечение глаза.Ткани глаза используют для выделения вируса при болезнях, сопровождающихся поражением глаза и конъюнктивы и накоплением или репродукцией вируса в них. Для извлечения глаза вокруг него рассекают кожу и удаляют ее. Ножницами рассекают конъюнктиву и глазные мышцы. Глазное яблоко выводят пинцетом из орбиты наружу, а затем пересекают глазной нерв. Извлеченное глазное яблоко фиксируют пинцетом за культю глазного нерва и струей стерильной питательной среды тщательно и обильно промывают. При необходимости исследования разных тканей глаза (например, роговицы) иссечение их производят в стерильных условиях Извлечение внутренних органов.Вскрытие грудной и брюшной полостей производят по общим правилам. Для исследования берут вируссодержащие органы – легкие, печень, почки, лимфоузлы, селезенку, кишечник и др. При наличии макроскопических изменений органов из пораженной части их вырезают кусочки, захватывая и непораженную ткань. 2.3 Получение проб для гистологического исследования. Пробу для гистологического исследования также необходимо проводить как можно скорее после гибели животного, до аутолиза и деструкции клеток. Если нет возможности доставить материал в лабораторию в течение нескольких часов, его помещают в консервирующий раствор. С. С Кальтер уточняет условия, обеспечивающие оптимальное сохранение проб. 1) соотношение жидкости и ткани 20:1, 2) толщина пробы не более 0,5 см (длина и ширина не играют особой роли); 3) использование для пересылки проб сосудов с широким горлом. Ни в коем случае нельзя замораживать ткани или использовать буру при консервации проб, предназначенных для гистопатологического исследования! Хороший фиксирующий раствор получают при смешивании 50 мл формалина (40 % раствора формальдегида в воде) с 450 мл воды и 3,8 г поваренной соли. При отсутствии измерительных приборов и весов такой раствор можно приготовить, взяв 3 столовые ложки формалина, 0,5 л воды и чайную ложечку поваренной соли. В качестве материала для гистологических исследований берут кусочки (размером в несколько кубических сантиметров) тех органов, которые имеют видимые отклонения от нормы (по форме, размеру, цвету, консистенции, наличию необычных образований); могут быть поражены и содержать вирус на основании клинической картины болезни и предположительной избирательной локализации. 2.4 Транспортировка и хранение проб. Пробы рекомендуется как можно быстрее поместить в условия, обеспечивающие замедление процессов инактивации вируса. Такие условия обеспечивают низкие температуры. Для этого пробирки (флакончики) с патматериалом, закрытые резиновыми пробками, надо поместить в термос с охлаждающей смесью (рис. 4, 5). В качестве охлаждающей смеси можно взять смесь равных частей сухого льда (твердой углекислоты) и этилового спирта (температура минус 71 °С держится несколько дней). Можно использовать смесь, состоящую из трех массовых частей льда или снега и одной массовой части поваренной соли. В последнем случае удается получить температуру минус 15 – минус 20 °С. Вместо замораживания можно использовать для консервирования химические средства (менее эффективно). Лучшим из последних считается смесь равных объемов стерильных глицерина и 0,85%-ного раствора поваренной соли (изотонический раствор), в которую и помещается патматериал. Обычно эту смесь используют для консервирования кусочков паренхиматозных органов и тканей. Растворы глицерина менее пригодны для вируссодержащих жидкостей, особенно в тех случаях, когда этот материал нужно вводить животным, эмбрионам и в культуру клеток в неразведенном виде. Употребление глицерина делает невозможным исследование патологического материала методом иммунофлюоресценции. Поэтому одновременно с пробой патматериала необходимо направлять мазки-отпечатки, приготовленные и фиксированные на предметном стекле, для исследования в люминесцентном микроскопе.  Рисунок 4. Схема упаковки проб вируссодержащего материала, первичная емкость: 1 – емкость, содержащая пробу, пробирка с завинчивающейся пробкой с нетоксичной резиновой прокладкой, обернутой лейкопластырем, или запаянная стеклянная ампула; внутренняя упаковка 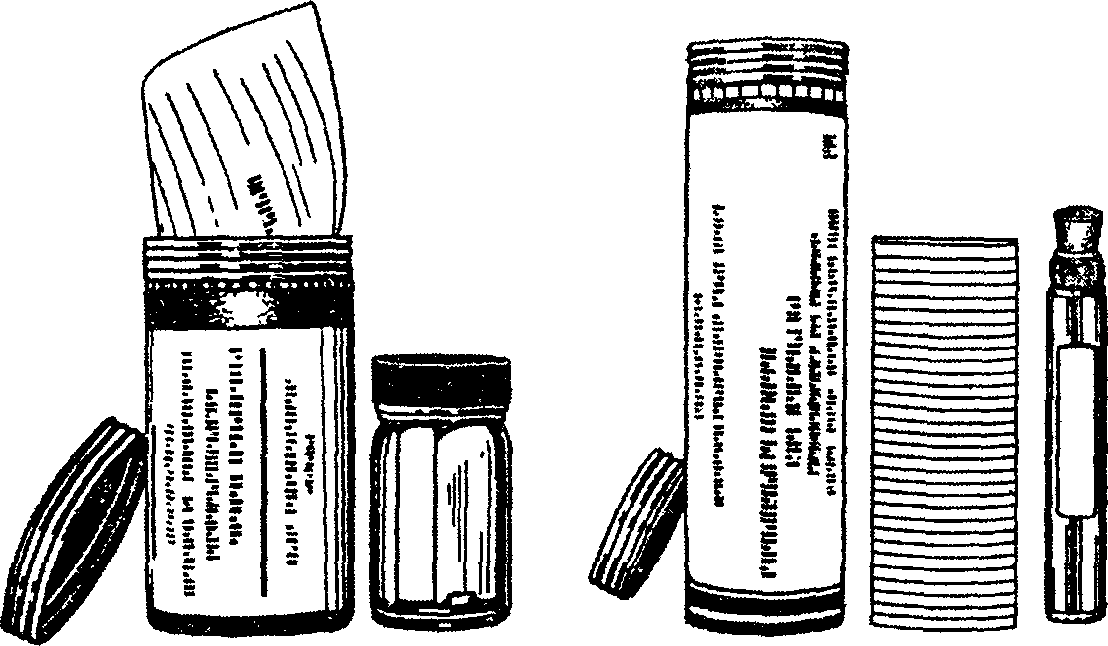 Рисунок 5. Контейнеры для перевозки-пересылки вирусологических проб В некоторых случаях возникает необходимость пересылки проб внутри области или страны, обмена пробами между диагностическими, научно-производственными или научно-исследовательскими лабораториями. В этом случае лаборатория, отправляющая материал, должна приготовить вируссодержащие пробы с максимальным титром. Это требование должно выдерживаться в случаях, если проводится идентификация вируса, если исходная лаборатория выделила вирус, но не в состоянии его идентифицировать, а другая лаборатория используется в качестве справочной для проведения полной идентификации. Вирус иногда удобно бывает послать в форме инфицированных культур клеток, которые не требуют сильного охлаждения. Культуры клеток должны быть предохранены от резких колебаний температур изолирующими материалами. Чтобы предупредить повреждение клеток от вспенивания, пробирка или пузырек должны быть полностью заполнены средой. Особое внимание необходимо обратить на то, чтобы пробки были нетоксичными, тщательно пригнанными и исключали утечку. Упаковка для радиоактивного меченого вируса или противовирусных антител должна отвечать требованиям, предъявляемым к перевозке радиоактивных материалов, при этом адекватный поглощающий материал должен действовать в качестве изолирующего средства, обеспечивающего медленное охлаждение пробы снаружи.  Рисунок 6. Предупреждающая этикетка для обозначения инфекционных субстанций, включая вирусные Сопроводительная к пересылаемому материалу должна иметь четкую маркировку (рис. 6). Указывают: фамилию и адрес грузоотправителя, фамилию и адрес грузополучателя. Эти два пункта должны быть четко разграничены; таможенную декларацию снабжают: предупреждающей этикеткой или этикеткой, рекомендованной ВОЗ для использования при международных перевозках; при пересылке меченых материалов – соответствующей этикеткой, предупреждающей о радиоактивной опасности. Могут потребоваться и другие этикетки типа «Срочно, не задерживать» или «Хранить в прохладном месте». Внутрь упаковки должны быть вложены дополнительная этикетка с описанием деталей материала, сопроводительный лист или перечень содержимого этой упаковки. Понятие о титре вируса. Единицы количества вируса: ООЕ, БОЕ, ЛД, ИД, ЭЛД, ЭИД, ЦПД, ГАЕ. Выражение в них титра вирусов. Титр – это количество вируса, содержащегося в единице объема материала. Из локальных повреждений, вызываемых вирусами, наиболее известны бляшки и оспины на ХАО КЭ. Если имеются данные обратные то инфекционная активность вируса может быть измерена в бляшкообразующих единицах (БОЕ) или оспообразующих единицах (ООЕ) 1БОЕ = дозе вируса, способной вызвать образование одной бляшки, а одна ООЕ – одной оспины. Методы: заражают несколько КК или КЭ на ХАО. Высчитывают среднеарифметическое количество оспин или бляшек. Оно = БОЕ или ООЕ вируса. Рассчитывают сколько БОЕ или ООЕ приходится на единицу объема вируссодержащего материала. Это и есть титр. Т=n/Va, где n-сред арифметическое бляшек или оспин, а –разведение материала, V – введенная доза. Метод 50%-ного инфекционного действия. За единицу количества вируса принимается доза, которая способна вызвать инфекционный эффект у 50% зараженных. Число таких доз в единице материала и будет выражать титр вируса в этом материале. Готовят 10 кратное разведение исследуемого материала, затем одинаковыми дозами заражают равные группы живых тест объектов. Учитывают результат действия и находят в каком разведение вирус проявил свое действие на 50%. Если сразу такое разведение не найдено то оно рассчитывается по формуле Т=lgB – (b-50)/(b-a) *lgd, где В – разведение дающие инфекционный эффект более 50%, b – процент дающий инфекционный эффект более 50%, а – менее 50% d – кратность разведения. За 1ГАЕ принимается такая доза вируса, которая способна агглютинировать примерно 50% эритроцитов содержащихся в том же, что и вирус объеме 1% суспензии отмытых эритроцитов. Готовят ряд последовательных кратных разведений материала и к каждому разведению добавляют 1% суспензию. Реакция оценивается в крестах. Реакция с 2 крестами содержит 1ГАЕ, которая умножается на кратность разведения. Титр вируса — это количество вируса, содержащееся в единице объема материала. Поскольку количество вируса невозможно выразить в обычно применяемых (объем, масса и т. п.) единицах, прибегают к измерению в единицах действия или единицах активности. Вирусы обладают инфекционным и гемагглютинирующим действием. Отсюда и единицы количества вирусов инфекционные и гемагглютинирующие. Размерность этих единиц зивисит от соотношения полноценных и неполноценных вирионов в используемой суспензии, объекта, способа титрования и других факторов. В практике нашли применение три типа единиц количества вируса: 1-й — инфекционные единицы локальных повреждений, вызываемых вирусами и оцениваемых по единичному эффекту; 2-й — инфекционные единицы 50%-ного действия вирусов на чувствительные живые объекты, оцениваемые статистически; 3-й — гемагглютинирующие единицы. Из локальных повреждений, вызываемых вирусами, наиболее известны бляшки в зараженных культурах клеток (островки мертвых клеток в слое живых) и оспины (некротические узелки) на ХАО куриных эмбрионов, зараженных оспенными и некоторыми другими вирусами. В случаях такого проявления инфекционной активности вирусов количество вируса может быть измерено в бляшкообразующих единицах (БОЕ) или оспообразующих единицах (ООЕ). Одна БОЕ равна дозе вируса, способной вызвать образование одной бляшки, а одна ООЕ — одной оспины. Наиболее универсален метод определения титра вируса в единицах 50%-ного инфекционного действия. По этому методу за единицу количества вируса принимается такая его доза, которая способна вызывать инфекционный эффект у 50 % зараженных тест-объектов. Она обозначается как ЭД50— эффективная 50%-ная доза. Число таких доз вируса в единице объема материала и будет выражать титр вируса в этом материале. Таблица 6. Виды единиц количества вирусов при определении по 50%-ному инфекционному действию
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
