Вирусология. вирь. Вакцин требует знаний структурных и функциональных особенностей вирусных антигенов, различаемых иммунной системой организма. Вирусными антигенами
 Скачать 2.43 Mb. Скачать 2.43 Mb.
|
|
Достоинства и преимущества ПЦР-диагностики инфекционных заболеваний Метод прямой и позволяет достичь предельно возможной чувствительности: от одного до нескольких возбудителей в пробе. Специфичность метода составляет 99-100 процентов. Для ПЦР-анализа пригоден любой материал, в том числе и гистологические препараты. Количество исследуемого материала, как правило, составляет несколько десятков микролитов. Высокая чувствительность метода позволяет контролировать эффективность проводимого лечения. ПЦР успешно используется при диагностике труднокультивируемых и некультивируемых возбудителей, а также хронических, латентных и персистентных форм инфекции. Длительность анализа не превышает 5-6 часов. Но наряду с достоинствами имеется определённый недостаток, который можно охарактеризовать как технологический. Подразумеваются повышенные требования к оснащению лаборатории, качеству тест-наборов и строжайшее соблюдение регламента исследования во избежание получения ложных результатов. Решение проблемы качества анализов возможно при соответствующей квалификации персонала и обязательной сертификации лаборатории. Разработка методик и испытание приборов и оборудования — один из этапов большой работы по внедрению ПЦР-методов в практику диагностических лабораторий. В связи с возрастающим интересом к ПЦР-диагностике внедрение её методов в систему государственной ветеринарной службы — дело сегодняшнего дня. Необходимо отметить, что перспективными направлениями являются определение антибиотикорезистентности клинических штаммов возбудителей, возможность количественного учёта результатов для контроля динамики инфекционного процесса, правильного выбора тактики лечения и оценки эффективности применяемых лекарственных средств. К настоящему времени ветеринарными специалистами уже разработаны тест-системы для диагностики методом ПЦР таких заболеваний, как туберкулёз, сибирская язва, лейкоз, чума крупного рогатого скота, бешенство, ящур, бруцеллез, кампилобактериоз, листериоз, хламидиоз животных, классическая чума свиней, респираторно-репродуктивный синдром свиней, парвовирусная инфекция свиней, энцефаломиокардит свиней, сальмонеллёз, стафилококкоз, микоплазмоз, болезнь Марека, реовирусная инфекция, болезнь Гамборо, инфекционный бронхит птиц, ньюкаслская болезнь; чума плотоядных, вирусный энтерит норок, вирусный гепатит утят и др. Реакция диффузной преципитации в агаровом геле. Достоинства и недостатки реакции и области возможного применения в вирусологии. При проведении реакции преципитации в гелевой среде на агаре (а не в жидкости) можно получить больше данных и количественно проанализировать содержание антигенов и антител. Такая реакция называется реакцией преципитации в геле или реакцией иммунодиффузии. Благодаря высокой аналитической чувствительности и исключительной простоте при постановке эта реакция используется, по-видимому, особенно часто при проведении всех иммунологических исследований. Реакцию преципитации в геле проводят в основном двумя способами. По методу одномерной диффузии один реагент, обычно антитела, равномерно смешивается с агаром, а антиген в физиологическом растворе затем диффундирует в гель. Наиболее удобный метод одномерной диффузии был предложен Оудином. По этому методу антисыворотку смешивают с расплавленным 0,6% -ным агаром, заливают в узкую опытную пробирку и оставляют для застывания агара. Затем в пробирку вносят антиген, и после его диффузии в агар в точке эквивалентности образуется преципитат (рис. 23). Агар вместе с сывороткой можно налить в чашку Петри. В такой модификации этот метод используется при проведении качественной реакции Манчини, описанной ниже (стр. 133). Для растворения агара его вначале нагревают до 100° С и затем после охлаждения, примерно до 45° С, когда он начинает образовывать гель, к нему добавляют сыворотку. Эта температура не оказывает отрицательного влияния па добавленную сыворотку, так как не вызывает повреждения антител. В реакции, поставленной по методу двойной диффузии в прозрачной агаровой пластинке, навстречу друг другу диффундируют два вещества, образуя преципитат на месте встречи. Согласно методу Экли—Фулторпа, реакцию проводят в пробирке. Вначале в пробирку вносят агар с сывороткой, на него наслаивают прозрачный агар и сверху вносят антиген. Однако чаще других применяется более удобный метод Оухтерлони. На физиологическом или буферном растворе готовят 1%-ный прозрачный агар, добавив в него азид натрия для предотвращения роста бактерий и грибков; после этого агар выливают в чашку Петри слоем толщиной до 3 мм. На поверхности застывшего агара вырезают лунки с помощью полого пробойника или сверла для пробок и в одну из соседних лунок заливают антиген, а в другую — антисыворотку. На месте встречи диффундирующего из этих лунок материала образуется линия преципитации (фото 16). При наличии множественной системы антиген — антитело образуется несколько линий. Указанное явление имеет исключительное значение для анализа антигенов. Особенно эффективен в этом смысле метод Оухтерлони, поскольку здесь устанавливается концентрационный градиент обоих мигрирующих из лунок компонентов реакции, что повышает резкость линий преципитации в точке эквивалентности. Кроме того, из-за различий антигенов по молекулярному размеру они диффундируют сквозь гель с разной скоростью. Комбинация всех этих явлений в сочетании с тем фактом, что концентрация компонентов в каждой системе бывает неодинаковой, обусловливают разграничение линий преципитации, соответствующих каждой отдельной системе антиген — антитело. Для идентификации линий преципитации, которые образуются при проведении теста по методу Оухтерлони, в одну из соседних лунок вносят известный антиген для получения реакции с той же антисывороткой. Затем находят идентичные линии преципитации, которые возникают между лунками (фото. 15). Полное совпадение этих линий (реакция идентичности) указывает на идентичность неизвестного материала используемому стандарту. Аналогичным образом можно установить присутствие такого материала в смеси других веществ. Поэтому реакция преципитации приобретает особое значение при определении примесей в биологических препаратах. Вследствие высокой специфичности иммунологических реакций установленное с их помощью сходство является лучшим подтверждением действительной идентичности двух использованных антигенных веществ. Если же эти линии пересекаются друг с другом (реакция неидентичности), это, в свою очередь, является достаточным подтверждением различия двух веществ (рис. 24). Иногда на месте пересечения линий можно увидеть шпоры. Наличие шпор указывает, что два антигена сходны по одним антигенным детерминантам, но различаются по другим. Реакция диффузионной преципитации по методу Оухтерлони широко используется в лаборатории для идентификации анализа биологических материалов. Несмотря на легкость постановки, эта реакция до сих пор не нашла диагностического применения, так как антитела инфицированных животных часто имеют относительно низкий титр и плохую способность к преципитации. Эту реакцию часто используют для определения антигена. Необходимые в данном случае антитела можно заранее приготовить и отобрать по их специфичности и преципитирующей способности. В таком плане реакция диффузионной преципитации оказалась пригодной для идентификации вируса чумы крупного рогатого скота и дифференциации заболеваний со сходной клиникой, например заболевания слизистых и злокачественный катар. В одну из лунок агаровой пластинки Оухтерлони помещают небольшой кусочек ткани лимфатического узла или его экстракт, а в две другие — стандартный антиген чумы крупного рогатого скота и сыворотку, которая будет преципитировать антиген. Если в результате реакции между сывороткой и каждым из антигенов образуется линия преципитации и эта линия дает реакцию идентичности, следовательно, животное, от которого были взяты лимфатические ткани, было заражено чумой крупного рогатого скота (фото 16). При идентификации заболевания слизистых в качестве источника антигена используют фрагменты тонкого кишечника и соответствующую антисыворотку. Таким же образом проводится определение антигенов вируса гепатита и чумы собак в патологическом материале от погибших собак и норок. При диагностике чумы собак можно использовать антисыворотку собак или кроликов к вирусу чумы собак, а также антисыворотку теленка, козы или кролика против чумы крупного рогатого скота (антигены которого дают перекрестную реакцию с антигенами вируса чумы собак). Для выявления антигенов к вирусу чумы собак лучше всего использовать ткани легких, лимфатических узлов и миндалин, а при подозрении на гепатит собак — печень. Кроме того, реакцию Оухтерлони можно применять для диагностики заболеваний домашней птицы и таких, как параличи, используя для этого кроличью антисыворотку к вызывающим эти заболевания вирусам. При работе с антисывороткой домашней птицы в агар для улучшения преципитации следует вводить до 9% NaCl. Реакцию диффузии в геле можно применять для диагностики заболевания у погибшей птицы, чтобы предупредить возможное распространение инфекции на оставшуюся часть стада. Точно так же при подозрении на одно из основных эпизоотических заболеваний крупных животных для получения соответствующего материала для реакции диффузии в геле можно убить зараженное животное. Иначе говоря, антиген для реакции получить довольно трудно, так как другие возможные их источники (моча, слюна, кожа и т. д.) не изучались с точки зрения их потенциальной пригодности для диагностических реакций подобного типа. Другая трудность состоит в том, что пока зараженное животное будет замечено, скорость образования его собственных антител может оказаться вполне достаточной, чтобы приостановить выделение антигена из тех мест, откуда он мог бы быть легко получен. Реконвалесценция, вирусоносительство и вирусовыделение. реконвалесценция (позднелат. reconvalescentia — выздоровление), выздоровление от той или иной болезни. Продолжительность Р. зависит от характера и тяжести болезни, иммунологической реактивности животного, условии его содержания и кормления и эффективности лечения. Выздоровление не всегда бывает полным. Определённое время отмечают признаки нарушения функции отдельных органов. В ряде случаев при отсутствии признаков болезни еще сохраняются патологические изменения органов и тканей. Поэтому при Р. животное может выделять во внешнюю среду возбудителей болезни. Микробоносительство(вирусоносительство), более или менее продолжительное пребывание возбудителей болезни в организме здорового животного; одна из форм инфекции.При М. нет патологических изменений каких-либо органов или функциональных расстройств, размножение микробов сдерживается на определённом уровне. Однако животные-микробоносители представляют опасность как потенциальные источники возбудителя инфекции. Такое истинное, или «здоровое», М. не связано с предшествующим переболеванием, не сопровождается иммунологической перестройкой организма и выявляется лишь с помощью бактериологических (вирусологических) исследований. Например, резистентные здоровые животные соответствующих видов могут быть носителями возбудителей пастереллёза, сальмонеллёзов, рожи свиней, мыта лошадей. Микробы в таких случаях локализуются на поверхности слизистых оболочек, в миндалинах, в лимфатических фолликулах кишечника и выделяются во внешнюю среду непостоянно и в сравнительно небольшом количестве. Вирулентность их обычно понижена. Однако снижение неспецифической устойчивости животных нередко ведёт к активизации этих микроорганизмов, повышению их вирулентности и развитию явной аутоинфекции. Предрасполагающими факторами могут быть скученное содержание животных, адинамия, длительная транспортировка, смена типа кормления и неполноценность рационов по белку, переохлаждение и перегревание, интоксикации, развитие других инфекций. Возможно также кратковременное «здоровое» носительство возбудителей болезней, не свойственных животным данного вида (вирус инфекционной анемии лошадей у кур и свиней, вирус чумы свиней у собак). Фактическое использование термина «М.» гораздо шире. Микробоносителями обычно называют животных, которые, будучи клинически здоровыми, представляют опасность как источник возбудителя какой-либо инфекции. В эту категорию входят животные, выделяющие патогенных микробов в инкубационном периоде болезни (чума свиней, ящур, бешенство), а также животные, оставшиеся носителями возбудителя после исчезновения симптомов перенесённой явной инфекции. В последнем случае М. называют реконвалесцентным и условно подразделяют на острое (длительностью до 3 мес) и хроническое. К микробоносителям относят и животных, у которых инфекция протекает скрыто, бессимптомно, что часто бывает при бруцеллёзе, туберкулёзе, паратуберкулёзе, сапе и инфекционной анемии лошадей. В подобных случаях, как и при реконвалесцентном М., с целью диагностики проводят не только бактериологические (вирусологические), но и серологические, аллергические исследования, а при вскрытии нередко находят очаги поражения отдельных органов. Эпизоотологическое значение животных — скрытых носителей возбудителей инфекции — заключается в стойкости поддерживаемых ими эпизоотических очагов, возникновении повторных вспышек болезни и зависит от вирулентности и количества выделяемых микробов, продолжительности выделения. Репродукция вирионов вирусов. Под адсорбцией принято понимать первичный контакт вируса с клеткой. Часто этот контакт сначала бывает очень слабым - обратимая адсорбция. Затем прочность контакта возрастает - необратимая адсорбция. Термин «проникновение» ошибочен потому, что он подразумевает активное воздействие на атакуемую клетку определенной части вириона, что не было доказано. Более вероятно, что во многих случаях на самом деле имеет место совсем другой процесс - прикрепление вируса к клетке вследствие физико-химической комплементарности между поверхностью вируса и молекулами рецепторов, находящихся на поверхности клетки, индуцирует в клетке изменения, необходимые для проникновения в нее вируса. Процесс начинается со случайных столкновений множества вирионов с поверхностью клетки. Участок связывания на поверхности вириона, непосредственно взаимодействующий с рецептором клетки, может состоять из индивидуального структурного вирусного белка, а может и представлять собой мозаику из нескольких белков капсида (по-видимому, именно так обстоит дело у пикорнавирусов). Рецептором во всех случаях служит расположенный на поверхности клетки белок или гликопротеид. На поверхности клетки имеются различные рецепторы, каждый из которых специфичен для своего вируса. Специфичность этих рецепторов не абсолютна, что приводит к возможности группировки вирусов по этому свойству в своеобразные «семейства». Следует подчеркнуть, что сам факт адсорбции вируса на клетке еще никоим образом не означает инициации вирусной инфекции. Связи, образующиеся при адсорбции между вирусом и клеткой, могут быть «слабыми»,, а адсорбция «обратимой», т.е. вирион может покидать поверхность клетки. Однако некоторые из адсорбировавшихся на клетке вирионов связываются с ней более прочными «необратимыми» связями. Следующий этап после прочного прикрепления вириона к поверхности чувствительной клетки - это проникновение внутрь клетки всего вириона или его части и начало синтеза вирус-специфического белка или вирусной м РНК. Проникновение вирионов в клетку и активация вирусного генома могут происходить у разных вирусов по-разному. Ясно, что вирусы с оболочкой и «голые» вирусы должны проникать в клетку в результате разных физико-химических процессов. Уже давно предполагали, что в основе проникновения в клетку вирусов с оболочкой, вероятно, лежит процесс, в какой-то мере подобный «плавлению мембраны», или процесс «слияния». Что же касается таких относительно больших белковых структур, как голые вирионы, то для них известен только один механизм проникновения в клетку - это фагоцитоз, и уже давно предполагается, что такие вирусы проникают в клетки в результате варианта фагоцитоза, названного «виропексисом». ДНК большинства ДНК-содержащих вирусов синтезируется в ядре клетки. Напротив, белки всех без исключения вирусов синтезируются в цитоплазме. Заражение клеток вирусами в принципе может привести к двум последствиям. Зараженная клетка может либо погибнуть, образовав при этом большое количество вируса (литический тип взаимодействия вирусов с клетками), либо продолжать жить и делиться, синтезируя небольшие количества вируса. Многие вирусы лизируют клетки очень редко, и обычно в зараженных клетках устанавливается состояние устойчивого равновесия - образуется персистентно инфицированная культура клеток. Установлено, что при успешной литической инфекции в зараженных клетках происходит пять четко отличающихся друг от друга событий, реализуемых функционально активными вирус-специфическими белками. Это следующие события: 1) подавление вирусом ряда клеточных функций; 2) синтез вирусных м РНК; 3) репликация вирусного генома; 4) морфогенез вирионов; 5) освобождение вирионов из клетки. Реакция иммунной флуоресценции, достоинства и недостатки реакции и области возможного применения в вирусологии. Метод иммунофлуоресценции называют еще РИФ, метод меченых антител. Принцип РИФ основан на использовании явления флюоресценции, который состоит в испускании света атомами вещества, поглотившими избыточную внешнюю энергию и пришедшими в состояние возбуждения. При этом используют люминесцентную микроскопию (рис. 7) 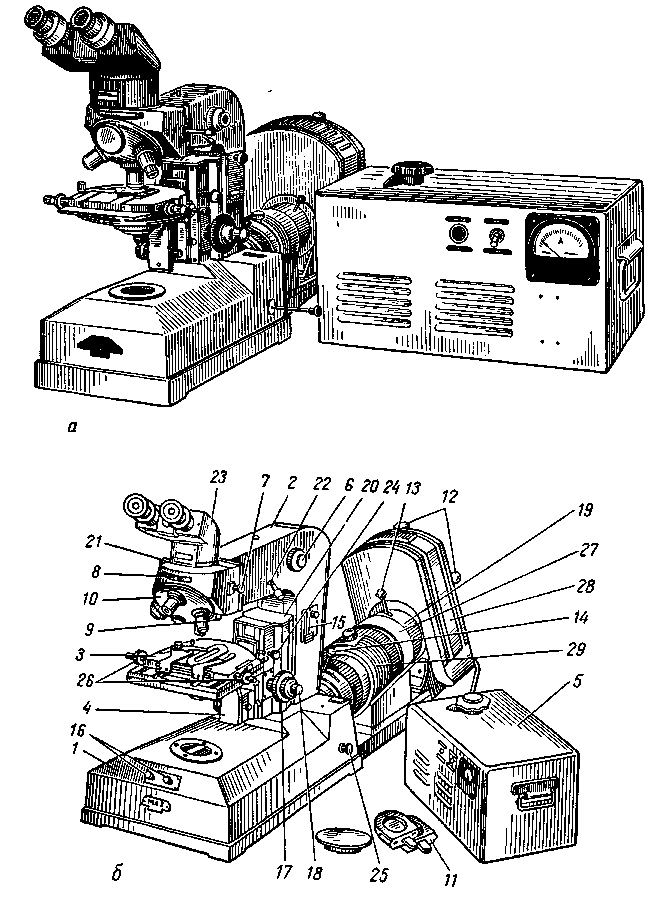 Рисунок 7. Люминесцентный микроскоп МЛ-2 В диагностических исследованиях методом РИФ в качестве объекта исследования могут быть мазки – отпечатки, срезы органов и тканей, соскобы, гистологические срезы, препараты тканевых культур. При прямом методе РИФ мазок - отпечаток обрабатывают сывороткой, меченной антителами, гомологичными тому вирусу, наличие которого предполагается. Если в мазке содержится антиген, гомологичный антителам сыворотки, то образуется комплекс антиген + антитело. Препараты отмывают, сушат и исследуют под люминесцентным микроскопом, который устроен так, что на препарат падает пучок сине-фиолетовых лучей, а в глаз наблюдателя попадают только желто-зеленые лучи, которые испускает комплекс антиген + антитело. По этому свечению и судят о наличии в материале антигенов, гомологичных антителам меченой сыворотки. Непрямой метод состоит в том, что мазок - отпечаток обрабатывают дважды: вначале немеченой антивирусной сывороткой, а затем после отмывания - меченной антивидовой. После второго отмывания препарат высушивают и исследуют под люминесцентным микроскопом. Обнаружение в препарате специфической флюоресценции указывают на наличие в материале антигенов, гомологичных использованной противовирусной сыворотке. По эффективности непрямой метод имеет преимущества перед прямым методом. В целом метод флюоресцирующих антител обладает рядом достоинств перед другими методами. Реакция нейтрализации, достоинства и недостатки реакции и области возможного применения в вирусологии. Второе место среди защитных реакций занимает реакция нейтрализации, которая служит для определения и характеристики иммунного состояния и его роли как механизма по выведению паразита и нейтрализации продуктов его распада и жизнедеятельности. Как правило, реакцию нейтрализации проводят путем смешивания сыворотки животного с патогенным организмом, по отношению к которому данное животное считается иммунным. После инкубации смесь исследуютin vivo или in vitro на наличие активного патогена. В этом случае, как и в реакции защиты, все присутствующие в сыворотке иммуноглобулины могут участвовать в реакции и проявлять тем самым свою активность in toto. По сравнению с большинством других реакций на антитела эта реакция не связана с каким-либо физическим проявлением, поскольку иммуноглобулины, активно разрушающие патогенный организм, могут не давать подобного эффекта. Реакция нейтрализации ничего не говорит об общем иммунном состоянии животного, так как в ней участвуют только гуморальные антитела, т. е., как и в большинстве других реакций, активность клеточной иммунной системы здесь не имеет значения. Однако реакция нейтрализации имеет преимущество перед реакцией защиты, заключающееся в том, что она не оказывает отрицательного действия на здоровье подопытного животного и может повторяться неоднократно. При проведении почти всех реакций нейтрализации для демонстрации явления нейтрализации необходима какая-нибудь живая система, будь то целостный организм или культура ткани. В некоторых случаях, таких, как реакция торможения гемагглютинации миксовирусов и вируса чумы крупного рогатого скота, реакция нейтрализации хотя и проводится с «живыми» эритроцитами, однако последние могут использоваться после хранения в условиях консервации. Реакцию нейтрализации можно полностью провести на одном животном, если патогенный организм ввести с одной стороны, а исследуемую сыворотку с другой стороны тела животного. Однако чаще всего этот организм (или токсин) и содержащие антитела растворы оставляют на некоторое время для взаимодействия in vitro и затем в смеси исследуют активность патогенного организма. Самые первые иммунологические реакции, использованные Фон Берингом и Китазато, принадлежали к реакциям именно такого типа. Эти исследователи установили, что антисыворотка, добавленная к столбнячному токсину, нейтрализует токсическое действие последнего, если смесь вводится морской свинке. С тех пор реакция нейтрализации интенсивно используется в работе с антитоксинными антителами, особенно с антителами против токсина клостридий; ее можно применять также при дифференциации видов внутри рода. Так, например, реакцию нейтрализации in vitro используют для быстрой идентификации Clostridium welchii. Выделяемый этим организмом токсин образует мутное кольцо вокруг колонии, растущей на агаре с сывороткой или яичным белком. Этот феномен называется реакцией Наглера. Он может быть подавлен без уничтожения организма, если до введения микроорганизма над агаровой пластинкой распылить специфический антитоксин. Токсины можно выделить и очистить и определить для них ЛД50 при помощи метода, описанного в главе 11. После этого путем титрования легко установить эффективность антисыворотки. Для этого растворы с серийным разведением сыворотки смешивают со стандартным количеством ЛД60 токсина и определяют токсическое действие каждой смеси путем инокуляции их группе подопытных животных, например мышей. Выживают те животные, которым введены низкие разведения антисыворотки и соответственно количество антител, достаточное для того, чтобы нейтрализовать токсин. За конечную точку титрования можно выбрать точку, соответствующую такому разведению сыворотки, когда она защищает от гибели только 50% мышей. Аналогичным образом реакцию нейтрализации можно применить для титрования антител к бактериям, но особенно полезной она оказалась в работе с вирусами. Причина этого заключается в том, что в последнем случае используется качественная методика культуры ткани, которую можно поддерживать в строго стандартных условиях. Поэтому каждый образец культуры ткани может быть идентичным другим до такой степени, которой нельзя добиться с любыми неинбредными стерильными животными. Другое преимущество реакции нейтрализации заключается в том, что для ее проведения требуется значительно меньше вируса, чем для реакции агглютинации, преципитации или связывания комплемента. 50%-ную тканевую цитопатогенную дозу вируса ТЦД50 можно определить точно так же, как это делается при измерении ЛД50 или ИД50. Используемый в этом случае метод основан на том факте, что если тканевую культуру инфицировать вирусом, который способен в ней развиваться, то о наличии большинства инфекций можно судить по появлению признаков цитопатогенного действия па клеточном монослое. В чашке Петри легко увидеть «бляшки» разрушенных клеток на участке взаимодействия отдельной вирусной частицы с монослоем клеточной культуры. Если подобный эффект отсутствует, то о наличии инфекции судят по другим признакам, например адсорбции эритроцитов на поверхности культуры клеток. В ходе предварительной инкубации с каждым из серийных разведений антисыворотки должно взаимодействовать точно измеренное количество вирусной суспензии, чтобы определить то наименьшее разведение сыворотки, которое уменьшает или полностью устраняет цитопатогенный эффект в результате нейтрализации вируса. Этим способом можно точно определить активность противовирусных антител, т. е. данный метод становится, таким образом, важным средством для измерения нейтрализующей активности сыворотки. По этой причине особенно широко реакция нейтрализации применяется в вирусологии при идентификации вирусов. Однако, при всех своих достоинствах, этот метод требует много времени, исключительной лабораторной отработки и тщательного внимания к деталям. Реакция непрямой гемагглютинации, достоинства и недостатки реакции и области возможного применения в вирусологии. 14.1 Методика постановки РНГА. Она включает: а) приготовление сенсибилизированных эритроцитов (подготовка эритроцитов, их фиксация, танизация и сенсибилизация); б) постановку главного опыта РНГА. Обычно в ветеринарных лабораториях ставят только главный опыт, а сенсибилизированные эритроциты готовят на предприятиях биологической промышленности. Процесс приготовления сенсибилизированных эритроцитов (эритроцитарного диагностикума): 1) подготовка эритроцитов. Для этой цели наиболее широко применяют эритроциты барана и человека. В настоящее время чаще применяют эритроциты птиц – кур, индеек, уток; приготовленные на них диагностикумы быстрее оседают, что позволяет сократить сроки исследования без потери чувствительности. От соответствующего вида животного берут кровь общепринятым методом. Дефибринированную кровь трижды отмывают изотоническим раствором хлорида натрия при центрифугировании; 2) фиксация эритроцитов. Преимущество фиксированных эритроцитов в том, что они могут быть заготовлены впрок и длительное время храниться в суспензии, не подвергаясь гемолизу. Для фиксации эритроцитов чаще всего используют формальдегид, глутаровый или акриловый альдегиды. Методики фиксации эритроцитов различны. Одна из них: 50%-ную взвесь отмытых эритроцитов соединяют с равным объемом 50%-ного формалина и после двухчасового контакта при 37 °С с периодическим встряхиванием эритроциты 3 раза отмывают 0,15 M/NaCl (pH 7,2); 3) танизация эритроцитов. Механизм действия танина на эритроциты малоизучен. Однако при этом достигается главное – танизированные эритроциты обладают значительно большей сорбционной емкостью белков. Танизацию формалинизированных эритроцитов осуществляют путем смешивания равных объемов 3%-ной взвеси эритроцитов и раствора танина (1:20000). После 10–15-минутного контакта при 37°С смесь центрифугируют, осадок трехкратно промывают фосфатным буфером (рН 7,2); 4) сенсибилизация эритроцитов. 10%-ную концентрацию эритроцитов на 0,15 М фосфатном буфере (рН 6,4) смешивают с равным объемом вируссодержащей жидкости. Смесь выдерживают 60 мин при 37 °С, периодически встряхивая, затем центрифугируют и 2–3 раза отмывают. Осадок сенсибилизированных эритроцитов разводят до 1%-ной концентрации в фосфатном буферном растворе (рН 7,2), содержащем 1% нормальной кроличьей сыворотки (для стабилизации эритроцитов). Полученные таким образом сенсибилизированные эритроциты используют в РИГА. Необходимо отметить, что оптимальную сенсибилизирующую дозу антигена (для разных вирусов) подбирают эмпирически в пробных опытах сенсибилизации эритроцитов. 14.2 Главный опыт РНГА. Реакцию ставят в пробирках или в лунках плексигласовых панелей. В последнее время РНГА ставят микрометодом, используя аппарат Такачи (рис. 30), Титертек или автоматические пипетки (1-, 8-, 12-канальные) с изменяющимися объемами (рис. 31). Исследуемые и контрольные сыворотки прогревают при 56 °С 30 мин. 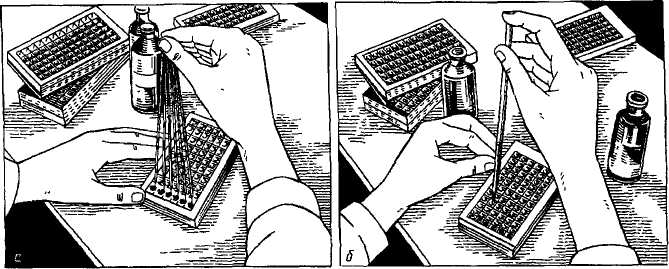 Рисунок 30. Аппарат Такачи Исследуемую сыворотку разводят двукратно в объеме 0,2 мл физиологическим раствором с рН 7,2–7,4, содержащим 1% нормальной сыворотки кролика, затем к каждому разведению сыворотки добавляют по 0,2 мл сенсибилизированных антигеном эритроцитов. 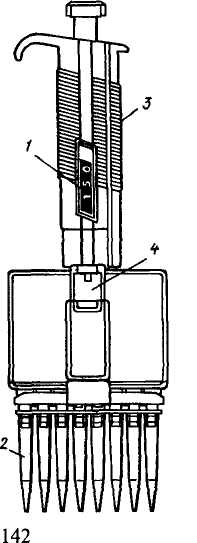 Рисунок 31. Многоканальная автоматическая пипетка 1 – регулятор объема; 2– наконечники; 3 – рабочая рукоятка; 4 – сбрасыватель наконечников Смесь встряхивают и выдерживают при комнатной температуре. Учет проводят через 2–3 ч по осаждению эритроцитов в контроле. Опыт сопровождают следующими контролями: 1) на спонтанную гемагглютинацию эритроцитарного антигена (сенсибилизированные эритроциты + физиологический раствор с 1 % кроличьей сыворотки); 2) на активность сенсибилизированных эритроцитов (сенсибилизированные эритроциты + положительная сыворотка); 3) на специфичность сенсибилизированных эритроцитов(сенсибилизированные эритроциты + нормальная сыворотка или другая негомологичная для данного антигена сыворотка); 4) на отсутствие в сыворотках неспецифических гемагглютининов (исследуемые сыворотки + несенсибилизированные эритроциты). Результаты реакции оценивают по четырехбалльной шкале: (+++) – агглютинированные эритроциты образуют перевернутый «зонтик» с неровными краями; (++) – по краю агглютинированных эритроцитов намечается тонкое кольцо из неагглютинированных эритроцитов; (+) – по краю агглютинированных эритроцитов располагается широкое кольцо из неагглютинированных эритроцитов; (–) – эритроциты оседают на дно в виде диска или колечка – отрицательный результат. При положительной реакции эритроциты равномерно распределяются по дну пробирки или луночки в виде зонтика, а при отрицательной – оседают в виде компактного осадка или колечка в центре луночки. Достоверные результаты получают при отсутствии гемагглютинации: испытуемой сыворотки с несенсибилизированными эритроцитами, диагностикума с заведомо отрицательной сывороткой, при положительной реакции диагностикума с заведомо положительной сывороткой. За титр антител в сыворотке принимают наибольшее ее разведение, которое еще вызывает агглютинацию сенсибилизированных эритроцитов. Таким образом, РНГА позволяет решать следующие диагностические задачи: а) обнаруживать антитела и определять их титр в сыворотках крови. Для этого используют эритроциты, сенсибилизированные вирусом; б) обнаруживать и идентифицировать вирусный антиген. Для этого используют эритроциты, сенсибилизированные антителами. Достоинства РНГА: высокая чувствительность (по этому показателю она превосходит РДП, РСК и близка к иммуноферментному методу), простота техники постановки и быстрота ответа (через 2– 3 ч). Однако есть и недостатки. Это трудности в приготовлении стабильных эритроцитарных диагностикумов (большая зависимость от чистоты компонентов, необходимость подбора режима сенсибилизации для каждого вида вируса и т. д.). Роль вирусов в инфекционной патологии животных, растений и человека. Реакция связывания комплемента, достоинства и недостатки реакции и области возможного применения в вирусологии. Из всех иммунологических реакций наиболее широкое применение имеет реакция связывания комплемента. Она высоко чувствительна и, самое главное, не зависит от наличия известных, определенных антигенов и антител. Все что необходимо для проведения данной реакции — это взаимодействие между антигеном и антителом. Добавленный к смеси комплемент фиксируется на образовавшемся комплексе и таким образом расходуется в реакции. Следовательно, если смешать сыворотку с комплементом, по исчезновению последнего можно установить, специфична ли сыворотка для данного антигена. При этом природа истинного антигена, присутствующего в составе грубого экстракта, который используется в реакции как антиген, может быть совершенно неизвестной. Например, если животное заражено болезнью с неизвестной этиологией, его ткани можно использовать в качестве антигена в реакции связывания комплемента с сывороткой переболевших животных. Таким образом, можно найти хороший источник антигена и применять его в тестах для выявления антител к данному антигену у всей популяции животных. Таким путем можно установить эпидемиологию заболевания, если даже у ветеринаров имеются лишь ограниченные сведения о точной природе идентифицируемого патогенного организма. С реакцией агглютинации подобное обследование осуществить невозможно. Реакция преципитации в этом случае дает возможность только наблюдать за появлением линий преципитации между тканевым экстрактом и сывороткой реконвалесцента при диффузии в геле. Однако эта реакция мало чувствительна, если заболевание было вызвано организмом, который не вырабатывает растворимых и способных к диффузии в геле продуктов, т. е. в этом случае линии преципитации может и не быть. Поэтому связывание комплемента представляет собой исключительно важную и основную диагностическую реакцию, которая может применяться при исследовании любого заболевания, сопровождающегося иммунным ответом. К сожалению, эта реакция довольно сложна и непригодна для постоянного пользования, тем более, что один из ее участников — комплемент представляет собой нестабильное вещество, для которого требуются специальные условия хранения. Поэтому, как только заболевание будет точно диагностировано и получен очищенный антиген, РСК можно заменить более простыми диагностическими реакциями, такими, как преципитация или агглютинация, которые сразу дают видимый результат. Известно лишь несколько случаев, когда РСК неприменима. Ее нельзя использовать для определения антител тех классов иммуноглобулинов (например, IgA и IgE), которые не связывают комплемент, а также в случаях, если антигеном является токсин, лизирующий эритроциты индикаторной системы; она непригодна для диагностики состояния гиперчувствительности или реакций Клеточного иммунитета. Кроме того, сыворотка некоторых птиц не фиксирует комплемент, так что в этих случаях более эффективна специальная непрямая реакция связывания комплемента (стр. 151). Иногда в сыворотке и в составе антигена могут присутствовать неспецифические факторы, которые в значительной мере искажают реакцию. Они разрушают или «перехватывают» комплемент на пути связывания его с комплексом антиген — антитело и поэтому называются антикомплементарными факторами. Если они присутствуют в большом количестве, то реакция вообще может оказаться безрезультатной. Реакция торможения гемагглютинации, достоинства и недостатки реакции и области возможного применения в вирусологии. Принцип РТГА состоит в том, что в пробирке смешивают равные объемы сыворотки крови и суспензии вируса и после экспозиции определяют, сохранился ли в смеси вирус, путем добавления суспензии эритроцитов. Агглютинация эритроцитов указывает на наличие, а отсутствие гемагглютинации – на отсутствие вируса в смеси. Исчезновение вируса из смеси вирус + сыворотка расценивается как признак взаимодействия антител сыворотки и вируса. Но антитела с антигенами взаимодействуют в строго определенных количественных соотношениях. Поэтому, для того чтобы определенное количество вируса было лишено гемагглютинирующей способности, требуется определенный минимум антител, а так как один из компонентов РТГА всегда неизвестен, приходится реакцию ставить в ряду пробирок с различными дозами антител и одинаковыми дозами вируса или наоборот. Это достигается тем, что берут или разные разведения сыворотки и одно и то же разведение вируса, или разные разведения вируса и одно и то же разведение сыворотки. РТГА позволяет решать следующие задачи: определять титр антител к гемагглютинирующему вирусу в сыворотке; идентифицировать неизвестный гемагглютинирующий вирус по известным сывороткам; установить степень антигенного родства двух вирусов. Достоинства РТГА: простота техники, быстрота, не требуется стерильной работы, специфичность, дешевизна. Недостаток: РТГА возможна только с гемагглютинирующими вирусами. Принцип титрования антител в РТГА состоит в следующем: – готовят ряд последовательных (обычно 2-кратных) разведений исследуемой сыворотки в одинаковых объемах (чаще по 0,25 или 0,2 мл); – к каждому разведению добавляют такие же объемы гомологичного вируса в титре 4 ГАЕ; – смеси выдерживают определенное время при определенной температуре (для вируса ньюкаслской болезни 40–60 мин при комнатной температуре); – ко всем смесям добавляют равные объемы 1%-ной суспензии отмытых эритроцитов; – после экспозиции оценивают гемагглютинацию в каждой смеси в крестах. В реакции предусматриваются контроли сыворотки, вируса и эритроцитов. То наивысшее разведение сыворотки, которое еще полностью тормозит гемагглютинацию, принимается за показатель титра антител в этой сыворотке. Использование в вирусологии реакции гемадсорбции. РГАд.Гемадсорбция – соединение эритроцитов с поверхностью пораженных вирусом клеток – впервые была обнаружена Фогелем и Щелоковым (1957) на культуре ткани, инфицированной вирусом гриппа. В основе этого явления лежит родство рецепторов вируса, находящихся на поверхности пораженной клетки, с рецепторами эритроцита, что приводит к их взаимному сцеплению аналогично реакции гемагглютинации. Преимущество этой реакции состоит в том, что она становится положительной еще до появления отчетливых цитопатических изменений в инфицированных клетках. Методика РГАд состоит в следующем. На 3–4-й день после инфицирования клеток берут две пробирки с одинаковой культурой клеток, из которых одна заражена вируссодержащим материалом, а вторая контрольная. Из обеих пробирок сливают культуральную жидкость и вносят в обе по 2–3 капли 0,5%-ной суспензии отмытых эритроцитов. Обе пробирки оставляют на 5–10 мин так, чтобы эритроциты были на поверхности клеток (кладут горизонтально на стол), а затем слегка споласкивают физраствором и исследуют под микроскопом (малое увеличение). В контрольной пробирке эритроциты полностью удаляются с физраствором, а некоторые из оставшихся плывут вместе с жидкостью. Если в зараженной пробирке эритроциты не удалились с физраствором и не плывут, а прикреплены к поверхности клеток, следует считать РГАд положительной. В зависимости от вируса и вида клеток расположение эритроцитов может быть трояким: – эритроциты адсорбированы только по периферии клеточного пласта в виде «ожерелья» (вирус африканской чумы свиней); – эритроциты расположены на слое клеток очагами или скоплениями (вирус гриппа); – эритроциты расположены на слое клеток диффузно (вирус парагриппа). Каждый вирус способен адсорбировать эритроциты крови животных определенных видов. Серологическая диагностика вирусных болезней по приросту титра антител в парных сыворотках крови. Систематика вирусов. Принцип систематики, ее научная и практическая ценность. Вирусы отнесены к царству Vira. В основу их классификации положен тип нуклеиново кислоты, образующей геном. Соответственно выделяют рибовирусы (РНК-вирусы) и дезоксирибовирусы (ДНК-вирусы). Для вирусов предложены следующие таксономические категории (по восходящей): Вид (Species) —> Род (Genus) —> Подсемейство (Subfamilia) —> Семейство (Familia). Но категории подсемейств и родов разработаны не для всех вирусов. Видовые названия вирусов обычно связывают с вызываемыми ими заболеваниями (например, вирус бешенства) либо по названию места, где они были впервые выделены (например, вирусы Коксаки, вирус Эбола). Если семейство включает большое количество видов, то видовые названия дают в соответствии с антигенной структурой и разделяют их на типы (например, аденовирус 32 типа или вирус герпеса 1 типа). Реже используют фамилии учёных, впервые их выделивших (например, вирус Эпстайна-Барр или вирус саркомы Рауса). Иногда используют устаревшие названия групп вирусов, отражающих их уникальные эпидемиологические характеристики (например, арбовирусы). Классификационные признаки патогенных для человека вирусов приведены в табл. 3-1. Таблица 3-1.Семейства вирусов, включающие возбудителей инфекций человека 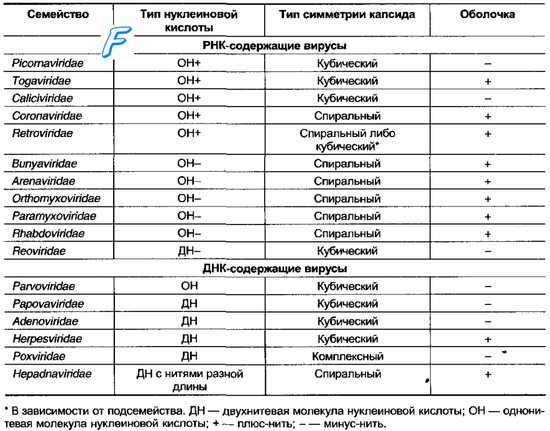 К вирусам отнесены вироиды [от virus и греч. eidos, сходство] — мелкие кольцевые однонитевые суперспирализованные молекулы РНК (аналогичную организацию имеет геном вируса гепатита D). Поскольку у вироидов нет белковой оболочки, они не проявляют выраженных иммуногенных свойств, и поэтому их нельзя идентифицировать серологическими методами. Вироиды вызывают заболевания у растений. В качестве безымянного таксона в царство Vira также включены и прионы. |
