Вирусология. вирь. Вакцин требует знаний структурных и функциональных особенностей вирусных антигенов, различаемых иммунной системой организма. Вирусными антигенами
 Скачать 2.43 Mb. Скачать 2.43 Mb.
|
Основные критерии таксономической классификации вирусовПри систематизировании вирусов выделяют следующие основные критерии: сходство нуклеиновых кислот, размеры, наличие или отсутствие суперкапсида, тип симметрии нуклеокапсида, характеристика нуклеиновых кислот (молекулярная масса, тип кислоты (ДНК или РНК), полярность [плюс или минус], количество нитей в молекуле либо наличие сегментов, наличие ферментов), чувствительность к химическим агентам (особенно к эфиру), антигенная структура и иммуногенность, тропизм к тканям и клеткам, способность образовывать тельца включений. Дополнительный критерий — симптоматология поражений: способность вызывать генерализованные поражения либо инфекции с первичным поражением определённых органов (нейроинфекции, респираторные инфекции и др.). Специфическая профилактика вирусных болезней животных. Специфические факторы противовирусного иммунитета и их формирование. 1.Противовирусный иммунитет связан с своеобразными защитными механизмами, т.к. вирусы не способны развиваться и размножаться в неживой клетке. Защитное приспособление организма направлено на 2 формы существования вируса. На внеклеточный вирусные неспецифические и специфические факторы иммунитета, на внутриклеточную форму – процесс фагоцитоза. При вирусных инфекциях он всегда незавершенный, интерферон оказывает экзогенное действие на внеклеточную форму, вирусы теряют способность адсорбции, эндогенный интерферон синтезируется в клетках в ответ на вирусный АГ. 2.Средства и методы воздействия на вирусы может быть эффективными только на определенных стадиях существования вируса, что ярче всего проявляется при лечении больных иммунными препаратами, т.к. АТ не способны проникнуть внутрь клеток. 3.Противовирусный иммунитет является более продолжительным по сравнению с бактериальным, а при отдельных вирусных инфекциях он пожизненный (чума КРС, собак, катаральная лихорадка овец, оспа). Противовирусный иммунитет. Отличие противовирусного И. от других видов И. (против бактерий, простейших, грибков и т.д.) связано со своеобразием структуры и размножения вирусов, особенностями патогенеза вирусных инфекций. Видовой противовирусный И. обусловлен отсутствием у клеток данного вида организмов рецепторов для прикрепления (адсорбции) соответствующих вирусов или их неспособностью репродуцироваться после проникновения в клетку, наличием неспецифических ингибиторов и нуклеаз в сыворотке крови, множеством других факторов. Немаловажную роль в защите от вирусов играет воспалительная реакция, направленная на ограничение распространения вирусов в организме и фиксацию их в воротах инфекции. При этом помимо клеток крови (макрофагов, естественных киллеров) противовирусный эффект оказывают такие универсальные реакции на внедрение вирусов, как общее или локальное повышение температуры и увеличение кислотности среды. Приобретенный противовирусный И. формируется в результате перенесенного заболевания или иммунизации организма с помощью вакцин. Он определяется сочетанием специфических факторов (иммуноглобулинов, В- и Т-лимфоцитов) и факторов неспецифической (естественной) резистентности (воспалительной реакции, интерферонов, противовирусных ингибиторов, естественных киллеров, макрофагов и др.). Так, термолабильные сывороточные -ингибиторы (-липопротеины) обладают инактивирующим действием против широкого круга вирусов. Уровень содержания в сыворотке этих ингибиторов взаимосвязан с резистентностью организма к вирусному заражению. У новорожденных и детей первого года жизни он низок, чем в известной степени восприимчивость объясняется к вирусам. Та же закономерность характерна для интерферонов — важнейших факторов неспецифической резистентности. Практически все вирусы обусловливают выработку интерферонов, их образование является одной из первых защитных реакций организма на внедрение вирусов. Интерфероны в отличие от антител подавляют внутриклеточные этапы репродукции вирусов в зараженных клетках и обеспечивают невосприимчивость к вирусам окружающих здоровых клеток. Попадая из ворот инфекции в кровь, интерфероны распределяются по организму, предотвращая последующую диссеминацию вирусов. Таким образом, факторы неспецифической резистентности в сочетании с медиаторами воспаления способны разрушать инфицированные вирусами клетки. Если этого не происходит и вирусы размножаются, наступает вторая (специфическая) стадия противовирусного И., связанная с продукцией вируснейтрализующих антител В-лимфоцитами и активацией регуляторных Т-лимфоцитов (Т-хелперов, Т-супрессоров, цитотоксических лимфоцитов), а также обширного круга Т-лимфоцитов — эффекторов лимфоцитарно-моноцитарного ряда. Интенсивность противовирусного И. определяется сложной системой межклеточных и медиаторных отношений, меняющейся в зависимости от индивидуального иммунного статуса человека и особенностей конкретного возбудителя. При острых (явных) инфекциях (гриппе, полиомиелите и др.) вскоре после контакта вирусов с клетками начинается разрушение последних. В этих случаях болезнь развивается быстро. При латентных (хронических, дремлющих, медленных инфекциях) вирусы могут оставаться в клетках неопределенно долгое время, не оказывая характерного повреждающего действия. Одним из механизмов такой персистенции может быть интеграция или встраивание генетическою материала (ДНК, РНК) вирусов в геном клетки. Под влиянием провоцирующих факторов (охлаждение, воздействие ионизирующего излучения, стрессы и др.) скрытая бессимптомная инфекция переходит в явное заболевание. Между этими двумя крайними видами взаимодействия вирусов с клетками существует множество переходных форм. Наблюдается широкая индивидуальная вариабельность и способности организма к иммунному ответу. Уровень специфической и неспецифической резистентности помимо возможных врожденных дефектов определяется множеством других факторов (возраст, стрессы, питание, суточный биоритм, время года и т.д.). В отдельных случаях вирусы несколько видоизменяются и т.о. избегают нейтрализующего действия антител и других специфических механизмов иммунной защиты. Это явление, называемое антигенным дрейфом, особенно хорошо изучено в отношении вируса гриппа. В большинстве случаев основная роль в развитии противовирусного И. принадлежит регуляторным Т-лимфоцитам, осуществляющим контроль за антителообразующими В-лимфоцитами и эффекторными Т-лимфоцитами. Способность многих вирусов размножаться и разрушать клетки иммунной системы или подавлять их функции приводит к иммуносупрессии и может способствовать переходу острой инфекции в хроническую форму. Так, поражение вирусами макрофагов вызывает подавление их антигенпрезенттирующей функции и приостанавливает дальнейший иммунный ответ; взаимодействие вирусов с антигенными детерминантами главного комплекса гистосовместимости изменяет клеточные мембраны и вызывает дефектность цитотоксических микроцитов; заражение В-лимфоцитов вирусами герпеса может вызвать их поликлональную активацию и резкое увеличение числа инфицированных клеток. Другим результатом поликлональной стимуляции В-лимфоцитов является образование полиспецифических иммуноглобулинов классов G и М, которые могут взаимодействовать с клетками и тканями внутренних органов и провоцировать развитие аутоиммунного процесса. Наконец, поражение вирусами делящихся Т-хелперов при ВИЧ-инфекции резко снижает, вплоть до полного выключения, иммунную защиту. Более того, вирусы могут подавлять образование лимфокинов и тем самым нарушать нормальное функционирование иммунной системы. Повышение невосприимчивости к вирусным инфекциям достигается вакцинацией, использованием интерферонов и их индукторов, иммуномодуляторов, с помощью различных химиопрепаратов. Исторически первым и надежным способом, приводящим к активации иммунитета, является вакцинация. Продолжительность противовирусного И. при вакцинации широко варьирует Наиболее длительную защиту обеспечивают вакцины против кори и желтой лихорадки (более 15 лет, возможно, пожизненно); эффект вакцин против полиомиелита, краснухи и эпидемического паротита сохраняется 5—8 лет, меньше длительность И. при гриппе (1—2 года). Однако возможности противовирусной вакцинации не беспредельны, т.к. большое число прививок может вести к развитию аллергических реакций, а при заболеваниях, вызываемых множеством вирусов (например, причиной острых респираторных заболеваний являются около 150 вирусов различных таксономических групп), вакцинация не дает желаемого эффекта. В этих случаях на первое место выдвигаются способы повышения неспецифической резистентности. Интерфероны, иммуномодуляторы и химиопрепараты, не обладающие узкой специфичностью вакцин, можно использовать в тех случаях, когда вакцины отсутствуют или их применять поздно (заражение уже произошло). Как правило, эффект лечения тем выше, чем раньше оно начато, поэтому перечисленные препараты следует вводить при появлении первых признаков вирусного заболевания (в 1—2-й дни болезни). Интерфероны, их индукторы и иммуномодуляторы оказывают выраженное активирующее влияние на систему И., принимая участие практически во всех его реакциях; они могут увеличивать образование антител, стимулировать фагоцитоз, усиливать цитотоксическую активность лимфоцитов, подавлять гиперчувствительность замедленного типа, влиять на процессы реализации иммунологической памяти. Структура и химический состав вирионов вирусов. Вирусы устроены очень просто. Они состоят из фрагмента генетического материала, либо ДНК, либо РНК, составляющей сердцевину вируса, и окружающей эту сердцевину защитной белковой оболочкой, которую называют капсидом. Полностью сформированная инфекционная частица называется вирионом. У некоторых вирусов, таких, как вирусы герпеса или гриппа, есть еще и дополнительная липопротеидная оболочка, которая возникает из плазматической мембраны клетки-хозяина. В отличие от всех остальных организмов вирусы не имеют клеточного строения. Оболочка вирусов часто бывает построена из идентичных повторяющихся субъединиц – капсомеров. Из капсомеров образуются структуры с высокой степенью симметрии, способные кристаллизироваться. Это позволяет получить информацию об их строении с помощью рентгеновских лучей и с помощью электронной микроскопии. Как только в клетке-хозяине появляются субъединицы вируса, они сразу же проявляют способность к самосборке в целый вирус. Самосборка характерна и для многих других биологических структур, она имеет фундаментальное значение в биологических явлениях. Непременным компонентом вирусной частицы является какая-либо одна из двух нуклеиновых кислот, белок и зольные элементы. Эти три компонента являются общими для всех без исключения вирусов, тогда как остальные липиды и углеводы - входят в состав далеко не всех вирусов. Вирусы, в состав которых наряду с белком и нуклеиновой кислотой входят также липиды и углеводы, как правило, принадлежат к группе сложно устроенных вирусов. Кроме белков, входящих в состав нуклеопротеидного «ядра», вирионы могут содержать еще вирус - специфические белки, которые были встроены в плазматические мембраны зараженных клеток и покрывают вирусную частицу, когда она выходит из клетки или «отпочковывается» от ее поверхности. Кроме того, у некоторых вирусов с оболочкой существует субмембранный матриксный белок между оболочкой и нуклеокапсидом. Вторую большую группу вирус-специфических белков составляют некапсидные вирусные белки. Они в основном имеют отношение к синтезу нуклеиновых кислот вириона. Ещё одним компонентом являются углеводы (в количестве, превышающем содержание сахара в нуклеиновой кислоте). Парамиксовирусы, размножающиеся в различных клетках, могут содержать и соответственно разные липиды. Поэтому специфика вирусной оболочки зависит от вирусных гликопротеидов, находящихся на ее поверхности. У бактериофагов и вирусов животных и растений обнаружены полиамины. Возможно, что их единственная физиологическая функция состоит в нейтрализации отрицательного заряда нуклеиновой кислоты. Например, вирус герпеса содержит достаточно спермина, чтобы нейтрализовать половинку вирусной ДНК, а в вирусной оболочке, кроме того, присутствует спермидин. Типы вирусных геномов. Структурные (вирионные) и неструктурные белки вирусов, их свойства и отличия от клеточных белков, их функции. Химический состав вирусов отличается от других форм жизни необычайной простотой. Кроме геномной ДНК или РНК вирусы позвоночных содержат белки, масса которых составляет 57—90% массы вириона. Количество вирионных белков может колебаться в широких пределах в зависимости от сложности строения вируса. Среди белков, кодируемых вирусным геномом, различают структурные и неструктурные вирусспецифические белки. Первые входят в структуру вириона, вторые не входят. Структурными белками являются капсидные белки, белки оболочки и в некоторых случаях белки тегумента и ферменты. У многих вирусов некоторые структурные вирусные белки не являются первичными продуктами генов, а образуются в результате посттрансляционного расщепления полипептида-предшественника вирусспецифическими и клеточными протеазами. Неструктурными вирусными белками являются белки, кодируемые вирусным геномом, но не являющиеся составными частями вириона. Одни из них участвуют в репликации вирусных компонентов, другие — в сборке вирионов, третьи нарушают нормальный клеточный синтез. Они включают различные типы репликаз, связанные с репликацией ДНК, транскриптазы, транскрибирующие мРНК на геномной дцДНК или дцРНК или (-)оцРНК, вирусные протеазы, геликазы и лигазы. У ретро- и гепаднавирусов найдена обратная транскриптаза, транскрибирующая ДНК на матрице РНК. У ретровирусов найден уникальный фермент, участвующий в интеграции ДНК-продукта в хромосомальную ДНК клетки. Вирусы оспы, которые размножаются в цитоплазме и имеют много уникальных ферментов для процессинга РНК-транскриптов и репликации вирусной ДНК, мало зависят от метаболизма клетки. Вирусные белки имеют молекулярную массу 5-200 кД. Наиболее просто устроенные вирусы (вирусы-сателлиты, дефектные вирусы) кодируют синтез только одного белка, многие патогенные вирусы кодируют синтез 5—10 белков, крупные вирусы, такие как вирусы оспы, герпесвирусы, кодируют синтез до 200 белков. Хотя это немного по сравнению с клетками прои эукариотов (кодируют соответственно более 5000 и 100000 белков). Разные вирусы демонстрируют различные варианты стратегии экспрессии своих генов и репликации геномов. 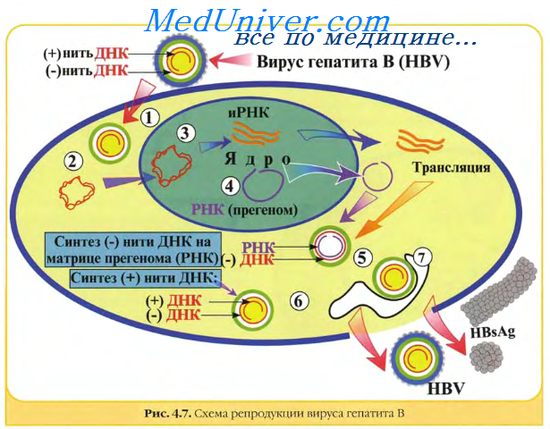 Вирусные геномы. Виды вирусных геномов.Все вирусные геномы являются гаплоидными, т.е. содержат одну копию каждого гена. Исключение составляют ретровирусы, которые обладают диплоидным геномом. Геномы ДНК-вирусов позвоночных представлены одной двуспиральной молекулой за исключением парво- и цирковирусов. Геномы полиома-, папиллома-, гепадна- и цирковирусов представлены кольцевой ДНК. ДНК гепаднавирусов частично двуспиральная, частично односпиральная. ДНК вирусов полиомы и папилломы является суперспиральной. Большинство линейных вирусных ДНК обладает способностью приобрести циркулярную конфигурацию, которая требуется для репликации по вращающемуся кольцевому механизму. Две цепи ДНК вируса оспы ковалентно связаны своими концами и при денатурации образуют большое одноцепочечное кольцо. У некоторых ДНК-вирусов (так же как у РНК-ретровирусов) имеются концевые повторяющиеся последовательности. Инвертированные концевые повторы обнаружены у адено- и парвовирусов. У адено-, гепадна- и парвовирусов, так же как у некоторых РНК-вирусов (пикорна- и калицивирусов), с 5'-концом генома ковалентно связан белок, играющий важную роль в его репликации. Все РНК-вирусы позвоночных за исключением рео- и бирнавирусов имеют одноцепочечные геномы. Геном некоторых РНК-вирусов состоит из нескольких (2-12) уникальных фрагментов, каждый из которых кодирует, как правило, один белок. РНК-вирусы с односпиральным геномом могут иметь различную полярность. Если они имеют ту же полярность, что и мРНК, то они могут прямо индуцировать синтез вирусного белка и считаются положительно (+) полярными. Если геномная нуклеотидная последовательность комплементарна мРНК, то они считаются отрицательно (—) полярными. К ним относятся: парамиксо-, рабдо-, фило-, ортомиксо-, арена- и буньявирусы. Все они имеют вирионную РНК-зависимую полимеразу (транскриптазу), которая в инфицированной клетке транскрибирует положительно-полярную РНК на матрице геномной вирусной РНК. У аренавирусов, по крайней мере, у одного рода буньявирусов, один из РНК-сегментов является двуполярным. Обычно у (+)полярных РНК-вирусов З'-конец имеет polyA-последовательность, а 5'-конец имеет кэп-структуру. Размер геномов РНК-вирусов (одноцепочечных 1,7—21 т.н.; двуцепочечных — 18—27 т.п.н.) значительно меньше размера генома многих ДНК-вирусов. Поэтому РНК-вирусы, как правило, кодируют меньше белков, чем ДНК-вирусы. Масса генома различных вирусов находится в пределах от 1 % (орто- и пара-миксовирусы) до 32% (парвовирусы) от массы вириона. Различные семейства вирусов позвоночных значительно различаются по структуре и функции генома. Основные типы вирусных геномов можно представить следующим образом: 1) двуцепочечной линейной молекулой ДНК с открытыми (герпесвирусы, аденовирусы, иридовирусы) или ковалентно связанными концами (вирусы оспы, асфаровирусы); 2) одноцепочечной линейной молекулой ДНК (парвовирусы); 3) одноцепочечной кольцевой молекулой ДНК (цирковирусы); 4) двуцепочечной кольцевой молекулой ДНК (папилломавирусы, полиомавирусы); 5) частично двуцепочечной кольцевой незамкнутой молекулой ДНК (гепаднавирусы); 6) одноцепочечной молекулой РНК, являющейся мРНК (положительно-геномные вирусы: пикорнавирусы, тогавирусы, флавивирусы, астровирусы, калицивирусы, коронавирусы, артеривирусы, нодавирусы); 7) одноцепочечной единой (рабдовирусы, парамиксовирусы, филовирусы, бор-навирусы) или фрагментированнои (ортомиксовирусы) линейной молекулой РНК, комплементарной мРНК — отрицательно-геномные вирусы; 8) одноцепочечной фрагментированнои кольцевой ковалентно несвязанной отрицательной или двуполярной РНК (буньявирусы, аренавирусы); 9) двуцепочечной линейной фрагментированнои молекулой РНК (реовирусы, бирнавирусы); 10) двумя идентичными линейными молекулами плюс-РНК, являющимися матрицами для синтеза ДНК (ретровирусы). Молекулярная масса ДНК различных вирусов позвоночных варьирует в широких пределах: от 0,7—1,5 МД у цирковирусов и парвовирусов, до 150—200 МД у вирусов оспы. Молекулярная масса генома у РНК вирусов колеблется менее значительно - от 2,0 до 20,0 МД. Трансляция и образование структурных и неструктурных вирусных белков. Сборка вирионов и их выход из клеток. Репродукция вирионов характеризуется сменой стадий: Транскрипция - переписывание ДНК на РНК – осуществляется с помощью фермента РНК-полимеразы, продуктами является биосинтез и-РНК. ДНК-содержащие вирусы, репродукция которых происходит в ядре, используют для транскрипции клеточную полимеразу. РНК-содержащие вирусы ф-ю и-РНК выолняет сам геном. У некоторых РНК-содержащих вирусов передача генетической информации осуществляется по формуле РНК-РНК-белок. К этой группе вирусов относятся – пикорновирусы, корновирусы. У РНК-содержащих вирусов транскрипция осуществляется вирусоспецифическими ферментами транскриптазами, т.е. вирусами закодированными в геноме. Синтез белка происходит в результате трансляции в РНК. Трансляция – процесс перевода генетической информации, содержащейся в вирусе на специфическую последовательность АК. Синтез белка осуществляется на рибосомах клетки. Репликация – синтез молекул нуклеиновой кислоты, гомологичной геному. В клетке происходит репликация ДНК в результате которой образуется двунитчатая ДНК. Будучи внутриклеточными паразитами вирусы используют все энергетические ресурсы клетки для синтеза компонентов: АК, нуклеотидов, АТФ. При этом в значительной мере или полностью подавляется клеточный метаболизм. На ряду с этим вирус вызывает образование ферментов, отсутствующих в клетке и необходимых для репликации вирусных АК. Согласно современным данным различают 3 основных периода в цикле репродукции: 1.Начальный (подготовительный) 2.Средний (латентный) 3.Конечный (заключительный) Каждый из периодов включает ряд этапов: Первый этап 1.Адсорбция вируса на клетке. 2.Проникновение в клетку. 3.Депротеинизация (высвобождение нуклеиновой кислоты). Второй этап 1.Биосинтез ранних вирусных белков 2.Биосинтез вирусных компонентов Третий этап 1.Формирование зрелых вирионов 2.Выход зрелых вирионов из клетки. Этапы: 1.Адсорбция – физико-химический процесс, является следствием разности зарядов. Эта стадия обратима на ее исход оказывает влияние кислотность среды, температура и другие процессы. Основную роль в адсорбции вируса играет взаимодействие вируса с комплементарными рецепторами клетки. По химической природе они относятся к мукополипротейдам. На степень скорости адсорбции влияют гормоны действующие на рецепторы. Адсорбция вируса может и не наступить, что связано с различной чувствительностью клеток к вирусам. Чувствительность, в свою очередь определяется: - наличием в клеточной оболочке и цитоплазме ферментов, способных разрушить оболочку и освободить нуклеиновую кислоту. - наличием ферментов, материала, обеспечивающих синтез вирусных компонентов. 2.Проникновение вируса в клетку: Вирус проникает 3 путями – путем непосредственного впрыскивания (характерно для фагов); путем разрушения клеточной оболочки (путь сплавления – характерно для вирусов растений); путем пиноцитоза (характерен для вирусов позвоночных). 3.Репродукция ДНК-содержащих вирусов. Под воздействием ферментов у ДНК-содержащих вирусов осуществляется синтез и-РНК, и-РНК посылается на рибосомы чувствительной клетки. На рибосомах клетки начинается синтез ранних вирионных белков (наделены свойствами – ферментами, блокируют клеточный метаболизм). Ранние вирионные белки дают начало образованию ранних вирионных кислот. По мере накопления ранних вирионных белков они блокируют себя и процесс перестраивается на рибосомном аппарате. Идет сборка вирионов и вновь сформировавшиеся вирионы покидают клетку-мать. 4.Выход вириона из клетки: Пути: 1.Просачиваются через оболочку клетки и одеваются суперкапсидом, в состав в состав которого включаются компоненты клетки: липиды, полисахариды. В данном случае клетка сохраняет свою жизнедеятельность затем погибает. В некоторых случаях в процессе репродукции процессы могут происходить в течение нескольких лет, но жизнедеятельность сохраняется. При этом способе зрелые вирионы из клетки выходят постепенно и относительно длительно. Этот путь характерен для сложных вирусов, имеющих двойную оболочку. Аномальные вирусы. В процессе репродукции образуются различные аномальные вирусы. Усилиями академика Жданова в последние годы были открыты псевдовирусы, состоящие из РНК-вируса и белков клетки, образующих капсид. Они обладают инфекционными свойствами, но в силу особенности капсида не поддаются действию антител, образующих ответ на этот вирус. Явление образования таких вирусов объясняется длительным вирусоносительством при наличии в организме специфических АТ. Причинами формирования таких вирионов являются: 1.Высокая множественность, в результате чего клетка не в состоянии обеспечить все потомство энергетическим материалом. 2.Действие интерферона – он влияет на синтез ДНК и РНК вирусов. Титрование вирусов. В лабораторных работах с вирусами, биофабричном производстве и в ветеринарной практике постоянно возникает необходимость определения количества вирусов в том или ином материале. Без такого определения невозможны экспериментальное заражение вирусами живых лабораторных систем, производство живых и инактивированных противовирусных вакцин и диагностических препаратов, оценка активности живых противовирусных вакцин, получение иммунных сывороток и многие другие работы. Количество вируса в каком-либо материале определяют по титру вируса в этом материале. Под титром вируса понимают выражение его концентрации в материале. Титр вируса — это количество вируса, содержащееся в единице объема материала. Поскольку количество вируса невозможно выразить в обычно применяемых (объем, масса и т. п.) единицах, прибегают к измерению в единицах действия или единицах активности. Вирусы обладают инфекционным и гемагглютинирующим действием. Отсюда и единицы количества вирусов инфекционные и гемагглютинирующие. Размерность этих единиц зивисит от соотношения полноценных и неполноценных вирионов в используемой суспензии, объекта, способа титрования и других факторов. В практике нашли применение три типа единиц количества вируса: 1-й — инфекционные единицы локальных повреждений, вызываемых вирусами и оцениваемых по единичному эффекту; 2-й — инфекционные единицы 50%-ного действия вирусов на чувствительные живые объекты, оцениваемые статистически; 3-й — гемагглютинирующие единицы. Из локальных повреждений, вызываемых вирусами, наиболее известны бляшки в зараженных культурах клеток (островки мертвых клеток в слое живых) и оспины (некротические узелки) на ХАО куриных эмбрионов, зараженных оспенными и некоторыми другими вирусами. В случаях такого проявления инфекционной активности вирусов количество вируса может быть измерено в бляшкообразующих единицах (БОЕ) или оспообразующих единицах (ООЕ). Одна БОЕ равна дозе вируса, способной вызвать образование одной бляшки, а одна ООЕ — одной оспины. Наиболее универсален метод определения титра вируса в единицах 50%-ного инфекционного действия. По этому методу за единицу количества вируса принимается такая его доза, которая способна вызывать инфекционный эффект у 50 % зараженных тест-объектов. Она обозначается как ЭД50— эффективная 50%-ная доза. Число таких доз вируса в единице объема материала и будет выражать титр вируса в этом материале. Таблица 6. Виды единиц количества вирусов при определении по 50%-ному инфекционному действию
В качестве тест-объектов в лабораториях обычно используют белых мышей, куриные эмбрионы и культуры клеток, у которых инфекционное действие вируса может проявляться гибелью, клиническими симптомами, патологоанатомическими изменениями и цитопатическим эффектом. Для каждого вируса подбирают чувствительный к нему тест-объект и форму учета его инфекционного действия, по которой оценивают эффект заражения. В зависимости от вида тест-объекта и формы проявления инфекционного действия ЭД50 принимает один из следующих видов, приведенных в таблице 6. Иначе говоря: 1 ЛД50—это доза вируса, убивающая 50 % лабораторных животных (обычно белых мышей); 1 ИД50—доза вируса, вызывающая клинические симптомы или патологоанатомические изменения у 50 % зараженных лабораторных животных; 1 ЭЛД — доза вируса, убивающая 50 % куриных эмбрионов; 1 ЭИД50—доза вируса, вызывающая патологоанатомические изменения у 50 % зараженных куриных эмбрионов; 1 ЦПД50— доза вируса, вызывающая цитопатический эффект у 50 % зараженных культур клеток (обычно пробирок с культурами клеток). Количество ЭД50 (ЛД50, ИД ЭЛД50, ЭИД50 или ЦПД50) вируса, содержащееся в единице объема вируссодержащего материала, и будет выражением титра (Т) вируса в этом материале. Например, Т=103,48 ЦПД50/0,1 мл означает, что в каждой 0,1 мл вируссодержащего материала содержится 103'48 доз вируса (т. е. более 1000, но менее 10 000, а именно 103,48=3020), каждая из которых способна вызвать цитопатический эффект в 50 % пробирок с культурой клеток. Названные единицы 50%-ного инфекционного действия вируса (ЛД50, ИД50, ЭЛД50, ЭИД50, ЦПД50) используются в случаях оценки инфекционного действия вируса со статистически оцениваемым эффектом, имеющим место, когда учет инфекционного действия вируса ведется по летальному действию, клиническим симптомам, патологоанатомическим изменениям или цитопатическому действию. Титрование вирусов по 50%-ному инфекционному действию — наиболее универсальный прием, пригодный для титрования практически любого вируса, если подобрать чувствительную к нему живую систему (текст-объект). Однако этот метод титрования вирусов довольно трудоемкий, длительный и требует статистических расчетов. Задача определения титра вируса в единицах 50%-ного инфекционного действия (ЛД50, ИД50, ЭЛД50, ЭИД50, ЦПД50) сводится к тому, чтобы найти такое разведение испытуемого вируссодержащего материала, в объеме заражающей дозы которого содержалась бы одна ЭД50, а затем рассчитать, сколько таких единиц вируса содержится в таком же объеме вируссодержащего материала, что и будет показателем титра вируса в этом материале. Чтобы решить эту задачу, сначала из исследуемого вируссодержащего материала готовят ряд последовательных 10-кратных разведений. 10-кратные разведения берут по двум причинам: во-первых, как видно из графика зависимости инфекционного эффекта от дозы вируса (рис. 35), кривая этой зависимости вблизи точки, соответствующей ЭД50, на значительном отрезке приближается к прямой. 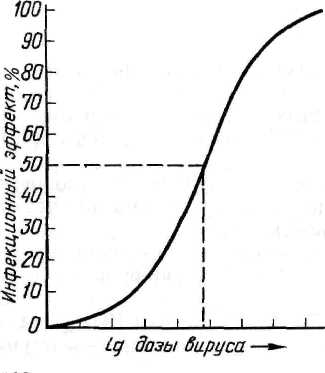 Рисунок 35. График зависимости инфекционного эффекта от дозы вируса Это означает, что в определенных пределах, центр которых в точке ЭД50, между логарифмом дозы (разведения) вируса и инфекционным эффектом существует прямолинейная зависимость, т. е. величина инфекционного эффекта пропорциональна логарифму дозы вируса (или его разведения), в области малых и особенно больших доз эта зависимость нарушается; во-вторых, при 10-кратном разведении облегчаются последующие расчеты. Одинаковыми объемами каждого из 10-кратных разведений исследуемого вируссодержащего материала заражают равные группы чувствительных к данному вирусу живых тест-объектов (мышей, куриных эмбрионов или культур клеток). При этом в каждой группе должно быть не менее 4—6 тест-объектов, так как при меньшем количестве статистически рассчитываемая величина титра вируса будет иметь слишком большую погрешность (статистическая величина тем точнее, чем на большем количестве исходных данных она основана). После заражения учитывают результат действия вируса (гибель, клинические симптомы, патологоанатомические изменения или ЦПЭ) на зараженные объекты и определяют, в каком разведении вирус проявил свое действие на 50 % чувствительных объектов. Разведение, дающее 50%-ный эффект, рассчитывают методом прямолинейной интерполяции. Когда такое разведение нашли, то считают, что в заражающем объеме вируса, разведенного в найденное (соответствующее 50%-ному эффекту) число раз, содержится 1 ЭД50. В таком же объеме исходного (неразведенного) вируссодержащего материала таких доз (ЭД50) содержится больше во столько раз, во сколько был разведен материал, давший 1 ЭД50. Затем пересчитывают, сколько таких единиц 50%-ного инфекционного действия вируса содержится в единице объема (мл) вируссодержащего материала, что и будет выражением титра вируса в данном материале. Ферменты вирионов, липиды и углеводы в составе вирионов. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
