Вирусология. вирь. Вакцин требует знаний структурных и функциональных особенностей вирусных антигенов, различаемых иммунной системой организма. Вирусными антигенами
 Скачать 2.43 Mb. Скачать 2.43 Mb.
|
|
В качестве тест-объектов в лабораториях обычно используют белых мышей, куриные эмбрионы и культуры клеток, у которых инфекционное действие вируса может проявляться гибелью, клиническими симптомами, патологоанатомическими изменениями и цитопатическим эффектом. Для каждого вируса подбирают чувствительный к нему тест-объект и форму учета его инфекционного действия, по которой оценивают эффект заражения. В зависимости от вида тест-объекта и формы проявления инфекционного действия ЭД50 принимает один из следующих видов, приведенных в таблице 6. Иначе говоря: 1 ЛД50—это доза вируса, убивающая 50 % лабораторных животных (обычно белых мышей); 1 ИД50—доза вируса, вызывающая клинические симптомы или патологоанатомические изменения у 50 % зараженных лабораторных животных; 1 ЭЛД — доза вируса, убивающая 50 % куриных эмбрионов; 1 ЭИД50—доза вируса, вызывающая патологоанатомические изменения у 50 % зараженных куриных эмбрионов; 1 ЦПД50— доза вируса, вызывающая цитопатический эффект у 50 % зараженных культур клеток (обычно пробирок с культурами клеток). Количество ЭД50 (ЛД50, ИД ЭЛД50, ЭИД50 или ЦПД50) вируса, содержащееся в единице объема вируссодержащего материала, и будет выражением титра (Т) вируса в этом материале. Например, Т=103,48 ЦПД50/0,1 мл означает, что в каждой 0,1 мл вируссодержащего материала содержится 103'48 доз вируса (т. е. более 1000, но менее 10 000, а именно 103,48=3020), каждая из которых способна вызвать цитопатический эффект в 50 % пробирок с культурой клеток. Названные единицы 50%-ного инфекционного действия вируса (ЛД50, ИД50, ЭЛД50, ЭИД50, ЦПД50) используются в случаях оценки инфекционного действия вируса со статистически оцениваемым эффектом, имеющим место, когда учет инфекционного действия вируса ведется по летальному действию, клиническим симптомам, патологоанатомическим изменениям или цитопатическому действию. Титрование вирусов по 50%-ному инфекционному действию — наиболее универсальный прием, пригодный для титрования практически любого вируса, если подобрать чувствительную к нему живую систему (текст-объект). Однако этот метод титрования вирусов довольно трудоемкий, длительный и требует статистических расчетов. Задача определения титра вируса в единицах 50%-ного инфекционного действия (ЛД50, ИД50, ЭЛД50, ЭИД50, ЦПД50) сводится к тому, чтобы найти такое разведение испытуемого вируссодержащего материала, в объеме заражающей дозы которого содержалась бы одна ЭД50, а затем рассчитать, сколько таких единиц вируса содержится в таком же объеме вируссодержащего материала, что и будет показателем титра вируса в этом материале. Чтобы решить эту задачу, сначала из исследуемого вируссодержащего материала готовят ряд последовательных 10-кратных разведений. 10-кратные разведения берут по двум причинам: во-первых, как видно из графика зависимости инфекционного эффекта от дозы вируса (рис. 35), кривая этой зависимости вблизи точки, соответствующей ЭД50, на значительном отрезке приближается к прямой. 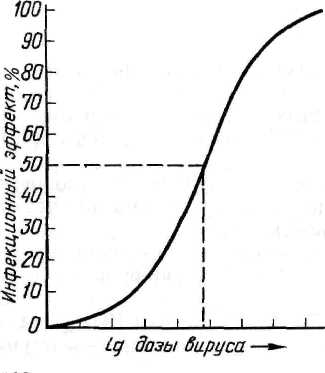 Рисунок 35. График зависимости инфекционного эффекта от дозы вируса Это означает, что в определенных пределах, центр которых в точке ЭД50, между логарифмом дозы (разведения) вируса и инфекционным эффектом существует прямолинейная зависимость, т. е. величина инфекционного эффекта пропорциональна логарифму дозы вируса (или его разведения), в области малых и особенно больших доз эта зависимость нарушается; во-вторых, при 10-кратном разведении облегчаются последующие расчеты. Одинаковыми объемами каждого из 10-кратных разведений исследуемого вируссодержащего материала заражают равные группы чувствительных к данному вирусу живых тест-объектов (мышей, куриных эмбрионов или культур клеток). При этом в каждой группе должно быть не менее 4—6 тест-объектов, так как при меньшем количестве статистически рассчитываемая величина титра вируса будет иметь слишком большую погрешность (статистическая величина тем точнее, чем на большем количестве исходных данных она основана). После заражения учитывают результат действия вируса (гибель, клинические симптомы, патологоанатомические изменения или ЦПЭ) на зараженные объекты и определяют, в каком разведении вирус проявил свое действие на 50 % чувствительных объектов. Разведение, дающее 50%-ный эффект, рассчитывают методом прямолинейной интерполяции. Когда такое разведение нашли, то считают, что в заражающем объеме вируса, разведенного в найденное (соответствующее 50%-ному эффекту) число раз, содержится 1 ЭД50. В таком же объеме исходного (неразведенного) вируссодержащего материала таких доз (ЭД50) содержится больше во столько раз, во сколько был разведен материал, давший 1 ЭД50. Затем пересчитывают, сколько таких единиц 50%-ного инфекционного действия вируса содержится в единице объема (мл) вируссодержащего материала, что и будет выражением титра вируса в данном материале. Понятия о гене и геноме вирусов. Вирусная популяция, вирусный штамм, вирусный клон. Все ДНК-вирусы и многие группы РНК-вирусов имеют геномы, состоящие из одной молекулы нуклеиновой кислоты. Геном некоторых других РНК-вирусов состоит из нескольких отдельных молекул РНК. Если определить ген как нуклеотидную последовательность, кодирующую один полипептид, то можно оценить число генов у разных вирусов, исходя из имеющихся данных о количестве нуклеиновой кислоты в инфекционной частице. Такой подсчет основан на следующих предположениях: 1) в генетической системе вирусов, так же как и у других организмов, используется неперекрывающийся триплетный код (в этом нет оснований сомневаться); 2) в вирусных нуклеиновых кислотах нет длинных повторяющихся последовательностей; 3) вся вирусная нуклеиновая кислота кодирует полипептиды [прежнее предположение (Субак-Шарп и Хей, 1965) о том, что вирус герпеса кодирует некоторые тРНК, сейчас отвергнуто (Белл и др., 1971)]; 4) «средний» вирусный полипептид состоит примерно из 500 аминокислот и имеет мол. вес около 50 000 [эта цифра лучше согласуется с экспериментальными данными, чем цифра 20 000, принятая ранее (Феннер, 1968): средний молекулярный вес 70 вирусных белков, включая гликопротеиды, оказался равным 55 000]; 5) каждый вирусный полипептид кодируется уникальной последовательностью нуклеотидов. Универсальность последнего положения вызывает сомнения, так как возможно, что у некоторых РНК-вирусов посттрансляционное расщепление полипептидов происходит неоднозначно (Купер и др., 1970b), а у некоторых ДНК-вирусов структурные белки могут состоять из белков-предшественников и образовавшихся из них полипептидов (Кац и Мосс, 1970а). Кроме того, имеется серьезная семантическая проблема. РНК пикорнавирусов, действуя как мРНК, транслируется в одну гигантскую белковую молекулу, которая затем последовательно расщепляется. Возникает вопрос: имеют ли такие вирусы только один ген или же образующиеся в конечном счете белки должны рассматриваться как продукты отдельных генов? Мы будем придерживаться второй интерпретации как более удобной при рассмотрении функций генов.  Даже с учетом того, что электрофорез в геле не выявляет всех полипептидов сложных крупных ДНК-вирионов, очевидно, что структурные белки соответствуют лишь меньшей части генов этих вирусов. Остальные гены, по-видимому, кодируют ферменты, участвующие в репликации ДНК, регуляторные белки, а в случае поксвирусов, возможно, даже ферменты, участвующие в синтезе вирусных полисахаридов и липидов. У вирусов с фрагментированным геномом (ортомиксовирусы и реовирусы) каждая молекула РНК соответствует одному гену. Имеется достаточно хорошее соответствие между числом фрагментов генома и рассчитанным числом генов. По-видимому, у большинства РНК-вирусов по меньшей мере половина генома кодирует структурные белки. вирусная «популяция» чаще всего представляет собой суммы полноценных вирионов и дефектных образований, т. е. фактически мертвого материала. Такого рода «популяции», состоящие из живых и мертвых особей, невозможно даже представить в мире организмов. В некоторых случаях сумма дефектных частиц с дефектами в разных участках генома может обеспечить развитие вирусной инфекции (феномен множественной реактивации). Правила работы с вируссодержащими материалами. 1.1 Техника безопасности и правила работы с вируссодержащим материалом При работе с вируссодержащим материалом необходимо выполнять следующие требования: не допускать рассеивания вирусов во внешней среде; предотвратить контаминацию (загрязнение) вируссодержащего материала посторонней микрофлорой; обеспечить личную безопасность. Режим работы вирусологической лаборатории регламентируется законами Российской Федерации, международными правилами проведения диагностических лабораторных исследований, правилами внутреннего распорядка. Весь персонал лаборатории проходит инструктаж и обучение безопасным методам труда, обеспечивается спецодеждой, спецобувью, средствами санитарной защиты и защитными приспособлениями в соответствии с действующими нормами. Вход в производственные помещения посторонним лицам категорически запрещен. Сотрудники вирусологической лаборатории обязаны соблюдать правила работы, предупреждающие загрязнения бактериями и грибами исследуемого материала, возможность заражения персонала и распространения инфекции. Запрещено выходить за пределы лаборатории в халатах и спецобуви или надевать верхнюю одежду на халат, курить, принимать пищу в производственных помещениях и хранить в них продукты питания. В боксе работают в стерильном халате, маске, шапочке, в некоторых случаях надевают очки и перчатки. Обязательно меняют обувь. Не допускаются хождение и разговоры во время работы. Весь материал, поступающий в лабораторию на исследование, должен рассматриваться как инфицированный! С инфекционным материалом следует обращаться крайне осторожно. При распаковке его банки необходимо протирать снаружи дезинфицирующим раствором и ставить их на поднос или в кювет. Рабочее место на столе покрывают несколькими слоями марли, увлажненной 3 – 5 % раствором хлорамина. Жидкости, содержащие вирусы, переливают над кюветами с дезинфицирующим раствором. При работе с пипеткой пользуются грушей. Пипетки, предметные стекла, стеклянную посуду и резиновые изделия, задействованные в работе с инфекционным материалом, обеззараживают погружением в 5 % раствор хлорамина или растворы фенола, лизола, серной кислоты. Запрещается выносить из лаборатории оборудование, инвентарь, материалы и т. д. без предварительной их дезинфекции. По окончании работы рабочее место приводят в порядок и дезинфицируют. Вирусосодержащий материал, необходимый для дальнейшей работы, ставят на хранение в холодильник и опечатывают. Руки в перчатках промывают в банке с 5 % раствором хлорамина, затем перчатки снимают, обеззараживают вторично, дезинфицируют и моют. Получение и транспортировка патологического материала для вирусологических исследований. См. вопрос № 28. Устройство вирусологической лаборатории. Современные требования к лабораторным диагностическим комплексам и отдельным составляющим (полы, стены, потолки, системы отопления, вентиляции, водоснабжения и канализации) изложены в правилах лабораторной практики GLP. Вирусологические отделы лабораторий и научно-исследовательских ветеринарных станций призваны осуществлять лабораторную диагностику вирусных инфекций, контролировать заболеваемость животных, вызываемую вирусами в межэпизоотический период, а также учитывать состояние и напряженность специфического постинфекционного и поствакцинального противовирусного иммунитета, участвовать в организации и проведении профилактических мероприятий в борьбе с вирусными и хламидийными заболеваниями животных в обслуживаемом регионе. Структура вирусологической лаборатории определяется задачами и особенностями ее деятельности. Размещать лабораторию желательно в двухэтажном здании или в изолированном отсеке. Боксы предпочтительнее располагать с северной, теневой стороны здания, чтобы избежать попадания в них прямых солнечных лучей, или следует застеклить окна боксов молочным или матовым стеклом. Полы в коридорах и комнатах для сотрудников могут быть паркетными, покрытыми лаком; в остальных – из плотного, влагонепроницаемого, устойчивого к дезинфектантам материала. Деревянные полы покрывают пластиком. Стены и потолки лаборатории должны быть также устойчивыми к дезинфектантам, легко подвергаться мойке. В боксах всю площадь целесообразно отделывать кафельной плиткой. Двери боксов должны быть раздвижными. Это позволяет сэкономить площадь и избежать колебания воздуха. В плоскости двери устраивают окошко с небольшой площадкой Целесообразно иметь боксы следующего назначения: для получения и культивирования клеток – 1–2 бокса; для заражения культуры клеток – 1–2, для заражения куриных эмбрионов – 1–2 бокса; для заражения подопытных животных – 1 бокс; для вскрытия подопытных животных – 1 бокс; для склада стерильного стекла – 1 помещение. Основные диагностические работы должны проводиться в настольных или стационарных ламинарных боксах (разного класса) с системой защиты оператора, предупреждения контаминации исследуемого материала, защиты окружающей среды от вредных и опасных выбросов. Помещения несколько больших размеров (примерно 4х4 м) выделяют для серологических исследований, уничтожения инфекционного материала, приготовления и стерилизации лабораторной посуды и других материалов, приготовления питательных сред и растворов, а также для сотрудников. Лаборатория (отдел) вирусологии должна быть обеспечена холодной и горячей водой, желательны подача пара и газа, наличие централизованного вакуум-провода и подачи воздуха под давлением. Каждый бокс комплектуют соответствующей мебелью и оборудованием. Примерная схема размещения оборудования и приборов представлена на рисунке 1. Наиболее важен стол, размер которого зависит от выполняемых на нем работ. В связи с тем, что многие работы приходится выполнять вдвоем, стол рекомендуется располагать параллельно стене, чтобы два работника сидели друг против друга, или ставить его к стене в виде буквы Т, что позволяет более экономно использовать площадь стола. Шкафчики для стеклянной посуды и мелкого инвентаря можно устроить под столом или повесить на стену. Покрытие лабораторного стола должно быть устойчивым к действию дезинфицирующих веществ. Лабораторные стулья лучше всего металлические, так как они легко очищаются и дезинфицируются. Над рабочим местом устанавливают бактерицидные лампы (БУВ-30). У входа в бокс кладут резиновый губчатый коврик, пропитанный дезраствором. В предбокснике находятся стерильные халаты, колпаки, косынки, маски и тапочки, перчатки, которые надевают перед работой в боксе, и, в зависимости от назначения бокса, соответствующее оборудование (термостат, холодильник, водяная баня, центрифуга и пр.). 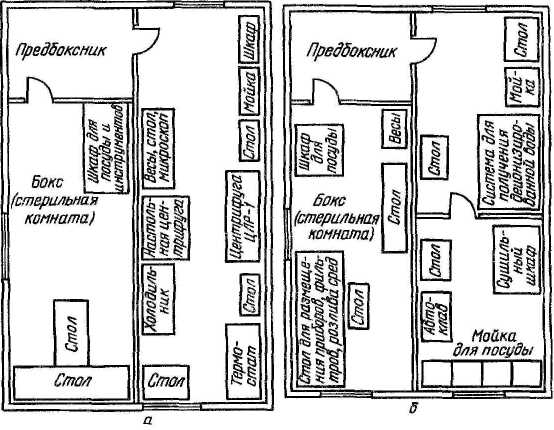 Рисунок 1. Схема размещения оборудования: а – для работы с культурами клеток, б – для изготовления сред и растворов для культур клеток 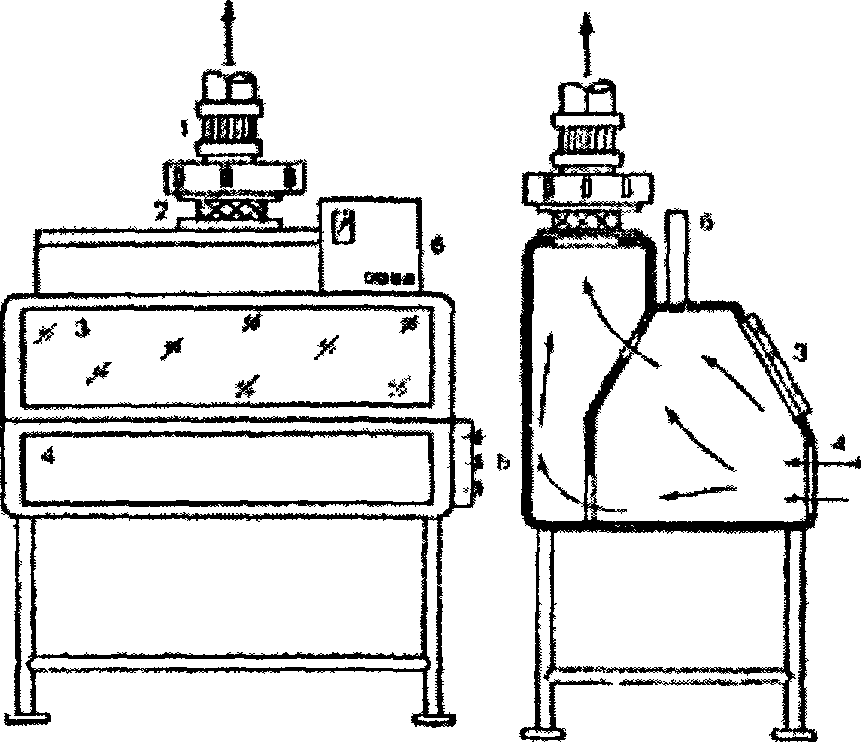 Рисунок 2. Микробиологический защитный бокс I класса:1 – вытяжной вентилятор; 2 - высокоэффективный воздушный фильтр; 3 - смотровая стеклянная панель; 4- открытый проем для рук работающего; 5 - штуцера для подводок воды, воздуха 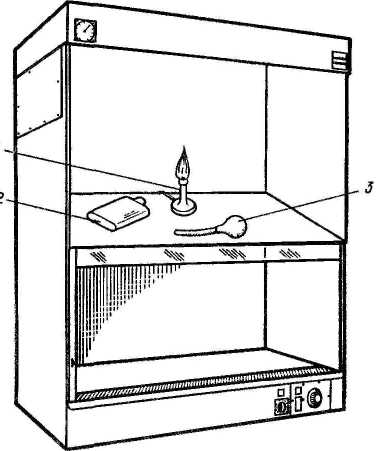 Рисунок 3. Бокс с ламинарной подачей стерильного воздуха:1 – газовая горелка, 2 – матрас, 3 – резиновая груша Ограничить численность бактерий можно с помощью бактерицидных ламп БУВ-15 и БУВ-30. Значительного снижения количества бактерий в воздухе боксов и предбоксников, на поверхности столов и другого оборудования можно достигнуть обработкой аэрозолем перекиси водорода и некоторых других веществ. Уборку помещений проводят влажным способом: полы, стены, мебель протирают марлей, увлажненной дезраствором. Для вирусологической лаборатории любого типа обязательной частью оборудования должен быть настольный бокс, содержащий бактерицидную лампу, еще лучше – ламинарный шкаф с подачей стерильного воздуха (рис. 2, 3). При работе в вирусологической лаборатории необходимо строго соблюдать методы и правила асептики и антисептики! Асептика – система мероприятий и приемов работы, предупреждающих попадание микроорганизмов и вирусов из окружающей среды в организм человека, а также в исследуемый материал. Она предусматривает использование стерильных инструментов и материалов, обработку рук сотрудников, соблюдение особых санитарно-гигиенических правил и приемов работы. Антисептика – комплекс мероприятий, направленных на уничтожение микроорганизмов и вирусов, способных вызвать инфекционный процесс при попадании на поврежденные или интактные участки кожи и слизистых оболочек. В качестве антисептиков используют различные химические вещества: 70%-ный этиловый спирт, 5%-ный спиртовой раствор йода, 0,5–3%-ный раствор хлорамина, 0,1%-ный раствор перманганата калия, 0,5–1%-ный раствор формалина, 1-2%-ные спиртовые растворы метиленового синего или бриллиантового зеленого. |
