Экзамен по биохимии 2 курс. Вопросы итоговой аттестации по биохимии
 Скачать 1.2 Mb. Скачать 1.2 Mb.
|
|
60. Механизм синтеза жирных кислот Условно можно выделить 4 этапа биосинтеза:
61. Холестерол - стероид, характерный только для животных организмов. Он синтезируется во многих тканях человека, но основное место синтеза - печень. Биологическая роль холестерола: 1. Входит в состав всех мембран клеток, увеличивает их электроизоляционные свойства, придаёт им жёсткость и плотность. 2. В мембране защищает полиненасыщенные жирные кислоты от окисления. 3. Из холестерола синтезируются желчные кислоты, стероидные гормоны и витамин D3. 4. Холестерол является компонентом желчи. Предшественники в метаболическом пути синтеза холестерола превращаются также в убихинон - компонент дыхательной цепи и долихол, участвующий в синтезе гликопротеинов. Нарушения обмена холестерола приводят к одному из наиболее распространённых заболеваний - атеросклерозу. Смертность от последствий атеросклероза (инфаркт миокарда, инсульт) лидирует в общей структуре смертности населения. Накопление холестерола в организме приводит к развитию и другого распространённого заболевания - желчнокаменной болезни. Производные: Желчные кислоты Холестерин, который находится в организме человека, подвержен окислению. Так он преобразуется во всевозможные стероидные соединения. Примерно 70% имеющегося в организме свободного холестерина уходит на это процесс. Желчные кислоты синтезируются в печени, а затем хранятся и концентрируются в желчном пузыре. При необходимости они направляются в тонкий кишечник. Самой значимой в организме является холевая кислота. Еще есть дезоксихолевая, хенодезоксихолевая и литохолевая. Некоторые из них присутствуют в желчи в виде солей. Эти производные холестерина являются основными компонентами желчи. В них растворяются диетические липиды. Кроме того и сами они являются конечными продуктами распада этого вещества. Стероидные гормоны Производными холестерина являются 5 основных классов стероидных гормонов: прогестины, глюкокортикоиды, минералокортикоиды, андрогены и эстрогены. Эти гормоны являются мощными веществами, регулирующими основные функции в организме. Прогестерон и прогестаген подготавливает матку к имплантации яйцеклетки. Для нормального протекания беременности необходим прогестерон. Андрогены определяют вторичные мужские половые признаки, а эстрогены – женские. Глюкокортикоиды участвуют в образовании гликогена, подавляют воспалительные реакции. Минералокортикоиды воздействуют на почки, что приводит к увеличению потока крови и артериального давления. На выработку всех этих гормонов уходит около 4% общего количества ЛПВП. Витамин D Холестерин является предшественником витамина D, который играет важную роль в контроле метаболизма кальция и фосфора. Это еще одна его производная. Витамин D превращается в кальцитриол. Затем он связывается с рецепторами и регулирует производство генов. При дефиците данного витамина в детском возрасте развивается рахит. 62. Синтез триацилглицеридов и фосфолипидов. В печени есть фермент глицеролкиназа: 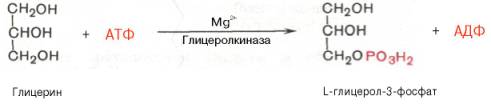 В жировой ткани и мышцах  Далее идут присоединения к глицерол-3-фосфату активированных жирных кислот. Образуется фосфатидат. 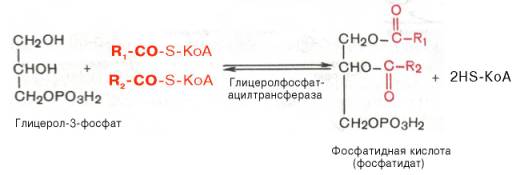 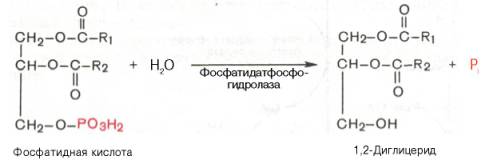  63. Кетоновые тела и их роль в метаболизме. Кетоновые тела: Кетоновые тела — топливо для мышечной ткани, почек и др.(особенно при недостатке глюкозы, голодании) Предотвращают излишнюю мобилизацию жирных кислот из жировых депо.[2] Во время голодания кетоновые тела являются одним из основных источников энергии для мозга.[4][5] Печень, синтезируя кетоновые тела, не способна использовать их в качестве энергетического материала (не располагает соответствующими ферментами). Синтез и использование: 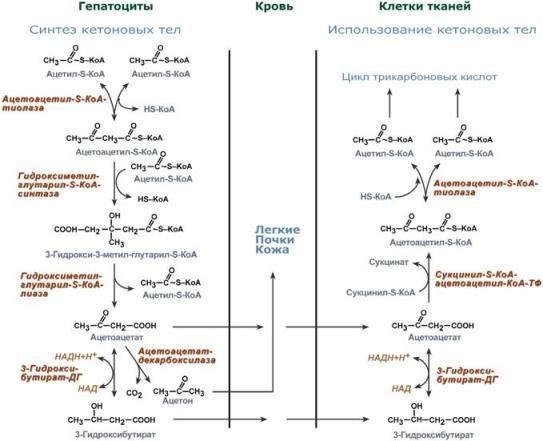 64. Физико-химические свойства белков. Изоэлектрическое состояние и изоэлектрическая точка аминокислот и белков. Наиболее характерными физико-химическими свойствами белков являются высокая вязкость растворов, незначительная диффузия, способность к набуханию в больших пределах, оптическая активность, подвижность в электрическом поле, низкое осмотическое давление и высокое онкотическое давление, способность к поглощению УФ-лучей при 280 нм (это свойство, обусловленное наличием в белках ароматических аминокислот, используется для количественного определения белков). Белки, как и аминокислоты, амфотерны благодаря наличию свободных NH2- и СООН-групп. Для них характерны все свойства кислот и оснований. В зависимости от реакции среды и соотношения кислых и основных аминокислот белкив растворе несут или отрицательный, или положительный заряд, перемещаясь к аноду или катоду. Это свойство используется при очистке белков методом электрофореза. Белки обладают явно выраженными гидрофильными свойствами. Значение рН, при котором белок приобретает суммарный нулевой заряд, называют"изоэлектрическая точка" и обозначают как pI. В изоэлектрической точке количество положительно и отрицательно заряженных групп белка одинаково, т.е. белок находится в изоэлектрическом состоянии. 65.Биохимические механизмы переваривания белков в ЖКТ. В ротовойполости не происходит. В желудке главные клетки слизистой оболочки секретируют пепсиноген – предшественник протеолитического фермента пепсина. В результате аутокатализа в кислой среде желудочного сока фермент активируется. Соляная кислота поддерживает рН в пределах 1,5-2,0. Это оптимальные условия для активной работы фермента. В кислой среде белки корма подвергаются денатурации, что делает их более доступными ферментативному протеолизу. Пепсин быстро гидролизует в белках пептидные связи, образованые ароматическими аминокислотами и медленно связи между лейцином и дикарбоновыми аминокислотами. В тонком отделе кишечника происходит дальнейший гидролиз пептидов до аминокислот. Туда поступает панкреатический сок с рН 7,8-8,2. Он содержит неактивные предшественники протеаз: трипсиноген,химотрипсиноген, прокарбоксипептидазу, проэластазу. Слизистой кишечника вырабатывается фермент энтеропептидаза, который активирует трипсиноген до трипсина, а последний уже все остальные ферменты. Протеолитические ферменты содержатся также в клетках слизистой кишечника, поэтому гидролиз небольших пептидов происходит после их всасывания. Конечный результат действия ферментов желудка и кишечника – расщепление почти всей массы пищевых белков до свободных аминокислот. Всасывание аминокислот происходит в тонком отделе кишечника. Это активный процесс и требует затраты энергии. Основной механизм транспорта – гамма-глутамильный цикл. В нем участвует 6 ферментов и трипептид глутатион (глутамилцистеинилглицин). Ключевой фермент – гамма-глутамилтрансфераза. Кроме того, процесс всасывания АК требует присутствия ионовNa+. Аминокислоты попадают в портальный кровоток – в печень и в общий кровоток. Печень и почки поглощают аминокислоты интенсивно, мозг избирательно поглощает метионин, гистидин, глицин, аргинин, глутамин, тирозин. В толстом отделе кишечника не всосавшиеся по каким-либо причинам (недостаток или низкая активность протеолитических фрементов, нарушение процессов транспорта АК) пептиды и АК подвергаются процессам гниения. При этом образуются такие продукты как: фенол, крезол, сероводород, метилмеркаптан, индол, скатол, а также группа соединений под общим названием «трупные яды» - кадаверин, путресцин. Эти вещества всасываются в кровь и поступают в печень, где подвергаются конъюгации с глюкуроновой кислотой и другим процессам обезвреживания (см. подробнее главу "Биохимия печени"). Затем они выводятся из организма с мочой. 66.Механизмы реакций трансаминирования и дезаминирования аминокислот. Под трансаминированием подразумевают реакции межмолекулярного переноса аминогруппы (NH2—) отаминокислоты на α-кетокислоту без промежуточного образования аммиака. Все трансаминазы (как и декарбоксилазыаминокислот) содержат один и тот же кофермент – пиридоксальфосфат. Специфичность трансаминаз обеспечивается белковым компонентом. Ферментытрансаминирования катализируют перенос NH2-группы не на α-кетокислоту, а сначала на кофермент пиридоксаль-фосфат. Образовавшееся промежуточное соединение (шиффово основание) подвергается внутримолекулярным превращениям, приводящим к освобождению α-кетокислоты и пиридоксаминфосфата; последний на второй стадии реакции реагирует с любой другой α-кетокислотой, что через те же стадии образования промежуточных соединений (идущих в обратном направлении) приводит к синтезу новой аминокислоты и освобождению пиридоксальфосфата. Реакции трансаминирования играют большую роль в обмене аминокислот. Поскольку этот процесс обратим, ферменты аминотрансферазы функционируют как в процессах катаболизма, так и биосинтеза аминокислот. Трансаминирование - заключительный этап синтеза заменимых аминокислот из соответствующих α-кетокислот, если они в данный момент необходимы клеткам. В результате происходит перераспределение аминного азота в тканях организма. Трансаминирование - первая стадия дезаминирования большинства аминокислот, т.е. начальный этап их катаболизма. Образующиеся при этом кетокислоты окисляются в ЦТК или используются для синтеза глюкозы и кетоновых тел. При трансаминировании общее количество аминокислот в клетке не меняется. Доказано существование 4 типов дезаминирования аминокислот (отщепление аминогруппы). Помимо аммиака, продуктами дезаминирования являются жирныекислоты, оксикислоты и кетокислоты. Первая стадия является ферментативной и завершается образованием неустойчивого промежуточного продукта (иминокислота), который на второй стадии спонтанно без участия фермента, но в присутствии воды распадается нааммиак и α-кетокислоту. оксидазы аминокислот (L- и D-изомеров) являются сложнымифлавопротеинами, содержащими в качестве кофермента ФМН или ФАД, которые выполняют в этой реакции роль акцепторов двух электронов и протонов, отщепляющихся от аминокислоты. Восстановленные флавиннуклеотиды оксидаз L- и D-аминокислот могут непосредственно окисляться молекулярнымкислородом. При этом образуется перекись водорода, которая подвергается расщеплению под действием каталазы на воду и кислород. Конечными продуктами реакции являются пируват и α-кетобутират, аммиак и сероводород. 67.Декарбоксилирование аминокислот. Биологическая роль продуктов декарбоксилирования. Процесс отщепления карбоксильной группы аминокислот в виде СО2 получил название декарбоксилирования. В живых организмах открыты 4 типа декарбоксилирования аминокислот: 1. α-Декарбоксилирование, характерное для тканей животных, при котором от аминокислот отщепляетсякарбоксильная группа, стоящая по соседству с α-углеродным атомом. Продуктами реакции являются СО2 и биогенныеамины 2. ω-Декарбоксилирование, свойственное микроорганизмам. Например, из аспарагиновой кислоты этим путем образуется α-аланин. 3. Декарбоксилирование, связанное с реакцией трансаминирования, В этой реакции образуются альдегид и новая аминокислота, соответствующая исходной кетокислоте. 4. Декарбоксилирование, связанное с реакцией конденсации двух молекул Эта реакция в тканях животных осуществляется при синтезе δ-амино-левулиновой кислоты из глицина и сукцинил-КоА и при синтезе сфинголипидов, а также у растений при синтезе биотина. Реакции декарбоксилирования являются необратимыми. Они катализируются специфическими ферментами – декарбоксилазами аминокислот, отличающимися от декарбоксилаз α-кетокислот как белковым компонентом, так и природой кофермента. Механизм реакции декарбоксилирования аминокислот в соответствии с общей теорией пиридоксалевого катализа сводится к образованию ПФ-субстратного комплекса. 68. Орнитиновый цикл цикл мочевины, циклический ферментативный процесс, состоящий из последовательных превращений аминокислоты Орнитина и приводящий к синтезу мочевины. О. ц. -важнейший путь ассимиляции аммиака (и тем самым его обезвреживания) у многих видов животных, а также у растений и микроорганизмов. О.ц. состоит из трёх основных реакций: превращение орнитина в Цитруллин, цитруллина в Аргинин и расщепление аргинина на мочевину иорнитин . Реакции I и II требуют затраты энергии, которая доставляется в форме аденозинтрифосфорной кислоты (АТФ). Реакция I протекает в два этапа: 1) образование карбамилфосфата, обладающего богатой энергией фосфатной связью, из NH3, CO2 и двух молекул АТФ (реакция активируется N-ацетилглутаминовой кислотой; NH3, повидимому, доставляется в печень в виде глутамина, который расщепляется глутаминазой печени на NH3 и глутаминовую кислоту ; 2)образование цитруллина при взаимодействии карбамилфосфата с орнитином (реакция идёт за счёт энергиисвязи карбамилфосфата). Реакция II также двухстадийна: цитруллин, реагируя с аспарагиновой кислотой,образует аргининоянтарную кислоту (реакция идёт при участии АТФ с освобождением адениловой кислоты— АМФ —и пирофосфата H4P2O7;), а аргининоянтарная кислота расщепляется на аргинин и фумаровуюкислоту. Реакция III: аргинин гидролизуется до мочевины и орнитина, который вновь вступает в цикл. 69.Биологические механизмы окисления нуклеотидов Увы 70.Строение молекулы ДНК ДНК представляет собой двойную нить, скрученную в спираль. Каждая нить состоит из «кирпичиков» — из последовательно соединенных нуклеотидов. Каждый нуклеотид ДНК содержит одно из четырёх азотистых оснований — гуанин (G), аденин (A) (пурины), тимин (T) и цитозин (C) (пиримидины), связанное с дезоксирибозой, к последней, в свою очередь, присоединена фосфатная группа. Между собой соседние нуклеотиды соединены в цепи фосфодиэфирной связью, образованной 3’-гидроксильной (3’-ОН) и 5’-фосфатной группами (5’-РО3). Это свойство обуславливает наличие полярности в ДНК, т. е. противоположной направленности, а именно 5’- и 3’-концов: 5’-концу одной нити соответствует 3’-конец второй нити. 71. Биохимические механизмы синтеза ДН Репликация (синтез) ДНК происходит не беспорядочно, а в строго определенный период жизни клетки. Всегда выделяют 4 фазы клеточного цикла: митоз (М), синтетическую (S), пресинтетичеекую (G1, от англ. дар - интервал), постсинтетическую (G2) 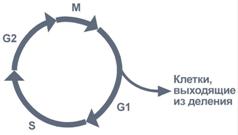 Фазы клеточного цикла Важное участие в регуляции смены фаз клеточного цикла занимают циклины - белки массой 35-90 кДа, уровень которых меняется входе клеточного цикла. По функции циклимы - это активаторные субъединицы ферментов циклин-зависимызс киназ (ЦЗК). Атвные комплексы циклин-ЦЗК фосфорилируют внутриклеточные белки, изменяя их активность. Этим обеспечивается продвижение по клеточному циклу. Синтез (репликация, удвоение) ДНК происходит в S-фазу клеточного цикла, когда клетка готовится к делению. Механизм репликации, как установили Мэтыю Мезельсон и Франклин Сталь в1957-г, полуконсервативный, т.е. на каждой нити материнской ДНК синтезируется дочерняя копия. 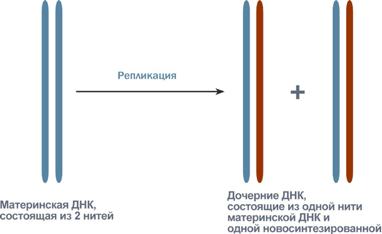 Как любой матричный биосинтез, репликация требует наличия нескольких компонентов:
Синтез ДНК начинается в определенных участках, получивших название точка ori (англ. origin – начало). На каждой ДНК млекопитающих точек ori насчитывается до 100. Репликация распространяется от этих участков в обе стороны по нитям ДНК с образованием репликативных "пузырей". В каждом таком "пузыре" имеются две репликативные "вилки", в которых происходит расплетание, раскручивание и непосредственный синтез ДНК. При этом репликативные вилки удаляются друг от друга. В целом репликация всех ДНК у эукариот заканчивается за 9 часов. Синтез новой цепи ДНК идет в направлении от 5'-конца к 3'-концу, т.е. 5'-конец новой ДНК остается свободным, следующие нуклеотиды присоединяются к 3'-гидроксильной группе предыдущего нуклеотида со скоростью порядка 100 штук в секунду. В репликативной вилке в направлении 5'→3' непрерывно (т.е. обычным заурядным присоединением последующих нуклеотидов к предыдущим через С3 и С5) синтезируется только одна нить, а именно та, для которой направление синтеза совпадает с направлением движения репликативной вилки и соответствует направлению материнской нити 3'→5'. По мере расплетания ДНК и движения репликативной вилки на этой материнской нити открываются участки, где возможно безостановочное удлинение ведущей дочерней нити. Направление 5'→3' для другой дочерней нити ДНК противоположно движению репликативной вилки. Поэтому синтез этой отстающей нити (в направлении 5'→3') возможен только после расплетания части ДНК и освобождения участка для синтеза. Таким образом, синтез дочерней ДНК идет фрагментарно. По имени японского исследователя синтезируемые на отстающей цепи отрезки ДНК назвали фрагменты Оказаки. |
