Лекции по органической химии 1 курс. Введение органическая химия
 Скачать 1.47 Mb. Скачать 1.47 Mb.
|
Галогенирование карбоновых кислотГалогены могут замещать водород в углеводородных радикалах кислот, образуя галогенкарбоновые кислоты; при этом под влиянием карбоксильной группы наиболее легко замещаются атомы водорода в -положении к этой группе, т.е. при соседнем с карбоксилом углеродном атоме: СH3—CH2—CH2—COOH + Br2 CH3—CH2—CHBr—COOH + HBr масляная кислота -броммасляная к-та Возможно и более глубокое замещение водорода. Так, при действии хлора на уксусную кислоту все атомы водорода метильной группы постепенно замещаются на хлор; в результате образуются хлоруксусные кислоты: CH3—COOH + Cl2 CH2Cl—COOH + HCl уксусная к-та монохлоруксусная к-та CH2Cl—COOH + Cl2 CHCl2—COOH + HCl дихлоруксусная к-та CHCl2—COOH + Cl2 CCl3—COOH + HCl Трихлоруксусная к-та Монохлоруксусная кислота (Тпл. 61,5 оС) и трихлоруксусная кислота (Тпл. 59 оС) – кристаллические вещества; дихлоруксусная кислота – жидкость (Ткип. 194 оС). Галогенпроизводные кислоты дают все характерные для карбоксильной группы реакции, но в результате влияния, оказываемого на эту группу галогеном, они являются во много раз более сильными кислотами и приближаются в этом отношении к сильным неорганическим кислотам (Кдисс. = 1,410-3, 3,3210-2 и 2,010-1 для моно-, ди- и трихлоруксусных кислот, соответственно). Способы получения одноосновных кислотКарбоновые кислоты часто встречаются среди природных продуктов как в свободном, так и особенно в виде сложных эфиров. При гидролизе последних образуется кислота и спирт: R—C—O—R' + H—OH R—C—OH + R'—OH II II O эфир O кислота спирт В частности, таким путем получают высшие одноосновные кислоты при гидролизе жиров. Большое значение имеют синтетические способы получения кислот. Окисление углеводородовНепредельные углеводороды могут легко окисляться с распадом молекулы по месту двойной связи; в качестве продуктов окисления получаются и кислоты. Предельные углеводороды окисляются также с распадом молекулы, но значительно труднее, причем разрыв углеродной цепи может происходить в ее различных местах; поэтому в результате образуются сложные смеси карбоновых кислот. В настоящее время разработано каталитическое окисление предельных углеводородов кислородом воздуха при умеренных температурах. Например: О2 СН3—СН2—СН3 СН3—СООН + НСООН соли Са, Mn Окисление первичных спиртов и альдегидовПервичные спирты и альдегиды гладко окисляются, образуя карбоновые кислоты с тем же числом углеродных атомов; при этом спирт окисляется в альдегид, а последний – в кислоту: R—CH2 R—CH R—C—OH I II II OH O O перв. спирт альдегид кислота Можно использовать альдегиды, получаемые методом оксосинтеза. Таким образом, сырьем для получения кислот могут служить этиленовые углеводороды и окись углерода. Гидролиз тригалогенпроизводных При нагревании с растворами щелочей галогенпроизводных, у которых три атома галогена находятся при одном и том же атоме углерода, получаются карбоновые кислоты.     Cl 3NaOH OH О Cl 3NaOH OH ОС   H3—CH2—C—Cl CH3—CH2—C—OH CH3—CH2—C—OH + H3—CH2—C—Cl CH3—CH2—C—OH CH3—CH2—C—OH +Cl -3NaCl неустойчивый OH пропионовая к-та H2O 1,1,1-трихлорпропан трехатомн. спирт Промежуточно образуется трехатомный спирт с тремя гидроксилами при одном углероде; такие спирты сразу же выделяют воду, превращаясь в кислоту. Гидролиз нитриловПри действии солей синильной (цианистоводородной) кислоты на галогенпроизводные углеводородов образуются нитрилы кислот: R—Cl + K—CN R—CN + KCl Нитрилы гидролизуются до карбоновых кислот. Эту реакцию можно представить следующим суммарным уравнением:   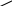     ОН О Н2О ОН О Н2ОR—CN + H2O R—C=NН R—C—NН2   нитрил нитрил R—C—OH + NH3 II О кислота аммиак При нитрильном синтезе получаются кислоты, содержащие на один углеродный атом больше, чем исходные галогенпроизводные, т.е. достигается наращивание углеродной цепи. Так, например, из хлорэтан может быть получена пропионовая кислота: +K—CN +2H2 O СН3—СН2—Cl CH3—CH2—CN CH3—CH2—COOH хлорэтан -KCl нитрил пропио- -NH3 пропионовая кислота новой кислоты Отдельные представители предельных одноосных кислотМуравьиная кислота Н-СООН. Безводная муравьиная кислота – бесцветная жидкость с резким запахом. Технический продукт представляет собой нераздельно кипящую смесь с водой (Ткип. 107,3 оС), содержащую 77,5 % кислоты. Как уже указано, муравьиная кислота в отличии от других кислот содержит в соединении с карбоксилом не углеводородный радикал, а водород, и из ее формулы видно, что в ней имеется как бы альдегидная группа С=О, соединенная с гидроксилом. Поэтому, подобно альдегидам муравьиная кислота является сильным восстановителем и окисляется до угольной кислоты, разлагающейся с образованием СО2 и Н2О. В частности, она восстанавливает окись серебра (реакция серебряного зеркала): Н-С-ОН + Ag2O 2Ag + HO—C—OH CO2 + H2O NH4 OH О О муравьиная кислота угольная кислота Под действием серной кислоты при нагревании муравьиная к-та разлагается, образуя окись углерода и воды: Н-СООН СО + Н2О В природе свободная муравьиная кислота встречается в выделениях муравьев, в соке крапивы, в поте животных. В промышленности муравьиную кислоту получают, пропуская окись углерода через нагретую щелочь: NaOH + CO H—COONa муравьинокислый натрий Из образовавшейся соли муравьиную кислоту выделяют действием разбавленной серной кислоты: H—COONa + H2SO4 H—COOH + NaHSO4 Применяют муравьиную кислоту при крашении тканей, в качестве восстановителя, в различных органических синтезах. Уксусная кислота СН3-СООН Безводная уксусная кислота – бесцветная жидкость с характерным острым запахом, ее иначе называют ледяной уксусная кислотой, т.к. она замерзает уже около +16 оС, образуя кристаллическую массу, напоминающую лед. Обычная крепкая уксусная кислота (уксусная эссенция) содержит 70-80 % кислоты. Уксусная кислота – одно из наиболее давно известных органических веществ, в древности ее получали в виде уксуса при скисании вина. Она широко распространена в природе, содержится в выделениях животных, в растительных организмах, образуется в результате процессов брожения и гниения в кислом молоке, в сыре, при прогаркании масла и т.п. В промышленности уксусную кислоту получают следующими способами: Из ацетилена (синтетическая уксусная кислота). Путем гидратации ацетилена по реакции Кучерова получают уксусный альдегид, последний кaталитически окисляют кислородом воздуха в уксусную кислоту. Схема процесса: НОН O2 СНСН СН3—СН=О СН3—СООН ацетилен Hg уксусный альдегид кат. уксусная кислота Исходным сырым для получения уксусной кислоты по этому способу фактически является уголь (С) и известь (СаО), т.к. из них в электрических печах получают карбид кальция (СаС2), а из последнего действием воды – необходимый для синтеза уксусной кислоты ацетилен. Этим способом в настоящее время получают основное количество уксусной кислоты. Из этилена (синтетическая уксусная кислота).   PdCl2, CuCl2 O О2 PdCl2, CuCl2 O О2СН2=СН2 СН3—С—Н СН3—СООН H2O, O2 кат. уксусная кислота Уксуснокислым брожением жидкостей, содержащих этиловый спирт (биохимическая уксусная кислота). Под влиянием бактерий Micoderma aceti («уксусного грибка»), зародыши которых в изобилии имеются в воздухе, этиловый спирт в разбавленном водном растворе (до 10%) окисляется кислородом воздуха в уксусную кислоту по следующему суммарному уравнению: О2 СН3—СН2—ОН СН3—СООН + Н2О Этот процесс называется уксуснокислым брожением, он происходит при участии вырабатываемого «уксусным грибком» энзима и протекает сложным путем, через ряд промежуточных стадий. Обычно берут вино или пиво, которые при стоянии на воздухе, в результате окисления имеющегося в них спирта, постепенно «скисают» и превращаются в натуральный уксус. Последний содержит 5-8 % уксусной кислоты и в таком виде его употребляют в пищу, а также для приготовления маринадов (консервированных овощей, грибов, рыбы и т.п.). Путем дробной перегонки из уксуса можно получать уксусную эссенцию. Этим способом в настоящее время получают сравнительно небольшое количество уксусной кислоты. Сухой перегонкой дерева (лесохимическая уксусная кислота). При сухой перегонке дерева одним из продуктов является водный слой, содержащий до 10 % уксусной кислоты. Его нейтрализуют известью, при этом образуется кальциевая соль уксусной кислоты (СН3СОО)2Са (древесный порошок), которую обрабатывают рассчитанным количеством серной кислоты, таким образом, выделяют концентрированную уксусную кислоту. Окисление углеводородов нефти. Этот способ весьма перспективен и в последние годы приобретает все большее значение. Н.М. Эммануэлем предложен и разработан процесс прямого окисления бутана кислородом воздуха при 145 оС и 50 атм. по схеме: Р, t, О2 2СН3-СН2-СН2-СН3 2СН3СООН + СН3-СО-СН2-СН3 + 2Н2О бутан уксусная кислота метилэтилкетон Выход уксусной кислоты достигает 80 %, побочный продукт – метилэтилкетон. В качестве исходного можно использовать бутан из попутного нефтяного газа. Уксусная кислота широко применяется в пищевой и химической промышленности, в производстве лекарственных веществ, для получения уксусного ангидрида и т.п. Уксусный ангидрид в свою очередь применяется в производстве пластических масс, искусственного шелка и др. Бензойная кислота С6Н5СООН. Кристаллизуется в виде бесцветных пластинок или игл, плавящихся при 121 оС, легко растворимых в спирте и эфире, но трудно растворимых в воде. В настоящее время бензойная кислота довольно широко применяется в промышленности красителей. Бензойная кислота обладает антисентическими свойствами и поэтому используется для консервирования пищевых продуктов. Значительное применение находят также различные производные бензойной кислоты. С6Н5СООН можно получить: 1. Путем окисления самых различных производных бензола, имеющих одну боковую цепь, например, толуола, этилбензола, бензилового спирта и т.д.: С6Н5СН3 С6Н5СООН 2. Из бензонитрила, который для этого гидролизуют кислотой или щелочью: Высшие жирные кислоты и их соли (мыла) Важнейшими представителями высших предельных одноосновных кислот являются пальмитиновая (С15Н31СООН) и стеариновая (С17Н35СООН) кислоты. Обе они имеют нормальную (неразветвленную) цепь углеродных атомов и представляют собой бесцветные твердые воскообразные вещества. Эфиры этих кислот с глицерином – основная составная часть различных, главным образом твердых, жиров и масел, пальмитиновая кислота в виде эфиров с высшими спиртами входит в состав пчелиного воска и т. н. спермацета (эфир пальмитиновой кислоты и цетилового спирта С15Н31-СО-ОС16Н33), добываемого из головы морского животного кашалота. Путем гидролиза жиров, масел и воска высшие жирные кислоты могут быть получены в свободном виде. Твердая смесь стеариновой и пальмитиновой кислот, отделяемая путем отжима от жидких кислот, называется стеарином, последний применяют для изготовления свечей. Пальмитиновая и стеариновая кислоты, так же как и другие представители высших кислот, хорошо растворимы в органических растворителях (спирт, эфир и др.) и совершенно не растворимы в воде. Однако они растворяются в водных растворах щелочей (KOH, NaOH, Na2CO3 и др.), т.к. образуют растворимые в воде соли щелочных металлов. Например: C15H31COOH + NaOH C15H31COONa + H2O пальмитиновая к-та пальмитат натрия C17H35COOH + KOH C17H35COOK +H2O стеариновая к-та стеарат калия Соли щелочноземельных металлов (Са, Ва и др.) не растворимы в воде, так же как соли тяжелых металлов (например, Рb). |
