Зачем врачу нужна биологическая химия
 Скачать 6.47 Mb. Скачать 6.47 Mb.
|
У гемоглобина есть молекулярные болезниСерповидно-клеточная анемияHbS – гемоглобин серповидно-клеточной анемии. При этом нарушении в ДНК в результате точковой мутации триплет ЦТТ заменен на триплет ЦАТ, что влечет за собой включение в 6-м положении β-цепи вместоглутаматааминокислоты валина. Изменение свойств β-цепи влечет изменение свойств всей молекулы и формирование на поверхности гемоглобина "липкого" участка. При дезоксигенации гемоглобина участок "раскрывается" и связывает одну молекулу гемоглобина S с другими подобными. Результатом является полимеризация гемоглобиновых молекул и образование крупных белковых тяжей, вызывающих деформацию эритроцита и при прохождении капилляров гемолиз. 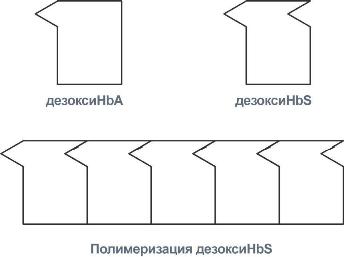 Схема отличия гемоглобина S от гемоглобина А и его полимеризацияНарушение синтеза гемоглобинаПорфирииПорфирии – это группа гетерогенных наследственных заболеваний, возникающих в результате нарушения синтеза гема и повышения содержания порфиринов и их предшественников в организме. Выделяютнаследственныеи приобретенныеформы порфирии. Приобретенныеформы порфирий носят токсический характер и вызываются действием гексахлорбензола, солей свинца и других тяжелых металлов (ингибирование порфобилиногенсинтазы, феррохелатазы и др.), лекарственными препаратами (антигрибковый антибиотик гризеофульфин). При наследственныхформах дефект фермента имеется во всех клетках организма, но проявляется только в одном типе клеток. Можно выделить две большие группы порфирий: 1. Печеночные– группа заболеваний с аутосомно-доминантными нарушениями ферментов различных этапов синтеза протопорфирина IX. Наиболее ярким заболеванием этой группы является перемежающаяся острая порфирия, при которой у гетерозигот активность уропорфириноген-I-синтазы снижена на 50%. Заболевание проявляется после достижения половой зрелости из-за повышенной потребности гепатоцитов вцитохроме Р450 для обезвреживания половых стероидов, обострение состояния также часто бывает после приема лекарственных препаратов, метаболизм которых требует участия цитохрома Р450. Потребление и снижение концентрации гема, необходимого для синтеза цитохрома Р450, активирует аминолевулинатсинтазу. В результате больные экскретируют с мочой большие количества порфобилиногена и аминолевулиновой кислоты. На свету порфириноген окисляется в окрашенные порфобилин и порфирин, и это является причиной потемнения мочи при ее стоянии на свету при доступе воздуха. Симптомами являются острые боли в животе, запоры, сердечно-сосудистые нарушения, нервно-психические расстройства. 2. Эритропоэтические– аутосомно-рецессивные нарушения некоторых ферментов синтеза протопорфирина IX в эритроидных клетках. При этом смещается баланс реакций образования уропорфириногенов в сторону синтеза уропорфириногена I. Симптомы заболевания схожи с предыдущим, но дополнительно наблюдается светочувствительность кожи, обусловленная наличием уропорфириногенов, кроме этого отмечаются трещины на коже и гемолитические явления. ТалассемииДля талассемий характерно снижение синтеза α-цепей гемоглобина (α-талассемия) или β-цепей (β-талассемия). Это приводит к нарушению эритропоэза, гемолизу и тяжелым анемиям. Эффективность транспорта кислорода регулируетсяИзменение рН средыВлияние рН на сродство гемоглобина к кислороду носит название эффекта Бора. При закислении среды сродство снижается, при защелачивании – повышается. При повышенииконцентрации протонов (закисление среды) в тканях возрастает освобождение кислорода из оксигемоглобина. Влегких после удаления угольной кислоты (в виде СО2) из крови и одновременном увеличении концентрации кислорода высвобождаются ионы Н+ из гемоглобина. Реакция взаимодействия кислорода с гемоглобином упрощенно имеет вид: Изменение сродства гемоглобина к кислороду в тканях и в легких при изменении концентрации ионов H+ и О2обусловлено конформационными перестройками глобиновой части молекулы. В тканях ионы водорода присоединяются к остаткам гистидина, образуя восстановленный гемоглобин (H-Hb) с низким сродством к кислороду. В легких поступающий кислород "вытесняет" ион водорода из связи с остатком гистидина гемоглобиновой молекулы. 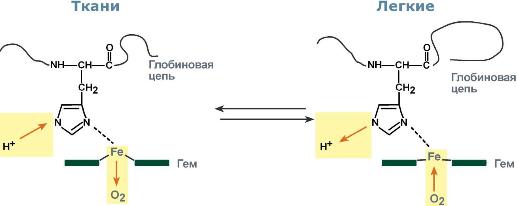 Механизм эффекта БораКооперативное взаимодействиеВзаимовлияние протомеров олигомерного белка друг на друга называется кооперативное взаимодействие. В легких такое взаимодействие субъединиц гемоглобина повышает его сродство к кислороду и ускоряет присоединение кислорода в 300 раз. В тканяхидет обратный процесс, сродство снижается и ускорение отдачи кислорода также 300-кратное. 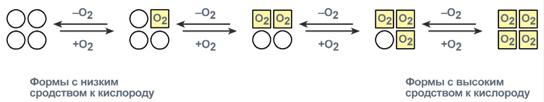 Схема кооперативного взаимодействия субъединиц гемоглобинаОбъясняется такой феномен тем, что в легких при присоединении первой молекулы кислорода к железу (за счет 6-й координационной связи) атом железа втягивается в плоскость гема, кислород остается вне плоскости. Это вызывает перемещение участка белковой цепи и изменение конформации первого протомера. Такой измененный протомер влияет на другие субъединицы и облегчает связывание кислорода со второй субъединицей. Это меняет конформацию второй субъединицы, облегчая присоединение последующих молекул кислорода и изменение других протомеров. 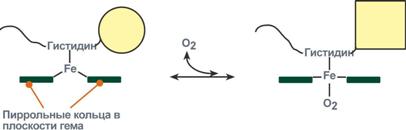 Изменение формы субъединиц гемоглобина при присоединении кислородаРоль 2,3-дифосфоглицерата2,3-Дифосфоглицерат образуется в эритроцитах из 1,3-дифосфоглицерата, промежуточного метаболитагликолиза, в реакциях, получивших название шунт Раппопорта. 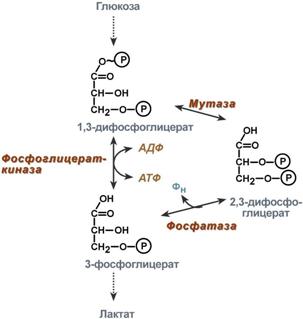 Реакции шунта Раппопорта2,3-Дифосфоглицерат располагается в центральной полости тетрамера дезоксигемоглобина и связывается с ?-цепями, образуя поперечный солевой мостик между атомами кислорода 2,3-дифосфоглицератаи аминогруппами концевого валина обеих ?-цепей, также аминогруппами радикалов лизинаи гистидина. 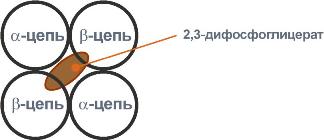 Расположение 2,3-дифосфоглицерата в гемоглобинеФункция 2,3-дифосфоглицерата заключается в снижении сродства гемоглобина к кислороду. Это имеет особенное значение при подъеме на высоту, при нехватке кислорода во вдыхаемом воздухе. В этих условиях связывание кислорода с гемоглобином в легких не нарушается, так как концентрация его относительно высока. Однако в тканях за счет 2,3-дифосфоглицерата отдача кислорода возрастает в 2 раза. |
