Фармхимия. Задача 1 1
 Скачать 1.75 Mb. Скачать 1.75 Mb.
|
Метенамин (МНН)Применяют как антисептическое средство внутрь по 0,5-1 г и внутривенно по 5-10 мл 40% раствора. Метенамин легко растворим в воде, растворим в этаноле и хлороформе, но очень мало растворим в эфире. Характерное его свойство – способность возгоняться без плавления. Он горюч и используется как “сухой спирт”. Является гетероциклическим азотсодержащим соединением. Получают гексаметилентетрамин конденсацией формальдегида с аммиаком: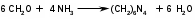 Для подтверждения подлинности сравнивают ИК-спектры поглощения испытуемого образца в области 4000 – 400 см-1 с прилагаемым к ФС рисунком спектра. Реакция гидролиза в кислой среде рекомендуется для испытания на подлинность этого лекарственного вещества: 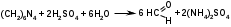 Выделяющийся при нагревании препарата формальдегид определют по запаху и по реакции с салициловой кислотой (образуется ауриновый краситель):  красное окрашивание После гидролиза добавляют раствор щелочи, появляется запах аммиака: (NH4)2SO4 + 2NaOH → 2NH3↑ + Na2SO4 + 2H2O При хранении растворов препарата в результате гидролиза образуется аммиак и параформ. Их обнаруживают с реактивом Несслера. В присутствии солей аммония образуется желтый осадок.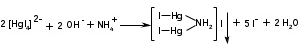 Параформ вводной среде подвергается гидролизу с образованием метаналя: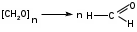 , ,который с реактивом Несслера образунт осадок металлической ртути.  Количественное определение гексаметилентетрамина проводят путем гидролиза в присутствии титрованного раствора кислоты серной. Избыток серной кислоты оттитровывают щелочью: 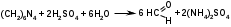 H2SO4 + 2NaOH → Na2SO4 + 2H2O Количественное определение можно выполнить методом ацидиметрии: (CH2)6N4 + HCl → (CH2)6N4·HCl Хранят в хорошо уцупоренной таре при температуре не выше 20, учитывая его способность возгоняться. Поскольку он в растворах легко гидролизуется, их нельзя стерилизовать. ЗАДАЧА 20.  Бензилпенициллина натриевая соль Бензилпенициллина натриевая сольBenzylpenicillinum natrium Состав и форма выпуска. Препарат получают путем биосинтеза из продукта жизнедеятельности плесневого гриба -Penicillium chrysogenum. Белый, мелкокристаллический порошок горького вкуса, слегка гигроскопичен. Легко разрушается под действием кислот, щелочей, спиртов, окислителей, солнечного света, желудочного сока, при нагревании в водных растворах, также при воздействии пенициллиназы. Легко растворим в спирте, воде и физиологическом растворе. Выпускают во флаконах по 100000, 125000, 200000, 250000, 300000, 500000, 1000000 ЕД активного вещества. Фармакологическое действие. В основе антибактериального действия пенициллина лежит угнетение синтеза полимера мукопептида, входящего в состав клеточной стенки микробов. Пенициллин резко нарушает обменные процессы чувствительных к нему микроорганизмов. В зависимости от концентрации в крови его действие бывает бактериостатическим или бактерицидным, бактерицидные концентрации обычно в 2 - 4 раза выше бактериостатических. Структурными фрагментами лекарственного вещества являются: 6-аминопенициллановая кислота, которая включает конденсированные тиазолидиновый (А) и β-лактамный (В) циклы:   Бензилпенициллин содержит также радикал бензил: Подлинность натриевой соли бензилпенициллина подтверждают методом УФ-спектрофотометрии. ИК-спектры идентифицируют по совпадению с полосами поглощения стандартных образцов в области 4000 – 400 см-1. Для испытания подлинности бензилпенициллина натриевой соли используют цветную реакцию, основанную на разрыве β-лактамного цикла и образовании медной соли гидроксамовой кислоты (осадок зеленого цвета): 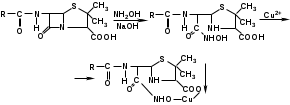 В лекарственном веществе можно обнаружить органически связанную серу по реакции с солями свинца после превращения её в сульфид-ион сплавлением с едкими щелочами: S2- + Pb(CH3COO)2 → PbS↓ + 2CH3COO- черн. В препарате открывают ион натрия реакцией по окраске пламени горелки в желтый цвет после минерализации путем сжигания в тигле. Количественное определение заключатся в определении суммы пенициллинов иодиметрическим методом после щелочного гидролиза лекарственного вещества: 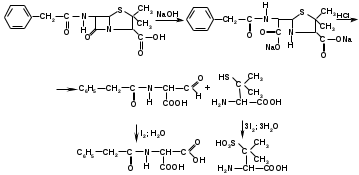  Избыток иода оттитровывают тиосульфатом натрия: I2 + 2Na2S2O3 → 2NaI + Na2S4O6 Активность препарата устанавливают микробиологическим методом по антибактериальному действию на определенный штамм золотистого стафилококка по угнетению зон роста микроорганизмов испытуемым и стандартным образцами. 2  1. 1. Пиридоксина гидрохлорид. Pyridoxini hydrochloridum Витамин В6 (МНН) 2-метил-3-окси-4,5-ди-(оксиметил)-пиридина гидрохлорид Являясь производным пиридина, пиридоксина гидрохлорид имеет полосу поглощения в УФ-области. В структуре вещества содержатся: фенольный гидроксил, две карбинольные группы, третичная аминогруппа, пиридиновый цикл и хлорид-ион. Фенольный гидроксил обнаруживают по образованию соли красного цвета при взаимодействии с раствором хлорида железа (III). С  огласно ФС подлинность пиридоксина подтверждается реакцией образования индофенольного красителя с 2,6-дихлорхинонхлоримидом (голубое окрашивание): огласно ФС подлинность пиридоксина подтверждается реакцией образования индофенольного красителя с 2,6-дихлорхинонхлоримидом (голубое окрашивание):голубое окрашивание Наличие в молекуле третичной аминогруппы подтверждают с помощью общеалкалоидных реактивов (Бушарда, Драгендорфа, Майера) по образованию комплексных солей, выпадающих в осадок (бурый, оранжевый, белый соответственно). Хлорид-ион обнаруживают с нитратом серебра, по выпадению белого творожистого осадка: HCl + AgNO3 → AgCl↓ + HNO3 Количественное определение. Так как пиридоксина гидрохлорид является солью слабого основания, то его количественно определяют: а) методом неводного титрования в среде безводной уксусной кислоты в присутствии раствора ацетата ртути (титрант – 0,1 моль/л раствор хлорной кислоты, индикатор – кристаллический фиолетовый): 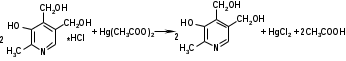  HClO4 + CH3COOH → ClO4- + CH3COOH2+ R3N+—H + ClO4- → R3N+—H∙ClO4- CH3COO- + CH3COOH2+ → 2CH3COOH б) методом нейтрализации по связанной хлороводородной кислоте в присутствии спирта для растворения выделяющегося основания лекарственного вещества (титрант – 0,1 моль/л раствор гидроксида натрия, индикатор – бромтимоловый синий). Можно применять для анализа методы аргентометрии и меркуриметрии. Пиридоксина гидрохлорид можно количественно определить спектрофотометрическим, фотоколориметрическим методами, а также аргентометрическим, алкалиметрическим методами. 22. 1. Для оформления протокола анализа травы полыни горькой (цельное сырье) напишите латинские названия сырья, производящего растения и семейства. Дайте характеристику сырьевой базы и отличия от других видов полыни. 2. Приведите описание внешних признаков сырья, зарисуйте картину микроскопии с указанием анатомо-диагностических признаков полыни горькой; напишите формулы основных действующих веществ; фармакологическую группу, препараты и применение. Полынь горькая —ArtemisiaabsinthiumL.; семейство Астровые (Сложноцветные) — Asteraceae (Compositae). Химический состав Полынь горькая содержит ароматические горечи: ведущей группой БАС является эфирное масло (околс 0,5-2%), в составе которого доминируют бициклические монотерпены — α-туйон и β-туйон (3-10%), туйол (25-75%) и другие терпеноиды — моноциклические терпены (фелландрен), бициклические сесквитерпены (кадинен, бисаболен); второй группой БАС являются горечи — сесквитерпены абсинтин, при расщеплении которого образуется артабсин. При перегонке эфирного масла артабсин и другие сесквитерпены превращаются в смесь хамазулена, гвайазулена и артемазулена (масло зеленого цвета).  Среди сопутствующих веществ интерес представляют ароматические полиины (капиллин), флавоноиды, которые могут влиять на желчегонную активность. Применение Препараты (настой, настойка, экстракт густой, сбор аппетиный, сбор желудочный, сложная горькая настойка и др.) применяются как классические горько-пряные желудочные средства, возбуждающие аппетит. Данные средства применяются также при заболеваниях печени и желчного пузыря. Полынь горькая широко используется также в ликеро-водочной промышленности («Вермут»).  Кислота фолиевая (МНН) Acidum folicum N-{4-[(2-амино-4-окси-6-птеридил)-метил]-амино}-бензоил-L(+)-глутаминовая кислота .Основу структуры составляет гетероциклическая система – птеридин, состоящая из конденсированных гетероциклов: пиримидина и пиразина. 2-амино-4-оксиптеридин известен под названием птерин, который является структурной основой птериновой кислоты, входящей в состав фолиевой кислоты: 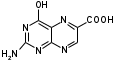 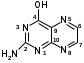 птерин птериновая кислота К  роме птериновой части в состав структуры кислоты фолиевой входят остатки п-аминобензойной и глютаминовой кислот: роме птериновой части в состав структуры кислоты фолиевой входят остатки п-аминобензойной и глютаминовой кислот: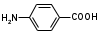 п-аминобензойная кислота глютаминовая кислота Фолиевая кислота имеет характерный спектр поглощения в УФ-области. П 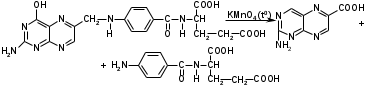 о химическим свойствам кислоту фолиевую можно отнести к амфотерным веществам, так как в ее структуре содержатся функциональные группы кислотного и основного характера. Фолиевая кислота легко окисляется с образованием птериновой кислоты (для этого используют раствор перманганата калия и нагревание до 80-85ºС) и п-аминобензоилглутаминовой кислоты: о химическим свойствам кислоту фолиевую можно отнести к амфотерным веществам, так как в ее структуре содержатся функциональные группы кислотного и основного характера. Фолиевая кислота легко окисляется с образованием птериновой кислоты (для этого используют раствор перманганата калия и нагревание до 80-85ºС) и п-аминобензоилглутаминовой кислоты:При обручении УФ-светом птериновая кислота флуоресцирует голубым светом. Фолиевая кислота обнаруживается с помощью реакции комплексообразования с солями тяжелых металлов в слабощелочной среде. Образуются осадки различных цветов. Количественное определение Фолиевую кислоту также количественно определяют спектрофотометрическим методом по собственному поглощению в УФ-области спектра, а также фотоколориметрическим методом по реакции образования азокрасителя. 2  3. 3.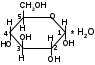 Глюкоза (МНН) Кислота аскорбиновая (МНН) Glucosum Acidum ascorbinicum Glucose γ-лактон 2,3-дигидро- α-D-глюкопираноза L-гулоновой кислоты Глюкоза. По химическому строению глюкозу относят к альдегидам, поэтому она обладает окислительно-восстановительными свойствами. Альдегидную группу глюкозы обнаруживают реакцией образования «серебряного зеркала» с аммиачным раствором нитрата серебра:  Глюкоза также дает положительную реакцию с реактивом Фелинга:  Для количественного определения глюкозы используют как химические, так и физико-химические методы. Основным титриметрическим методом является иодиметрия. Глюкозу окисляют в щелочной среде, затем после подкисления непрореагировавший иод оттитровывают тиосульфатом натрия: I2 + 2NaOH → NaIO + NaI + H2O 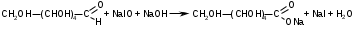 NaIO + H2SO4 + NaI → Na2SO4 + I2 + H2O I2 + 2Na2S2O3 → 2NaI + Na2S4O6 Из физико-химических методов используется поляриметрический метод. Зная удельное вращение (  ), длину кюветы (l, дм) и измерив угол вращения () можно вычислить концентрацию (%) глюкозы: ), длину кюветы (l, дм) и измерив угол вращения () можно вычислить концентрацию (%) глюкозы: . .Кислота аскорбиновая. По химическим свойствам кислота аскорбиновая является сильным восстановителем. В кристаллической форме устойчива, но в растворах в присутствии слабых окислителей быстро окисляется до дегидроаскорбиновой кислоты:  дегидроаскорбиновая кислота В качестве окислителей используют: растворы нитрата серебра, хлорида железа (III), раствор иода, перманганат калия и др. Кислотные свойства проявляет за счет наличия в молекуле двух енольных гидроксилов. Наиболее подвижным является водород в положении 3 (одноосновная кислота). С растворами щелочей образуются однозамещенные, бесцветные, растворимые в воде соли:  Согласно ФС кислоту аскорбиновую количественно определяют иодатометрическимп методом. Титрант – 0,1 моль/л раствор иодата калия. Титрование проводят в присутствие иодида калия: 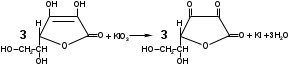 KIO3 + 5KI + 6HCl → 3I2 + 6KCl + 3H2O Избыток иода окрашивает индикатор (крахмал) в синий цвет. Кроме того, используются иодиметрический и алкалиметрический (титрование раствором гидроксида натрия) методы. Используют фотоколориметрические способы, основанные на образовании окрашенных продуктов. В данной лекарственной форме кислоту аскорбиновую обнаруживают по реакции с нитратом серебра. Образуется серый осадок металлического серебра. Обнаружению глюкозы мешает кислота аскорбиновой, так как она тоже проявляет восстановительные свойства. Поэтому вначале проводят окисление кислоты аскорбиновой раствором йода, а затем выполняют реакцию на глюкозу с нитратом серебра. Количественное определение ингредиенотов данной лекарственной формы проводят путем титрования вначале кислоты аскорбиновой 0,1М раствором йода до желтого окрашивания. К оттитрованной жидкости добавляют гидроксид натрия и избыток раствора йода. Затем прибавляют разведенную серную кислоту. Выделившийся йод оттитровывают 0,1М раствором тиосульфата натрия (индикатор – крахмал): 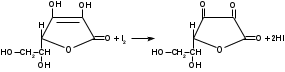  I2 + 2Na2S2O3 → 2NaI + Na2S4O6 ЗАДАЧА 24. 1. Кодеина фосфат (Codeini phosphas) – наркотическое противокашлевое ЛС. 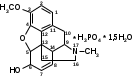 П 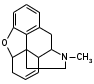 о химическому строению кодеина фосфат относится к N-метилпроизводным морфинана (фенантренизохинолина): о химическому строению кодеина фосфат относится к N-метилпроизводным морфинана (фенантренизохинолина):   изохинолин дигидрофуран N-метилморфинан В составе молекулы имеются функциональные группы: - третичный атом азота; - метоксигруппа; - связанная фосфорная кислота 2. Возможны следующие типы реакций: - реакции окисления, обусловленные восстановительными свойствами частично гидрированных циклов фенантренизохинолинового ядра;- реакции осаждения с общеалкалоидными реактивами, обусловленные наличием третичного атома азота; - реакции осаждения основания кодеина щелочами. 3. Подтверждение подлинности кодеина фосфата: Инструментальные методы: ИК- и УФ-спектрофотометрия Химические реакции: 1) Реакции осаждения с общеалкалоидными реактивами (Бушарда, Драгендорфа, Майера, и др.) за счет третичной аминогруппы 2) Реакция окисления под действием кислот (образования апоморфина), основанная на восстановительных свойствах, обусловленных наличием частично гидрированных циклов фенантренизохинолинового ядра:  апоморфин От капли раствора хлорида железа (Ш) раствор приобретает синее окрашивание за счет фе- нольного гидроксила (реакция комплексообразования), а при последующем добавлении азотной кислоты появляется красное ок- рашивание. 3) Реакция с реактивом Марки (раствор формальдегида в концентрированной серной кислоте). Наблюдается пур- пурное окрашивание, переходящее в сине-фиолетовое. (вначале происходит гидролиз метоксигруппы, а затем реакция образования ау- ринового красителя) 4) Под действием концентрированной азотной кислоты приобретает неизменяющийся оранжевый цвет (реакция окисления, основанная на восстановительных свойствах). 5) Реакция осаждения оснований из растворов при при бавлении раствора NaOH. Выделенные основания имеют характерную температуру плавления. 6) Фосфат-ион обнаруживают: а) с раствором нитрата серебра – образуется желтый осадок: H3PO4 + 3AgNO3 → Ag3PO4↓ + 3HNO3 б) с молибдатом аммония – образуется желтый осадок: H3PO4 + 12(NH4)2MoO4 + 21HNO3 → (NH4)3PO4·12MoO3↓ + 21NH4NO3 + 12H2O Количественное определение:1) Метод неводного титрования. Обоснование: усиление основных свойств вещества Титрант: 0,1М хлорная кислота Среда: безводная уксусная кислота. Индикатор: кристаллический фиолетовый Химизм: 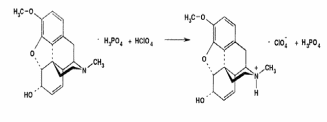 f = 1 2) Метод алкалиметрии, вариант вытеснения Обоснование: наличие связанной фосфорной кислоты. Титрант: NaOH. Индикатор: фенолфталеин. В реакционную смесь добавляют хлороформ для извлечения основания кодеина Химизм: R3N·H3PO4 + 2NaOH → R3N↓ + Na2HPO4 + 3H2O f = ½ Задача 25 1. Сульфокамфокаин:  Сульфокамфокаин представляет собой смесь кислоты сульфокамфорной и основания новокаина (прокаина). По внешнему виду представляет собой прозрачную слегка желтоваую жидкость. Химические свойства обусловлены наличием в молекулах следующих групп: - кислота сульфокамфорная – сульфогрупа и кетогруппа; - новокаин – первичная ароматическая аминогруппа, сложноэфирная группа, третичный том азота. 2. Подлинность подтверждается с помощью химических реакций на функциональные группы: 1) На сульфогруппу (―SO3H) сульфокамфорной кислоты – после минерализации с последующим добавлением раствора бария хлорида (образуется осадок белого цвета):  2) На кетогруппу сульфокамфорной кислоты – по реакции взаимодействия с 2,4-динитрофенилгидразином. В результате образуется гидразон желтого цвета: 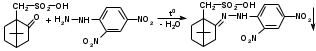 3) На первичную ароматическую аминогруппу (Ar―NH2), содержащуюся в прокаине реакцией образования азокрасителя (реактивы: раствор NaNO2; разведенная HCl, затем щелочной раствор β-нафтола): 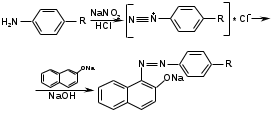 4) На сложноэфирную группу, содержащуюся в прокаине (гидроксамовая проба) – появляется красное окрашивание: 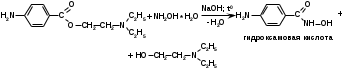  3. количественное определение: 1) Нитритометрический метод (прокаин) Обоснование: способность ароматической аминогруппы вступать в реакцию диазотирования Титрант – 0,1 М NaNO2, в присутствии HCl, катализатор – KBr. Индикатор: смесь тропеолина 00 и метиленового синего. Переход окраски: от красно-фиолетовой до голубой. Титруют медленно и на холоду Химизм:  f = 1 2) Алкалиметрический метод (кислота сульфокамфорная) в присутствии хлороформа для растворения выделяющегося основания новокаина. Обоснование: кислотные свойства вещества. Титрант: NaOH. Индикатор: фенолфталеин. Переход окраски: от бесцветной до розовой 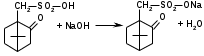 Задача 26 1 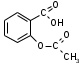 . Кислота ацетилсалициловая - Acidum acetylsalicylicum, салициловый эфир уксусной кислоты: . Кислота ацетилсалициловая - Acidum acetylsalicylicum, салициловый эфир уксусной кислоты:Фармакологическая группа: НПВС Применение: как противовоспалительное, жаропонижающее, обезболивающее средство. 2. Кислота ацетилсалициловая – сложный эфир кислот салициловой и уксусной. Относится к эфирам ароматических кислот. Это белый кристаллический порошок без запаха. Мало растворим в воде, легко растворим в 95% этиловом спирте и щелочах. УФ-спектр 0,007%-ного растворакислоты ацетилсалициловой в хлороформе имеет в области260-350 нм максимум поглощения при 278 нм, а УФ-спектр 0,001%-ного раствора в 0,1 М растворесерной кислоты в области 220-350 нм — два максимума при 228 и 276 нм и один минимум поглощения при 257 нм. Химические свойства кислоты ацетилсалициловой проявляются за счет входящих в ее структуру сложноэфирной и карбоксильной групп. 3. Качественные реакции: 1) Рц гидролиза - основана на разрушении молекулы под действием щелочи:  Затем смесь подкисляют H2SO4 разв. и наблюдают образование осадка салициловой кислоты: 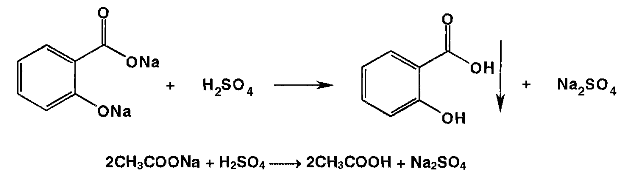 К фильтрату, содержащему уксусную кислоту, прибавляют этаноли концентрированную серную кислоту — образуется уксусноэтиловый эфир, имеющий характерный запах:  С  алициловую кислоту идентифицируют по образованию фиолетового окрашивания после прибавления раствора железа (III) хлорида: алициловую кислоту идентифицируют по образованию фиолетового окрашивания после прибавления раствора железа (III) хлорида:2) Кислота ацетилсалициловая взаимодействует с реактивом Марки (СН2O + к. Н2SO4) с образованием ауринового красителя:   Количественное определение: Алкалиметрический метод, вариант нейтрализации.Обоснование: кислотные свойства вещества.Титрант: NaOH. Индикатор: фенолфталеин. Растворитель: нейтрализованный по фенолфталеину этанол Химизм: 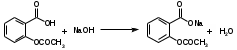 Известны методики количественного определения с использованием спектрофотометрического метода. 5. Способ количественного определения кислоты аскорбиновой: Метод иодометрии. Обоснование: способность кислоты аскорбиновой к окислению Титрант: калия йодат в присутствии калия йодида. Индикатор: крахмал. Изменение окраски: от бесцветной до синей Химизм: 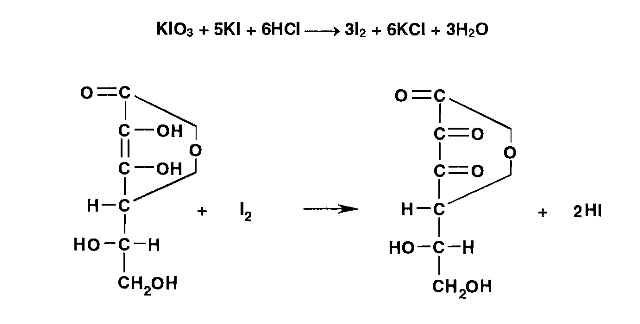 f = ½ 6. Аскорбиновая кислота неустойчива, под даже слабых окислителей она окисляется до дегидроаскорбиновой кислоты. Процесс обрати Задача 27 1. Камфора - Camphora 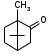 Белые кристаллические куски или бесцветный кристаллический порошок, или прессованные плитки с кристаллическим строением, легко режущиеся ножом, слипающиеся в комки, отличается сильным характерным запахом и пряным горьковатым, а затем охлаждающим вкусом. Камфора практически нерастворима в воде, легко растворима в этаноле, очень легко — в эфире, хлороформе, легко растворима в жирных маслах. Образует густые прозрачные жидкости (эвтектические смеси) с фенолом, ментолом, тимолом, хлоралгидратом, а также постепенно возгоняется даже при обычной температуре, образуя в верхних частях сосуда кристаллический сублимат. При осторожном нагревании полностью возгоняется без обугливания. Горит светлым пламенем, флуоресцирует в УФ-свете. В медицинской практике применяют d, l изомеры и рацемат. Согласно НД удельное вращение ( 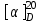 ) для: ) для:а) l-изомера находится в пределах от –39º до -44º (10% спиртовый раствор); б) d-изомера +44,3º (10% спиртовый раствор); в) рацемата от –1º до +1º. Камфора является бициклическим терпеном. 2. Подлинность подтверждается по характерному спектру поглощения. Качественные реакции: 1) Кетонная группа (>C=O) обнаруживается с помощью реакций образования гидразонов (образуется белый или желтый осадок): 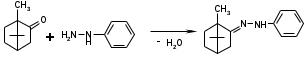 2) Метиленовая группа обнаруживается с помощью реакции конденсации с альдегидами, в присутствии серной кислоты концентрированной: 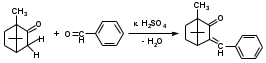 Количественное определение: Оксимный метод Обоснование: способность камфоры образовывать оксим под воздействием гидроксиламина Оксимы определяются гравиметрически  Выделившееся в эквивалентное количество кислоты хлористоводородной можно определить алкалиметрически по фенолфталеину: HCl + NaOH → NaCl + H2O. Задача 28 |
