Фармхимия. Задача 1 1
 Скачать 1.75 Mb. Скачать 1.75 Mb.
|
|
Для этого: 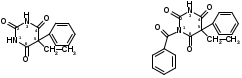 Фенобарбитал (МНН). Phenobarbitalum Бензобарбитал (МНН) 5-этил-5-фенилбарбитуровая кислота Benzobarbitalum Бензонал 1-бензоил-5-этил-5- фенилбарбитуровая кислота Фенобарбитал и бензонал относятся к производным барбитуровой кислоты. Подлинность фенобарбитала и бензонала можно установить по УФ- и ИК-спектрам. Для испытания подлинности фенобарбитала и бензонала используют химические реакции, основанные на соле- и комплексообразовании с солями тяжелых металлов. Фенобарбитал и бензонал образуют нерастворимые соли с ионами серебра, ртути (II), меди (II), кобальта (II). При взаимодействии с ионами серебра происходит образование однозамещенных (растворимых в воде) и двузамещенных (нерастворимых в воде) солей серебра:  В отличие от фенобарбитала, бензонал, содержащий заместитель у N1, образует только однозамещенные соли. Фенобарбитал и бензонал можно идентифицировать сплавлением с едкими щелочами, так как они при этом разрушаются с выделением аммиака: 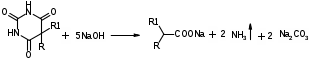 Фенильный радикал в фенобарбитале и бензонале обнаруживают по образованию нитросоединений, окрашенных в желтый цвет:  Специфичной для бензонала является реакция с хлоридом железа (III) после предварительного гидролиза. Образующийся при гидролизе бензонала бензоат-ион образует с ионом железа (III) розовато-желтый осадок: 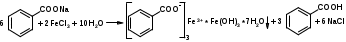 Поскольку фенобарбитал и бензонал проявляют слабые кислотные свойства, для количественного определения применяют неводное титрование в среде диметилформамида. Титруют 0,1 М раствором натрия гидроксида (в смеси метанола и бензола). Диметилформамид, являясь основным растворителем, присоединяет протон, усиливая при этом кислотные свойства барбитуратов:  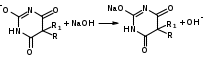 HCO+NH(CH3)2 + OH- → HCON(CH3)2 + H2O Количественное определение бензонала выполняют в спиртовом растворе, титруя его 0,1 М водным раствором гидроксида натрия до синего окрашивания. БИЛЕТ 39 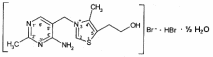 Тиамина бромид. Thiamini bromidum Тиамин (МНН) 4-метил-5-β-оксиэтил-N-(2'-метил-4'-амино-5'-метилпиримидил)-тиазолий бромида гидробромида полугидрат Тиамина бромид. Thiamini bromidum Тиамин (МНН) 4-метил-5-β-оксиэтил-N-(2'-метил-4'-амино-5'-метилпиримидил)-тиазолий бромида гидробромида полугидратОснову химической структуры тиамина составляют два гетероцикла — пиримидин и тиазол. Гиповитаминозы и авитаминозы В; Воспалительные и дегенеративные процессы в периферических нервах: различные формы невритов, алкогольные и постинфекционные полиневриты, радикулиты, невралгии, периферические парезы и параличи различного происхождения, болезнь Меньера, психоз Корсакова, полиомиелит и энцефаломиелит, болезнь Вернике; Поражения центральной нервной системы в результате травмы, коммоций, особенно при резких болях; вегетативные неврозы, мигрени; Сердечно-сосудистые неврозы, сопровождающиеся тахикардией, миастения; Язвенная болезнь желудка и двенадцатиперстной кишки, Ослабление секреторной и двигательной функций желудочно-кишечного тракт (атония кишечника и др.); Ухудшение регенерации тканей после ранений, раневое истощение; Нарушения питания (алиментарная дистрофия); Дистрофия миокарда, нарушения коронарного кровообращения у больных стенокардией; Тиреотоксикоз; Эндартериит; Неврогенные дерматозы Наличие пиримидинового и тиазолового ядра в молекуле тиамина бромида обусловливает характерные ИК- и УФ-спектры. Идентифицируют тиамина бромида с помощью реакции, основанной на окислении тиамина в щелочной среде. Эта реакция известна под названием тиохромной пробы:  Тиохром из водных растворов извлекают бутиловым или изоамиловым спиртом. Спиртовые растворы при ультрафиолетовом облучении имеют характерную синюю флуоресценцию. Тиамина бромид дает характерные реакции на бромиды: по реакции окисления до свободного брома (который окрашивает слой хлороформа в желто-бурый цвет) и по реакции с серебра нитратом: 2HBr + Cl2 → Br2 + 2HCl NaBr + AgNO3 → AgBr↓ + NaNO3 Основание тиамина из растворов осаждается общеалкалоидными реактивами. Тиамина бромид количественно определяют в водной среде способом, основанным на нейтрализации гидробромида и последующем аргентометрическом титровании суммы бромид-ионов:  БИЛЕТ 40 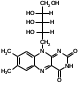 Рибофлавин (МНН). Riboflavinum Рибофлавин (МНН). RiboflavinumИзоаллоксазиновый цикл в молекуле рибофлавина связан с остатком рибитола. Рибофлавин имеет характерную желто-оранжевую окраску, обусловленную несколькими сопряженными связями в молекуле. Является амфотерным соединением. Его кислотные свойства обусловлены наличием подвижного атома водорода имидной группы, а основные – наличием нескольких гетероциклических атомов азота. Нейтральные водные растворы рибофлавина имеют яркую зеленовато-жёлтую окраску и зеленую флуоресценцию, вследствие чего возможно провести его анализ спектро- и фотоколориметрическими методами. Рибофлавин оптически активен. Оптическая активность рибофлавина обусловлена наличием в остатке рибозы трёх асимметрических атомов углерода. Рибофлавин можно идентифицировать по ИК-спектру. При восстановлении сульфитом натрия, рибофлавин переходит в бесцветный лейкорибофлавин: 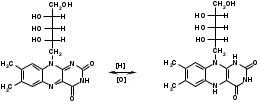 Под влиянием света он неустойчив в кислой, и щелочной средах. Так, щелочной среде образует люмифлавин, а в нейтральной и слабокислой – люмихром, в этом случае физиологическая активность рибофлавина исчезает. 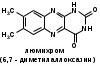  Люмифлавин в растворах имеет окрашивание и флуоресценцию, растворяется в хлороформе. Как азотсодержащее органическое основание, рибофлавин дает положительную реакцию с общеалкалоидными (осадительными) реактивами. С солями металлов (серебра, кобальта, меди, ртути и др.) рибофлавин образует нерастворимые окрашенные комплексные соединения Для количественного определения рибофлавина в субстанции и в лекарственных формах используются физико-химические методы: флуориметрический, фотоколориметрический и спектрофотометрический. |
