Фармхимия. Задача 1 1
 Скачать 1.75 Mb. Скачать 1.75 Mb.
|
|
ЗАДАЧА 34
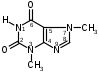
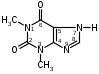
Оба вещества – это производные ксантина. Они являются алкалоидами и содержат третичные аминогруппы. Подлинность теобромина и теофиллина можно установить по УФ- и ИК-спектрам поглощения. Наличие третичных аминогрупп в молекулах лекарственного вещества дает возможность проведения реакций с осадительными алкалоидными реактивами. Общегрупповой реакцией для алкалоидов производных пурина является мурексидная проба: 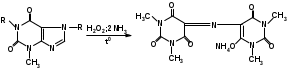 аммонийная соль тетраметил- пурпуровой кислоты Реакции отличия Теофиллин и теобромин обладают кислотными свойствами, так как имеют атом водорода в 7- и 1-положениях соответственно. На этих особенностях химического строения основаны реакции с хлоридом кобальта и нитратом серебра с получением осадков различного цвета и консистенции:  ф фтеоброминат кобальта теоброминат серебра серовато-голубой желатинообразная масса Теофиллин с солями кобальта образует розоватый осадок, а с солями серебра – студенистый осадок. Методы количественного определения основаны на кислотно-основных свойствах теобромина и теофиллина. Теобромин, как слабое органическое основание, определяют методом неводного титрования в среде муравьиной кислоты и уксусного ангидрида. 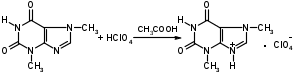 На кислотных свойствах обоих веществ основан метод заместительной нейтрализации после взаимодействия с серебра нитратом: 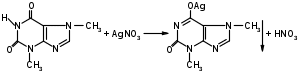 Выделяется эквивалентное количество азотной кислоты, которую титруют щелочью: HNO3 + NaOH → NaNO3 + H2O. БИЛЕТ 35 Для проведения аналитического контроля и заключения о качестве субстанций: 1.
Оба вещества являются органическими азотистыми основаниями, производными бензилизохинолина. Фармгруппа - миотропные спазмолитики. Папаверин впервые выделен Мерком в 1884 г из опия, ктр содержит 0,4-1,5% этого алкалоида. В 1910 г был осуществлен сиетез папаверина. Синтезируют папаверин из ветрового альдегида(3,4-диметоксибензальдегида) и гиппуровой кислоты и другими методами. Природный и синтетический папаверин идентичны в фармакологическом отношении.Дротаверин - полусинтетический аналог папаверина. Формы выпуска раствор в ампулах, таблетки. 2. Папаверин: Описание. Белый кристаллический порошок без запаха, слегка горь-коватого вкуса. Растворимость. Медленно растворим в 40 ч. воды, мало растворим в 95% спирте, растворим в хлороформе, практически нерастворим в эфире. Кислотность. рН 2% раствора 3,0-4,5 (потенциометрически).Дротаверин: светло-желтый или зеленовато-желтый кристаллический порошок без запаха или почти без запаха. Раствор считают прозрачным, если его опалесценция не превышает таковую стандартного опалесцирующего раствора. Раствор считают бесцветным, если при сравнении его окраска по интенсивности не превышает окраску любого из стандартных окрашенных растворов, сравнение проводят со стандартным окрашенным раствором наиболее подходящего оттенка. Оба вещества являются органическими азотистыми основаниями, производными бензилизохинолина, и вступают в реакции с осадительными (А) и специальными (Б) реактивами: А. Реактив Драгендорфа, реактив Шейблера, реактив Майера. Б. Кислота азотная концентрированная, кислота серная концентрированная, реактив Марки, реактив Фреде, реактив Эрдмана, реактив Манделина. В результате этих реакция образуются окрашенные или флюоресцирующие продукты. Из физико-химических методов анализа для идентификации возможно использование ИК-спектроскопии. Растворы обоих веществ в различных растворителях характеризуются избирательным поглощением в УФ - свете, что используется для идентификации папаверина и дротаверина. 3. Для проведения количественной оценки папаверина гидрохлорида и дротаверина гидрохлорида как в субстанциях, так и лекарственных формах, можно предложить следующие методы анализа: а) неводное титрование в среде ледяной уксусной кислоты для обоих веществ: 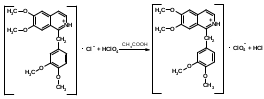 б) наличие в молекулах папаверина гидрохлорида и дротаверина гидрохлорида кислоты хлороводородной позволяет определить эти вещества методами аргентометрии и алкалиметрии. Хранят по списку Б в хорошо укупоренной таре , в защищенном от света месте, чтобы не допустить окисления. Растворы папаверина гх при хранении под действием света и кислорода приобретают желтое окрашивание, что обусловлено образованием продуктов окисления - солянокислых растворов папаверинола и папаверальдина. Стабильность лекарственных средств является важным требованием, обеспечивающим как необходимый срок их годности (экономическая эффективность использования), так и исключение возможности появления продуктов различных химических реакций, оказывающих побочное, токсическое действие или приводящих к снижению или какому – либо другому изменению фармакологического действия. Особое значение имеет стабильность инъекционных растворов. В процессе изготовления и особенно хранения некоторых инъекционных растворов происходит более или менее заметные изменения их свойств, связанные со снижением их активности, или изменения физико-химических свойств. Чаще всего в инъекционных растворах изменения связаны с протеканием тех или иных химических реакций, что требует стабилизации растворов в процессе приготовления. Различают физические и химические способы стабилизации инъекционных растворов. Физические способы стабилизации основаны на защите лекарственных веществ от неблагоприятных условий внешней среды, как в процессе изготовления, так и хранения лекарственного средства, на использовании высокочистых лекарственных и вспомогательных веществ и др. Химические способы стабилизации основаны на введении в растворы для инъекций специальных вспомогательных веществ, называемых стабилизаторами. Основными путями деструкции лекарственных препаратов в растворах для инъекций являются реакции гидролиза и окисления. Для стабилизации растворов для инъекций, в которых протекают реакции гидролиза, могут использоваться как физические, так и химические способы. К физическим способам можно отнести обезвоживание растворов, т.е. удаление воды, используя сублимационную или липофильную сушку, сразу из свежеприготовленных лекарственных форм. Инъекционные растворы в этом случае готовят непосредственно перед их введением в организм больного. К этому способу прибегают при изготовлении лекарственных средств антибиотиков, ферментов и других. Кроме того, в качестве физического способа стабилизации используются неводные растворители: водорастворимые – полиэтиленоксиды, пропиленгликоль, поливиниловый спирт и др.; жирорастворимые – этилолеат, бензилбензоат и др. Они могут использоваться как в чистом виде, так и в смеси. Химический путь стабилизации реакций гидролиза зависит от химической природы лекарственного вещества. Для подавления реакции гидролиза солей, образованным слабым основанием и сильной кислотой (соли алкалоидов, синтетических азотистых оснований и др.), к раствору для инъекций добавляют 0,1н раствор кислоты хлористоводородной. БИЛЕТ 36 Для проведения аналитического контроля и заключения о качестве лек субстанции: 1. 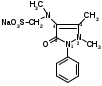 Анальгин. Analginum Метамизол-натрия (МНН) Анальгин. Analginum Метамизол-натрия (МНН)1-фенил-2,3-диметил-4-метиламинопиразолон-5-N-метансульфонат натрия Молекула анальгина содержит в своей структуре пятичленный гетероцикл пиразол. Применяют в качестве болеутоляющих, жаропонижающих и противовоспалительных средств. Внутрь при головных болях,невралгиях,артритах.можно подкожно,внутримышечно,внутривенно. Для испытания на подлинность анальгина используют ИК- и УФ-спектрофотометрию. Анальгин обладает окислительно-восстановительными, основными свойствами, вступает в реакцию разложения. С раствором хлорида железа (III) анальгин образует продукты окисления, окрашенные в синий цвет. Анальгин дает положительную реакцию на ион натрия, а при нагревании на водяной бане с минеральными кислотами выделяет диоксид серы и формальдегид, которые обнаруживают по запаху: 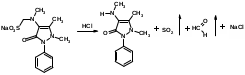 После охлаждения прибавляют раствор хлорида железа (III); через 2 мин появляется темно-красное окрашивание. Анальгин с серной концентрированной и салициловой кислотами дает интенсивное красное окрашивание (за счет остатка формальдегида образуется ауриновый краситель):  Серу в анальгине обнаруживают также путем прокаливания в смеси натрия и калия карбонатов. Образовавшиеся сульфат-ионы обнаруживают с помощью раствора хлорида бария: SO42- + Ba2+ → BaSO4↓ Ввиду наличия основных свойств анальгин образует осадки с осадительными(общеалкалоидными) реактивами. Для количественного анализа используют восстановительные свойства растворов анальгина. Иодометрическое определение анальгина выполняют методом прямого титрования иодом в слабокислой водно-спиртовой среде (до окисления серы (IV) в серу (VI)): 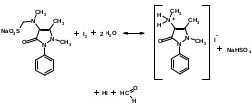 Конечную точку титрования можно установить по избытку титрованного раствора иода (желтое окрашивание). Хранят в хорошо укупоренной таре, предохраняющей от действия света по списку Б. Особенно чувствителен к действию света и влаги, банки оранж стекла. Пожелтение при хранении связано с воздействием температуры, кислорода,света, воздуха, процессом гидролиза. БИЛЕТ 37 Фармацевтическая фирма-дистрибьютер закупила раствор для инъекций "Реопирин" и сырьё листья сенны. В состав раствора для инъекций входят ЛС след структуры Phenazone — феназон (Антипирин) Бесцветные кристаллы или белый кристаллический порошок без запаха. Т. пл. 110-113°С Phenylbutazone — фенилбутазон (Бутадион) Белый или белый со слегка желтоватым оттенком порошок. Т. пл. 104-107°С Для испытания на подлинность производных пиразола используют ИК- и УФ-спектрофотометрию. На основе исследований ИК-спектров разработана схема идентификации производных пиразола по расположению характеристических полос поглощения. НД рекомендует подтверждать подлинность по ИК-спектрам, снятым в виде спрессованных таблеток лекарственных веществ с бромидом калия в области 4000-400 см1, которые должны полностью совпадать с прилагаемыми к ФС рисунками спектров. Производные пиразола можно идентифицировать с помощью УФ-спектров. Раствор феназона в 0,1 М серной кислоте имеет максимум поглощения при 230 нм. Водные растворы метамизола-натрия характеризуются максимумами поглощения при 237 и 270 нм, а растворы в этаноле — при 236,5 и 264,5 нм. Раствор пропифеназона в воде имеет максимум поглощения при 240 нм. фенилбутазона в 0,01 М растворе гидроксида натрия — при 263-265 нм, а в этаноле — при 240 нм. Фенилбутазон может быть окислен только в более жестких условиях (действием концентрированной серной кислотой в присутствии нитрита натрия). При нагревании появляется оранжевое окрашивание, переходящее в более стойкое вишневое окрашивание, и выделяются пузырьки газа. Феназон в этих условиях приобретает красно-оранжевое, а метамизол- натрий — буро-желтое окрашивание. Реакции окисления фенилбутазона обусловлены наличием в его молекуле остатка гидразобензола, который окисляется до окрашенных производных азобензола: 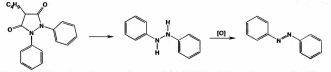 При действии раствора дихромата калия в концентрированной серной кислоте феназон и метамизол-натрий приобретают зеленое окрашивание, а фенилбутазон — темно-красное. Идентифицировать производные пиразола можно с помощью цветных реакций, которые они дают с различными реактивами: концентрированной азотной кислотой, смесью концентрированных азотной и серной кислот, с 0,5%-ным раствором ванадата аммония в концентрированной серной кислоте, 1 %-ным раствором и-диметиламинобензалъдегида в разведенной хлороводородной кислоте (после погружения в кипящую водяную баню). Фенилбутазон можно идентифицировать реакциями осаждения солями: меди (осадок бледно-голубого цвета); серебра (белого цвета) и т. д. Для выполнения реакции вначале получают натриевую соль фенилбутазона, действуя раствором гидроксида натрия (происходит образование енольной формы):  Затем к натриевой соли добавляют раствор сульфата меди: 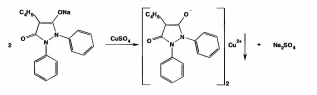 Феназон и метамизол-натрий под действием раствора сульфата меди (II) приобретают зеленое окрашивание. Производные пиразола ввиду наличия основных свойств дают характерные реакции с осадительными (общеалкалоидными) реактивами. При нагревании метамизола-натрия с реактивом Миллона (раствор ртути в азотной кислоте) возникает темно-синее окрашивание. При испытаниях на чистоту особое внимание следует уделять обнаружению специфических примесей. В феназоне обнаруживают органические примеси, а также бензолсульфонат натрия (по прозрачности 10%-ного раствора в дихлорэтане). Посторонние примеси (не более 0,5%) в метамизоле-натрия устанавливают методом ТСХ на пластинках Силуфол УФ-254, сравнивая с СОВС 4-аминофеназона. Хроматографируют восходящим методом в камере с системой хлороформ-метанол (9:1), сушат и просматривают в УФ-свете при 254 нм, сравнивая пятна и значения Rf. В фенилбутазоне устанавливают отсутствие примеси гидразобензола по отрицательной цветной реакции с хлоридом железа (III) в среде концентрированной серной кислоты. Йодхлорометрическое определение, основанное на реакции замещения, можно использовать для определения фе- нилбутазона, который растворяют при нагревании в 0,1 М растворе гидроксида натрия, нейтрализуют 0,1 М раствором хлороводородной кислоты и в среде натрия гидрокарбоната титруют 0,1 М раствором йодмонохлорида (индикатор крахмал): 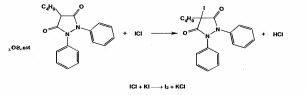 Количественное определение пропифеназона выполняют методом неводного титрования, используя в качестве растворителя диоксан. Титрантом служит 0,1 М раствор хлорной кислоты в ледяной уксусной кислоте (индикатор кристаллический фиолетовый). Количественное определение фенилбутазона по ФС основано на нейтрализации раствора навески в ацетоне 0,1 М раствором гидроксида натрия с применением индикатора фенолфталеина. В этом способе использованы кислотные свойства енольной формы фенилбутазона:  Количественное определение пропифеназона в лекарственных формах выполняют методом ВЭЖХ, одновременно подтверждая его подлинность. На хроматограмме испытуемого раствора образуется пик с временем удерживания и УФ-аб- сорбционными характеристиками, аналогичными хроматограмме раствора сравнения пропифеназона. Для количественного определения используют обращенно-фазовый вариант ВЭЖХ. Неподвижная фаза — октадецилсилил на силикагеле (5 мкм), подвижная фаза — метанол-вода-0,01 М фосфорная кислота. Предложены также способы количественного определения методом И К-спектрофотометрии в области «отпечатков пальцев»: феназона (1140 см-1), фенилбутазона (1590 см ')- В качестве растворителей использовали хлороформ или тетра- хлорметан. Относительная погрешность определения ±0,5-1,0%. Производные пиразола хранят в хорошо укупоренной таре, предохраняющей от действия света, по списку Б Производные пиразола применяют в качестве болеутоляющих, жаропонижающих и противовоспалительных средств. пропифеназон назначают внутрь при головных болях, невралгиях, артритах и других заболеваниях по 0,25-0,5 г на приемФенилбутазон назначают главным образом при острых формах ревматизма и полиартритов по 0,1 -0,15 г. Пропифеназон проявляет анальгезирующее действие в несколько раз более сильное, чем феназон. Он входит в состав анальгетических лекарственных форм (саридон) по 0,15 г. БИЛЕТ 38 Фармацевтическая фирма-дистрибьютер закупила таблетки фенобарбитала и бензонала и лекарственное растительное сырьё ьрава горца перечного |