Ответы к Колойдной химии экзамен, Мирэа тхт. Все лекции по колде. 1. Предмет коллоидной химии. Почему поверхностные явления и дисперсные системы изучают в рамках одной дисциплины коллоидной химии Значение коллоидной химии для технологии
 Скачать 2.71 Mb. Скачать 2.71 Mb.
|
|
1. Предмет коллоидной химии. Почему поверхностные явления и дисперсные системы изучают в рамках одной дисциплины -коллоидной химии? Значение коллоидной химии для технологии. П 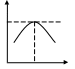 од дисперсной системой понимают гетерогенную систему состоящую минимум из 2 фаз. Фаза состоит из отдельных частиц называемых дисперсной фазой(она непрерывна и дисперсна). Фаза в которой распределены частицы называют дисперсной средой(она непрерывная и сплошная). Ультрадисперсные системы: размер 1-100нм. Объекты: пленки, нити, капилляры, тк в них больше всего проявляются поверхностные явления. од дисперсной системой понимают гетерогенную систему состоящую минимум из 2 фаз. Фаза состоит из отдельных частиц называемых дисперсной фазой(она непрерывна и дисперсна). Фаза в которой распределены частицы называют дисперсной средой(она непрерывная и сплошная). Ультрадисперсные системы: размер 1-100нм. Объекты: пленки, нити, капилляры, тк в них больше всего проявляются поверхностные явления.n,% 50 10-9 l,м Фундаментальные особенности ультрадисперсного состояния вещества: состояние которое находится между молекулярным соединением и компактной массой материала. Причины характеризующие ультрадисперсные частицы:1)ns=nv; Fs=U 2)колебания поверхностных атомов ультрадисперсных частиц происходит с большей амплитудой и меньшей частотой, чем в объеме 3)если размеры частиц в пределах 10-30нм, то в металлических частицах возникают 2 типа-1) внешняя икосаиндрическая 2) внутренняя 4) структура ультрадисперсных частиц метастабильна и соответствует энергонасыщенному состоянию вещества, что приводит к усилению физико-химических и физико-механических свойств. 2. Признаки объектов коллоидной химии: гетерогенность и дисперсность. -Гетерогенность- качественный признак изучаемых объектов, указывающий на наличие нескольких фаз (σмф) -Дисперсность (раздробленность) вещества -количественный признак. Оценивается 3 параметрами: 1) d, l, a- метры 2) D-дисперсность =1/а (м-1) 3)удельная поверхность Sуд=S12/V (м-1); Sуд=S12/V (м2/кг); Sуд=4πr2/(4/3) πr3=3/r- для сферической частицы. Оба признака неотделимы друг от друга. -Поверхностная энергия: F= σмф* S12 Основные свойства лиозолей:1) рассеянье света (ополиссенция) 2)медленная диффузия 3) малое и непостоянное по величине осмотическое давление 4)диализ 5)электрофорез 5) седиментационная устойчивость 7) способность к выпадению осадка при механическом воздействии или добавлении электролита, происходит без теплового эффекта(коагуляция) 3. Классификация дисперсных систем по размерам частиц дисперсной фазы. Подразделяются на 1) ультрадисперсные (ультрамикрогетерогенные) частицы, размер 1-100нм 2) микрогетерогенные 10-7(-6)-10-5(-4) (1-100мкм) 3) грубодисперсные больше 10-4 S 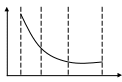 уд уд1-молекулярнодисперсные( не могут образовывать дисперсных фаз) 1 2 3 4 2- ультрадисперсные 3- микрогетерогенные 4- грубодисперсные d, м 4. Классификация дисперсных систем по агрегатному состоянию дисперсной фазы и дисперсной среды.
5. Классификация дисперсных систем по взаимодействию дисперсной фазы и дисперсионной среды.
6. Классификация дисперсных систем по взаимодействию частиц дисперсной фазы. Свободнодисперсные системы(без структурные системы, аэрозоли, дымы, суспензии, эмульсии) Связнодисперсные системы(гели, пены эмульсии). 7. Классификация поверхностных явлений. 1) физические- изотермическая перегонка, смачивание, коагуляция (способность к выпадению осадка при механическом воздействии или добавлении электролита, происходит без теплового эффекта); в твердых телах- трение, адгезия. 2) химические- адсорбция, коррозия dG=SdT+VdP+σdS+Σμini+φdq 1) σdS ↔dG, увеличение дисперсности следовательно увеличение реакционоспособности 2) σdS ↔SdT, может переходить в теплоту( при изотермической перегонке, смачивании) 3) σdS ↔ VdP,может переходить в механическую энергию ( при адсорбции, адгезии) 4) σdS ↔ Σμini, может переходить в химическую энергию (когезия) 5) σdS ↔ φdq, может переходить в электрическую энергию (двойной электрический слой)  Термодинамика поверхностного слоя Термодинамика поверхностного слоя   δ  толщина поверхностного слоя толщина поверхностного слоя8. Общие причины отличия состояния поверхностного слоя от объемных фаз. Изменение плотности свободной энергии на границе раздела в лиофобных и лиофильных системах. О  тличия:1) отличие внутренней энергии Uα≠Uβ≠Us 2) взаимодействие в поверхностном слое осуществляется в нескомпенсированном силовом поле. тличия:1) отличие внутренней энергии Uα≠Uβ≠Us 2) взаимодействие в поверхностном слое осуществляется в нескомпенсированном силовом поле.Несимметричное силовое поле( на поверхности) сила направлена в более плотное силовое поле dA=-σdS dF=σdS σ поверхностное натяжение- обратимая изотермическая работа образования единицы поверхности, которая затрачивается на преодоление межмолекулярных сил и переходит в поверхностную энергию; сильно зависит от температуры и полярности вещества. 3  ) число компонентов не равны между собой niα≠niβ≠ns 4) S α≠S β≠Ss ) число компонентов не равны между собой niα≠niβ≠ns 4) S α≠S β≠SsSs >Sβ Ss >Sα Интенсивные и экстенсивные свойства гетерогенных систем Интенсивные свойства- при составлении сложной системы выравниваются независимо от количества (p,T,μi, (дF/дv) δ-толщина поверхностного слоя 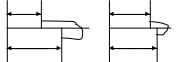 f δ≈10А°, F>0 f δ≈100-1000А° f f Лиофобная система лиофильная система Экстенсивность- при составлении сложной системы свойства складываются, зависят от количества вещества (m, ni, U, S, F, G)Uα=Uβ=Us 9. Поверхностное натяжение, его определения и размерности. Поверхностное натяжение- изменение свободной энергии приходящееся на единицу площади. Σ- расстояние по обе стороны от границы раздела фаз за пределами которого св-ва слоя перестают отличаться от свойств объемных фаз; сила действующая на единицу длинны контура, направленная тангенсально к нему и стремящаяся этот контур сократить. (Дж /м2б Н/м), (эрг/см2, дин/см). 10. Метод избыточных величин Гиббса. Вывод фундаментального уравнения Гиббса для свободной энергии системы с плоской границей раздела фаз. 2 понятия. Разделяющая поверхность- фиктивная разделяющая поверхность, на которой происходит разрыв непрерывно в плоскостях( m, S, F). Поверхность разрыва –толщина поверхностного слоя. Предпосылки: α и β включают в себя часть поверхностного слоя и считается однородным вплоть до раздела поверхности. Разделяющая поверхность- это гетерогенная поверхность, воспроизводящая форму поверхности разрыва и параллельная ей. Каждая точка разделяющей поверхности находится в одинаковых условиях, положение поверхности фиксировано по величине адсорбции, разность между экстенсивными величинами в реальной и идеальной системе представляет собой избыточную величину, которую относят к разделяющей поверхности. В  ывод: ывод:Г, α dV α Ж, β dS β Для открытой системы: Для открытой системы: 11. Вывод фундаментального уравнения Гиббса для свободной энергии плоского поверхностного слоя, его анализ. δ< 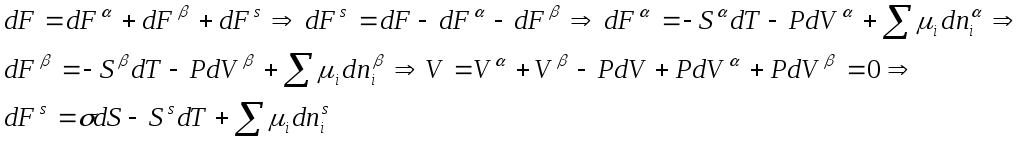 σdS -работа увеличения единицы поверхности; SdT –связанная энергия слоя; Σμidnis- вещественный обмен между фазами и поверхностным слоем. Анализ уравнения Гиббса для плоского поверхностного слоя: 1) Поверхностное натяжение-изменение свободной энергии приходящейся на единицу площади. 2) 12. Понятие об адсорбции. Причины адсорбции. Количественные характеристики адсорбции. Адсорбция- процесс выравнивания химических потенциалов между поверхностью и объектом, приводящий к изменению концентрации компонента на поверхности. Адсорбция- сгущение( концентрирование) вещества на границе раздела фаз. dF>0, F. Причина адсорбции- уменьшение поверхностной энергии dF и Σμidni. Условия адсорбции: выходит на поверхность компонент, который приводит к уменьшению поверхностного натяжения. Тs=Tα=Tβ Количественные характеристики адсорбции: а (моль/г), (кмоль/кг)-емкость монослоя Α (моль/см2), (кмоль/м2)-поверхностная концентрация. Г- гибсовская адсорбция =ni/S (кмоль/м2), показывает избыток числа молей компонента в поверхностном слое по сравнению с содержанием в объеме. 13. Вывод адсорбционного уравнения Гиббса для разбавленных растворов, его анализ. Адсорбция на границе раствор газ отличается от адсорбции на границе газ-тв тело 1) тем, что система трехкомпонентна 2) в в жидкости адсорбционное равновесие устанавливается медленнее, чем в газе 3) адсорбция не локализовала 4)к описанию адсорбции применим термодинамический подход. Вывод: Для разбавленных растворов: Анализ: 1)↑с ↓σ- ПАВ , для ПАВ g>0; (дσ/дc)<0 , Г>0. ПАВ- вещества способные адсорбироваться на границе фаз, имеют дифильное строение. К ПАВ относятся- карбоновые кислоты и их соли, соли сульфокислот, алкил бензолсульфонаты. – характерно: малая растворимость в данном растворителе, - σпав всегда меньше σраств,  - взаимодействие ПАВ-растворитель всегда меньше, чем взаимодействие растворитель-растворитель. - взаимодействие ПАВ-растворитель всегда меньше, чем взаимодействие растворитель-растворитель.σ Г ПАВ σ0 ПАВ с с 2)ПИВ характерно: ↑с ↓σ g<0; (дσ/дc)> 0 , Г<0- находятся в объеме раствора (электролиты)  σ Г высокая растворимость σр-ля< σр-ра σ Г высокая растворимость σр-ля< σр-ра взаимодействие ПИВ-р-тель>р-тель-р-тель ПИВ σ0 с с ПИВ 3)ПНВ ↑с ↓σ g=0; (дσ/дc)= 0 , Г=0 σр-ра= σр-ля( сахара)   σ Г σ ГПНВ σ0 ПНВ    с с с с | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
