Билет 1 Альбумины, глобулины, фибриноген
 Скачать 2.76 Mb. Скачать 2.76 Mb.
|
|
БИЛЕТ 1 1 .Альбумины, глобулины, фибриноген. Белки плазмы крови: альбумины (35-50 г/л – 60% белков плазмы): маленькие (70000 Да), долго не живут (7 дней), очень гидрофильны; онкотическое давление (коллоидно-осмотическое) - не дают воде выйти из сосудистого русла - объём крови постоянен (белки – это коллоиды, и они связывают и удерживают воду: при Сплазмы(альбумины) < 30 г\л - отёки); неспецифический транспорт веществ и лекарств (Ca2+, Zn, Cu, ЖК, vit. D3, эстрогены, билирубин; аспирин, сульфаниламиды); белковый буфер; энергетическая (при длительном голодании его АМК идут на ГНГ); глобулины (25-35 г/л; больше альбуминов по массе и слабо гидрофильны): α1-глобулины: антитрипсин (ингибитор трипсина, химотрипсина, плазмина; гликопротеин (глобулиновый транспорт стероидов, повышается - воспаления, понижается - цирроз печени); α2-глобулины: макроглобулин (ингибитор трипсина, химотрипсина, плазмина; повыш при циррозе, диабете, почечной недостаточности); гаптоглобин (связывает и уносит свободный HbA; повыш воспаления, диабет, пониж гепатит,гемолитическая анемия);церрулоплазмин (ферроксидаза I) (Cu-содержащий, переводит Fe2+ в Fe3+; ангиотензиноген β-глобулины: трансферрин (транспорт Fe3+; по крови); С-реактивный белок; γ-глобулины: IgG,A,M,E,D; криоглобулин (при Т < 37С выпадает в осадок; повыш лейкоз,ревматизм); фибриноген (2-4 г/л). биороль белков плазмы: онкотическое давление; свёртывание крови (в т.ч. фибриноген); создают вязкость крови (повыш в 4-5 раз вязкости воды); контроль рНкрови (белковая буферная система); транспорт веществ и лекарств; иммунитет (в т.ч. иммуноглобулины); связывание катионов, постоянство их концентрации в плазме (в т.ч. альбумины; Ca2+; Fe, Mg, Cu); резерв АМК. альбумин-глобулиновый (АГ) коэффициент – применяется при различных заболеваниях (не только печени): альбумины/глобулины= 1,5−2 в норме При поражениях всегда снижается: за счёт альбуминов – гепатит, цирроз, тяжёлые инфекции, алкоголизм, дефицит белка в пище (квашиоркор), потери при болезнях почек; за счёт глобулинов – при аутоиммунных и некоторых онкологических (миеломная болезнь).
4.Витамин В2 (рибофлавин) Пищевые источники: парное молоко; творог;печень, мясо, яйца; миндаль и шпинат Потребность: 1-3 мг/сут; + синтезируется кишечной микрофлорой. Биороль: коферментные формы – ФМН и ФАД; ДГ: комплексы ДЦ I и II; ПВДГК; сукцинатДГ, ацил-КоА-ДГ (β-окисление ЖК); глицерол-3-Ф-ДГ оксидазы: ксантиноксидаза, МАО (обезвреживание биогенных аминов), L- и D-оксидазы АМК; цитохром P450 (микросомное окисление); Редуктазы: (глутатионредуктаза) Гипервитаминоза нет: избыток препарата быстро выводится с мочой. Гиповитаминоз: дерматит носогубного треугольника, шелушение кожи; воспаление слизистых; красный сухой язык; трещина уголка рта, конъюнктивит; катаракта ФМН (ФлавинМоноНуклеотид) : изоаллоксазин-рибитол-РО4 ФАД (ФлавинАденинДинуклеотид): изоаллоксазин-рибитол-РО4 | Аденин-рибоза-РО4 Вопрос 5 Содержание воды в организме взрослого человека. вода (H2O) потребность: взрослые – 30-4 г кг массы\сутки, дети – в 3-4 раза больше поступление (2,5 л/сут.): питьевая вода (1,2 л/сут.);с пищей (1 л/сут.); эндогенная (0,3 л/сут.) выведение:с мочой (1,5 л/сут.); через лёгкие (0,6 л/сут.); через кожу (0,3 л/сут.); через кишечник (0,1 л/сут.) Биороль воды: универсальный растворитель; диссоциация веществ; формирование и стабилизация нативной структуры биополимеров (третичная структура белка); реакции гидролиза, гидратации; тургор клеток и межклеточного вещества (механическая функция); транспорт веществ; регулятор теплового баланса. вазопрессин V1: 7-TMS-R - Gq - ФЛ С - Ca2+ - вазоконстрикция - повышение АД. Как АДГ V2: 7-TMS-R - Gs - повыш АЦ - ПК А - встраивание аквапорина II в апикальную мембрану - повыш реабсорбция воды - снижение диурез НУП синтез альдостерона, продукция ренина и снижение АПФ (ангиотензинпревращающего фермента) повышэкскреция Na+ - пониж объем циркулирующей крови (ОЦК)) повыш диурез; + функции ПК G. Нефрогенный несахарный диабет (снижение АДГвазопрессина) этиология: наследственный дефект почечных RАДГ; мутации гена, кодирующего синтез аквапорина II Патогенез: пониж реабсорбция воды в почечных канальцах - гиповолемия (уменьшение ОЦК) Клиника: пониж удельного веса можи, жажда, полиурия Билет 2 1. Структура гемоглобина, молекулярные формы гемоглобина. Гемоглобин – гемопротеин, способный обратимо связываться с кислородом, обеспечивая его перенос в ткани. Он состоит из 2 частей: небелковая часть – гем ; белковая часть – глобин (по строению – цепочка из 8 уложенных альфа -спиралей (третичная структура); синтезируется на рибосомах). Гемоглобин – белок с четвертичной структурой, его протомер – белковая цепочка + связанный с нею гем. Типы полипептидных цепей: α, β, γ, δ, ε; в состав молекулы гемоглобина входят по 2 цепи 2 разных типов. Гем соединяется с белковой субъединицей: через остаток ГИС координационной связью Fe2+; через гидрофобные связи порфирина и гидрофобных АМК. Разновидности гемоглобинов HbА (adult – взрослый) α2β2 97% у здорового человека. HbА2 α2δ2 патология – бета-талассемия (если 3+% от Hbобщего): нарушение синтеза бета-цепи HbF (fetus – плод) α2γ2 повыш сродство к О2; легко повреждается и разрушается (даже от перепада рН, Т); в течение 1 года жизни почти полностью замещается HbA. HbS (sickle - серп) α2β2 мутация в бета-цепи, плохо переносит О2; склонен к кристаллизации, эритроцит деформируется (становится серповидным) - не может пройти через капилляр - застревает, разрушается - тромб - гипоксия тканей; легко повреждается - долго не живёт - быстрее разрушается в селезёнке - мерозоиты малярийного плазмодия не успевают созреть. патология – серповидно-клеточная анемия Производные гемоглобина: Норма: оксигемоглобин - при связывании О2 в лёгких деоксигемоглобин восстановленная форма Hb, способен присоединить О2 или СО2 карбгемоглобин при связывании СО2 в тканях Патология: карбоксигемоглобин - у Hb повыш сродство к СО, чем О2, + СО выключает IV комплекс ДЦ - гипоксия метгемоглобин MetHb-образователи (анилин, нитробензол, нитрит натрия, бензокаин, нафталин) окисляют Fe2+ доFe3+ - Hb не может присоединить О2 -гемическая гипоксия цианметгемоглобин - при отравлении цианидами в качестве антидота вводятся метгемоглобинобразователи -образуется стабильный комплекс гликированный гемоглобин - при диабете идёт неферментативное гликозилирование всех белков, в т.ч. Hb 2. Свертывание крови (гемокоагуляция). Свёртывающая система – каскадный ферментативный завершающийся превращением растворимого фибриногена в нерастворимый фибрин процесс, в ходе которого на тромбопластинах (ФЛ-матрицах) взаимодействуют и последовательно активируются сериновые протеиназы. Время свёртывания крови (по Ли-Уайту) – 5-7 мин. 3 фазы гемокоагуляции + посткоагуляционная фаза Фаза I. Образование протромбиназы (активного тромбопластина крови) 4 мин 50 сек – 6 мин 50 сек Фаза II. Образование тромбина 2-5 сек Фаза III. Образование фибрина 2-5 сек Фаза IV (посткоагуляционная). Ретракция – образование гемостатически полноценного тромба 55-85 мин В зависимости от механизма первой фазы различают внешнюю и внутреннюю системы свёртывания крови.
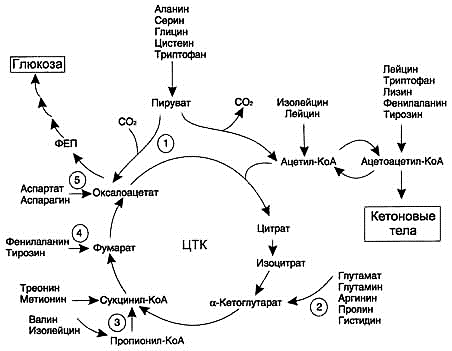
Вопрос 3 Пути использования АТФ в состоянии покоя. Реальный и желательный вклад в энергопродукцию белков, жиров и углеводов. общее содержание АДФ и АДФ в организме – 10 г.; суточный оборот АТФ примерно = весу тела; АТФ расходуется на: ферментативные реакции (36%); работу Na+/K+-АТФазы (22%); биосинтез белка (21%); мышечные сокращения (11%); работу Сa2+-АТФазы (22%). Реальные пропорции энергии : У-42%,Ж-40%,Б-15%, желательные: У-55%,Ж-30%,Б-15%. Для снижения доли жира следует снизить кол-во потребляемых насыщенных липидов с 17 % до 10%, увеличить долю углеводов за счет увеличения крахмала. Вопрос 4 Витамин В1. Участие в построении коферментов. Роль в обмене в-в. Проявления недостаточности. Суточная потребность. Пищевые источники Витамин В1 (тиамин, антиневритный) Пищевые источники: кожура семян хлебных злаков и риса; горох; фасоль; соя; мясо, печень; рыба. Потребность: 1,1-1,5 мг/сут; зависит от энергозатрат; повыш при избытке углеводов в пище; С2Н5ОН ингибирует всасывание Биороль: коферментная форма – тиаминпирофосфат (ТПФ; синоним – кокарбоксилаза, используется в комплексной терапии ИБС, невритов и др.; кофермент дегидрогеназных комплексов (ПВДГК); кофермент транскетолаз Гипервитаминоза нет: избыток препарата быстро выводится с мочой. Гиповитаминоз: болезнь Бери-Бери - полиневрит: сухая форма: полиневрит (онемение, боль по ходу нервов (невралгии), утрата периферических рефлексов (арефлексия), параличи); пониж кислотность желудочного сока ,диспепсии; отёчная форма: полиневрит (онемение, невралгии, арефлексия, параличи), пониж кислотность желудочного сока - диспепсии; сердечная недостаточность (отёки, одышка, тахикардия). у алкоголиков – синдром Гайя-Вернике-Корсакова: нистагм, атаксия, тремор, сниж интеллекта, психозы, потеря памяти. Патогенез: этанол угнетает всасывание vit. B1 + его альдегид оказывает прямое нейротоксическое действие - дефицит тиамина - дефицит ТПФ - сниж активность ТПФ-зависимых ферментов: Сниж активность ПВДГК - нарушение утилизации глю в цикле Кребса нейронами - дефицит энергии; на фоне дефицита энергии сниж активности альфа-КГДКГ - повыш накопление альфа-КГ - трансаминирование - ГЛУ -сверхнакопление ГЛУ - его нейротоксическое действие Вопрос5 Норма потребления воды для взрослого человека. вода (H2O) потребность: взрослые – 30-4 г кг массы\сутки, дети – в 3-4 раза больше поступление (2,5 л/сут.): питьевая вода (1,2 л/сут.);с пищей (1 л/сут.); эндогенная (0,3 л/сут.) выведение:с мочой (1,5 л/сут.); через лёгкие (0,6 л/сут.); через кожу (0,3 л/сут.); через кишечник (0,1 л/сут.) Биороль воды: универсальный растворитель; диссоциация веществ; формирование и стабилизация нативной структуры биополимеров (третичная структура белка); реакции гидролиза, гидратации; тургор клеток и межклеточного вещества (механическая функция); транспорт веществ; регулятор теплового баланса. Вода, образуемая в процессе катаболизма и при окислительном фосфорилировании – метаболическая вода, в среднем 400 мл. Участие в биохимических реакциях: Вода - хороший растворитель полярных молекул. Минерал. Соли, моносазариды, АМК и др полярные соединения хорошо растворяются в воде, что обеспечивает их транспорт по крови и участие во внутрикл процессах. Вода- плохой растворитель для неполярных и дифильных молекул, что щироко использовалось в ходе эволюции при формировании кл структур и границ компартмнтов внутри кл. Она участник хим реакций, играющих важную роль в проц жизнедеят-ти Реакции гидролиза БИЛЕТ 3 ВОПРОС 1 Перечислите известные вам метаболические процессы, сопровождающиеся реакциями декарбоксилирования веществ. Реакции: 1. Окислительное декарбоксилирование ПВК, с образованием ацетил-КоА (пируватдегидрогеназный комплекс). 2. Окислительное декарбоксилирование альфа-кетоглутаровой кислоты(ЦТК). 3. Декарбоксилирование 6-фосфоглюконата(пентозофосфатный путь). 4. Декарбоксилирование ДОФА( реакции синтеза катехоламинов). Декарбоксилирование – это превращение АМК с образованием аминов, в т.ч. биогенных, и выделением СО2. ферменты – декарбоксилазы; кофермент – пиридоксальфосфат Химически связанный С02 находится в крови в одной из трех форм: 1) угольная кислота (Н2С03): 2) бикарбонатный ион 3) карбогемоглобин (ННЬС02). В форме угольной кислоты переносится только 7% СОГ, бикарбонатных ионов - 70%, карбогемоглобин - 23%. При накоплении НСО3-в эритроцитах создается его градиент с плазмой. Возможность выхода НСО3-в плазму определяется условий: выход НСО3-должен сопровождаться одновременным выходом катиона или поступлением другого аниона. Мембрана эритроцита хорошо пропускает отрицательные, но плохо - положительные ионы. Кроме того, СО2 может связываться с белками: частично - с белками плазмы, но главным образом - с гемоглобином эритроцитов. При этом со2 взаимодействует с белковой частью гемоглобина - глобина. Гем же остается свободным и сохраняет способность гемоглобина находиться одновременно в связи как с С02, так и 02. Таким образом, одна молекула НЬ может транспортировать оба газа. 3 пути взамоимодействия со2 с гемоглобином: Увеличение рСО2 увеличивает сродство гемоглобина к кислороду. При деоксигенации гемоглобина его сродство к СО2 увеличивается. Еще один путь обусловлен изменением кислотных свойств гемоглобина в зависимости от его соединений с кислородом. HbO2 обладает более сильными кислотными свойствами. Поэтому он забирает катионы от бикарбонатов. В результате образуется угольная кислота. При повышении ее концентрации активируется фермент карбоангидраза, которая разрушает угольную кислоту до CO2 и H2O. Углекислый газ диффундирует в альвеолярный воздух. Превращения, описанные выше и происходящие в легочных капиллярах, можно записать в виде последовательных символических реакций: HHB+O2=HHbO2 HHbO2+KHCO3=KHBO2+H2CO3 H2CO3+карбоангидраза=H2O+CO2 ВОПРОС 4 Биотин. Витамин Н (биотин (bios - жизнь), антисеборейный) Пищевые источники: печень; яичный желток; молоко; бобовые; цветная капуста; грибы. Потребность: 150-200 мкг/сут; + синтезируется микрофлорой кишечника. Биороль:коферментная форма – карбоксибиотин переносит СО2 в реакциях карбоксилирования: пируваткарбоксилаза (ПВК - ЩУК, ГНГ); ацетил-КоА-карбоксилаза (ацетил-КоА - малонил-КоА, синтез ЖК); пропионил-КоА-карбоксилаза (пропионил-КоА - метилмалонил-КоА, β-окисление ЖК с Снечёт.). Гипервитаминоза нет. Гиповитаминоз: причины: приём антибиотиков - пониж рост микрофлоры; много яичного белка в пише - в нём содержится авидин – антивитамин Н; беременность; симптомы: жирная себорея (вид дерматита); очаговое облысение – алопеция; боли в мышцах (миалгия). Антивитамины – вещества, снижающие или полностью подавляющие биоактивность vit авидин + биотин (vit. H) = [авидин-биотин] неактивный комплекс, не всасывается в энтероцит. 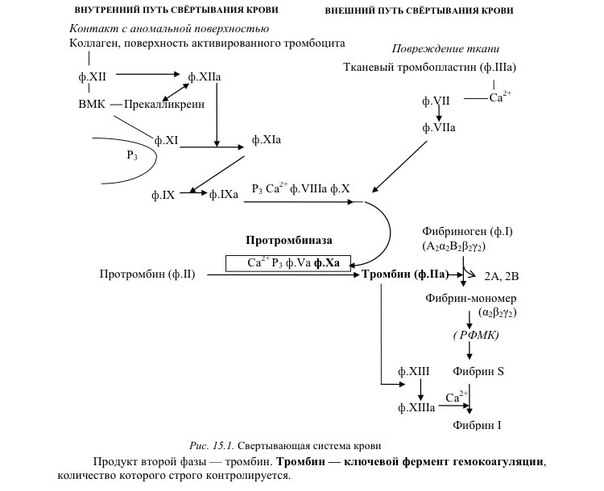 ВОПРОС 2 ВОПРОС 2Напишите схему гемокоагуляции при повреждеии кровеносного сосуда осрым предметом. Охарактеризуйте тканевой тромбопластин Тканевой тромбопластин: вместе с ФФ. IV, VII активирует Ф. X, т.е. участвует во внешнем пути; в тканях присутствует в виде предшественника – протромбопластина. 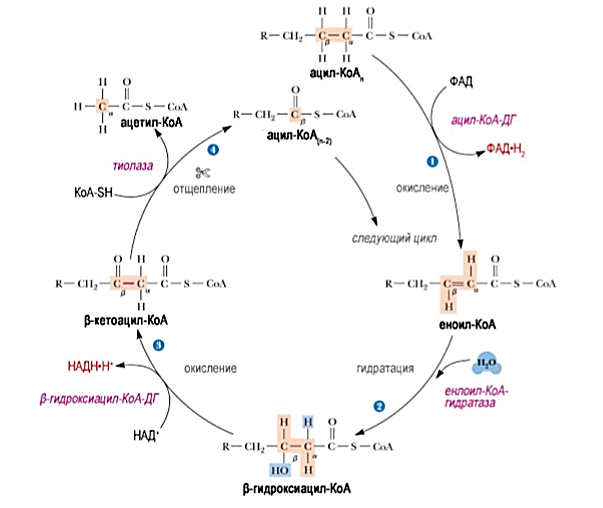 ВОПРОС 3 ВОПРОС 3Укажите конкретные метабол пути(по возможности приведите схемы реакций) использования липидов в качестве источника энергии. При гидролизе ТАГ образуются 3 молекулы ЖК и глицерол. бета-окисление – это основной путь использования ЖК в качестве источника энергии. Если в ЖК Сдо 10, она свободно попадает в матрикс митохондрии и там активируется в ацил-КоА Если С10+, активация происходит в цитозоле, и такой ацил-КоА диффузно попадает через наружную мембрану в ММП, а сам через внутреннюю в матрикс попасть не может. ацил-КоА + карнитин + КАТ1 = ацил-карнитин + КоА-SH КоА-SH + ацил-карнитин+КАТ2 = карнитин + ацил-КоА То есть, за 1 виток мы получаем: 1 восстановленный ФАДН2 (уходит в дыхательную цепь 1,5 АТФ); 1 восстановленный НАДНН+ (уходит в дыхательную цепь 2,5 АТФ); 1 ацетил-КоА (уходит в цикл Кребса 10 АТФ). Вывод: за один виток ЖК укорачивается на 2 атома С. Расчёт энергетического баланса β-окисления: Если количество С чётное Миристиновая кислота 6 витков, 7 ацетил-КоА (70 АТФ) , 6 ФАДН2 (9 АТФ), 6 НАДНН+ (15 АТФ) = 94-2=92 ВОПРОС 5 Содержание натрия в организме, его относительное распределение. Суточная потребность: до 5-8 г NaCl (чайная ложка). Содержание в организме: 80-100 г: 50% - внеклеточно: Сплазмы(Na+) = 135-150 ммоль/л!; 40% в костях и хрящах; 10% внутриклеточно. Биороль главный катион внеклеточного пространства: регулирует объём внеклеточной жидкости; регулирует Росмотическое; регулирует КОС (кислотно-основное состояние); участвует в создании электрического мембранного потенциала (φ); транспорт через мембрану: симпортом – АМК, глю, гал; антипортом – Nа+/ К+, Na+/Ca2+; ингибирует ферменты, !искл.: активирует пищеварительные. Избыток (гипернатриемия): причины: сильное потоотделение; недостаточное питьё при избытке солёной пищи; несахарный диабет; синдром Кона (гиперальдостеронизм) синдром/болезнь Кушинга; Недостаток (гипонатриемия): причины: возмещение только Н2О после потери жидкости (кровотечение, рвота, понос); применение мочегонных; голодание, бессолевая диета; болезни почек с нарушением реабсорбции; бронзовая болезнь Аддисона синдром Конна: Причины: гиперплазия клубочковой зоны коры надпочечников; альдостерома , опухоль клубочковой зоны коры надпочечников; Симптомы: гипер-Nа+-емия; гипо-K+-емия; гипергидратация; артериальная гипертензия; тахикардия; алкалоз; судороги; головные боли. синдром Кушинга: повыш глюкокортикоиды Причины: опухоль пучковой зоны коры коры; терапия ГК Патогенез: избыток ГК - нарушение метаболизма (белков, жиров, углеводов, водно-солевого обмена) БИЛЕТ 4 1.Белки плазмы крови В плазме крови содержится 7% всех белков организма при концентрации 60 - 80 г/л. Основная функция заключается в поддержании осмотического давления, так как белки связывают воду и удерживают её в кровеносном русле, образуют буферную систему крови и поддерживают рН крови в пределах 7,37 - 7,43, определяют вязкость крови и, следовательно, играют важную роль в гемодинамике кровеносной системы. Белки плазмы крови являются резервом аминокислот для организма. Иммуноглобулины, белки свёртывающей системы крови, α1-антитрипсин и белки системы комплемента осуществляют защитную функцию. α2-Макроглобулин(2,6 г/л) синтезируется в печени. Ингибитор плазменных протеиназ, транспорт цинка. При недостатке- нарушения в системах свертывания, фибринолиза и др. С-реактивный белок (<0,01 г/л)- Активация комплемента. Способен вступать в реакцию преципитации с С-полисахаридом пневмококков. В норме не определяется в крови, выявляется при многих патологических состояниях ,сопровождающихся воспалением и некрозом тканей. Появляется в острый период болезни (белок острой фазы). Гаптоглобин ( 1 г/л)- Связывание гемоглобина. Специфически связывает внеклеточный Нb, образуя прочный нековалентный комплекс. Формирующийся комплекс гаптоглобина с Нb не способен пройти через капилляры клубочка почек=> Нb свободно не попадает в почки. Церулоплазмин (0,35 г/л)-транспорт ионов меди, оксидазная активность проявляется при взаимодействии с Вит.С. Катализирует окисление различных полифенолов, ароматических полиаминов. Трансферрин (3 г/л) –траспорт ионов железа. Состоит из 2 одинаковых доменов, связывающих по одному атому железа. В молекуле трансферрина железо трехвалентное, с двухвалентным железом связывается легче, затем окисляется до трехвалентного. Так же могут связываться медь, цинк, хром(3), кобальт, марганец. Криоглобулин – в норме в сыворотке крови здоровых людей его нет, появляется при патологии. Способен выпадать в осадок или желатинизироваться при температуре ниже 37- отличительное свойство. α1 –Антитрипсин(2,5 г/л)-термолабилен, необратимо инактивируется при рН ниже 5,0. Тормозит в крови активность широкого спектра протеаз. Интерфероны способны угнетать размножение вирусов в клетках, но не разрушают уже имеющиеся вирусные частицы. Они индуцируют синтез ферментов, которые катализируют синтез олигонуклеотида, активирующего РНКазу. 2. Фактор Хагемана. Данный фактор в неактивном состоянии в норме находится в плазме крови. Его активация происходит при контакте с отрицательно заряженными поверхностями, например с коллагеном, обнажающимся при ранении, или in vitro со стеклом. В активации и действии фактора XII(Хагемана) участвуют также высокомолекулярный кининоген и протеолитические ферменты, например калликреин, тромбин или трипсин. Также активируется иммунными комплесами, адреналином, жирными кислотами, уратами, холестеролом, ТАГ, эндотоксинами. Фактор Хагемана участвует во «внутреннем» пути формирования протромбиназы, активируя фактор XI. Внутренний путь свертывания крови начинается с активации ХII фактора. ХIа фактор превращает IХ фактор в IХа в присутствии ионов Са2+. Активация Х фактора катализируется Са2+-зависимым мембранным комплексом, состоящим из факторов IХа, Vа и VIIIа (внутренний путь) и/или факторов VIIа и ТФ (внешний путь).Vа и VIIIа факторы являются коферментами активации ХI фактора. После образования протромбинактиваторного комплекса начинается второй этап гемокоагуляции – переход протромбина (II фактора) в свою активную форму – тромбин. Интересно отметить, что протромбин, помимо коагулянтной функции, участвует в дифференцировке нервных клеток. Переход протромбина в тромбин происходит в 2 этапа: образование мезотромбина и образование фрагментов F1+2 протромбина. Последний используется для диагностики гиперкоагуляционных состояний. Тромбин является конечным продуктом второй стадии гемокоагуляции, кроме того, вызывает активацию кофакторов и тромбоцитов. Тромбин принимает активное участие в репаративных процессах поврежденных тканей. Протромбина́за — Комплекс факторов IXa, VIIIa на фосфолипидной поверхности тромбоцитов в присутствии ионов кальция. Катализирует превращение II фактора из неактивной формы (протромбин) в активную (тромбин). 3. Углеводы Норма потребления углеводов составляет 400(300) – 500 г в сутки в зависимости от степени физической активности. К кетоновым телам относят β-гидроксибутират, ацетоацетат и ацетон. Первые две молекулы могут окисляться в тканях, обеспечивая синтез АТФ. Ацетон образуется только при высоких концентрациях кетоновых тел в крови и, выделяясь с мочой, выдыхаемым воздухом и потом, позволяет организму избавляться от избытка кетоновых тел. Синтез кетоновых тел в печени. При низком соотношении инсулин/глюкагон в крови в жировой ткани активируется распад жиров. Жирные кислоты поступают в печень в большем количестве, чем в норме, поэтому увеличивается скорость β-окисления. Скорость реакций ЦТК в этих условиях снижена, так как оксалоацетат используется для глюконеогенеза. В результате скорость образования ацетил-КоА превышает способность ЦТК окислять его. Ацетил-КоА накапливается в митохондриях печени и используется для синтеза кетоновых тел. Синтез кетоновых тел происходит только в митохондриях печени. Схема образования кетонных тел: Ацетил-КоА--тиолаза--Ацетоацетил- КоА--ГМГ-КоА-синтаза--ГМГ-КоА--ГМГ-КоА-лиаза--Ацетоацетон--НАДН+Н+- НАД+--бета-Гидроксибутират--бета-Гидроксибутират-ДГ--Ацетоацетат--Трансфераза--Ацетоацетил-КоА--тиолаза-- 2 Ацетил- КоА (идет в ЦТК). При длительном голодании кетоновые тела становятся основным источником энергии для скелетных мышц, сердца и почек. Таким образом глюкоза сохраняется для окисления в мозге и эритроцитах. Уже через 2-3 дня после начала голодания концентрация кетоновых тел в крови достаточна для того, чтобы они проходили в клетки мозга и окислялись, снижая его потребности в глюкозе. 4. Аскорбиновая кислота - лактон кислоты, близкой по структуре к глюкозе. Существует в двух формах: восстановленной (АК) и окисленной (дегидроаскорбиновой кислотой, ДАК). Биологически активна только в L- аскорбиновая кислота. Суточная потребность человека в витамине С составляет 50-75 мг. Биологические функции. способность легкоокисляться и восстанавливаться. Вместе с ДАК она образует в клетках окислительно-восстановительную пару с редокс-потенциалом +0,139 В. Благодаря этой способности аскорбиновая кислота участвует во многих реакциях гидроксилирования: остатков Про и Лиз при синтезе коллагена (основного белка соединительной ткани), при гидроксилировании дофамина, синтезе стероидных гормонов в коре надпочечников. В кишечнике аскорбиновая кислота восстанавливает Fe3+в Fe2+, способствуя его всасыванию, ускоряет освобождение железа из ферритина, способствует превращению фолата в коферментные формы. Природный антиоксидант. Обезвреживание токсинов и ксенобиотиков. Авитаминоз- цинга (скорбут). Главные проявления авитаминоза обусловлены в основном нарушением образования коллагена в соединительной ткани. Вследствие этого наблюдают разрыхление дёсен, расшатывание зубов, нарушение целостности капилляров (сопровождающееся подкожными кровоизлияниями). Возникают отёки, боль в суставах, анемия. Анемия при цинге может быть связана с нарушением способности использовать запасы железа, а также с нарушениями метаболизма фолиевой кислоты. Гиповитаминоз - ощущение усталости, снижение аппетита, подверженность к простудным заболеваниям, кровоизлияния на коже, кровоточивость десен, развитие железодефицитной анемии, ослабление иммуннозащитных сил. Пищевые источники- плоды шиповника, облепиха, черная смородина, цитрусовые, красный перец. 5. В организме содержится 10-15 мг марганца. Всасываясь из кишечника, марганец связывается в крови с бета-глобулинами, быстро захватывается тканями и в них митохондриями. Поэтому ткани, богатые митохондриями, имеют повышенные концентрации марганца. Участие в метаболизме: Активирование ферментов глюконеогенеза- пируваткарбоксилазы и фосфоенолпируваткарбоксикиназы. Активирование аргиназы(фермент синтеза мочевины). Активирование изоцинтатдегидрогеназы цикла кребса. Играет важную роль в обмене хрящевой и костной ткани, участвую в синтезе протеогликанов. Марганец, как 2валентный катион , может заменять магний2+ во многих реакциях, в частности в ДНК-полимеразной при синтезе молекулы ДНК. Но такая замена неравноценна: синтез ДНК при этом осуществляется быстро, но с многочисленными ошибками. НАРУШЕНИЕ ОБМЕНА :Недостаточность марганца у человека не описана.отравление марганцем возможно при вдыхании его паров. Развивается симптоматика нарушения корковых( расстройство психической деятельности) и подкорковых центров. БИЛЕТ 5 1. Ренин-ангиотензиновая система- ведущий фактор в регуляции секреции альдостерона — это гормональная система человека , которая регулирует кровяное давление и объём крови в организме. Компоненты системы: -Ангиотензиноген образуется из белка-предшественника ангиотензиногена, сывороточного глобулина, который продуцируется в основном печенью. -Ангиотензин I образуется из ангиотензиногена под действием ренина -Ангиотензин II преобразуется из ангиотензин I под действием ангиотензинпревращающего фермента (АПФ) -Проренин неактивная форма ренина -Ренин вырабатывается юкстагломерулярными клетками в стенках артериол почечных клубочков -Ангиотензинпревращающий фермент находится на мембранах пневмоцитов II типа, энтероцитов тонкого кишечника, эндотелиальных клеток артерий и вен, а также гладкомышечных клеток в большинстве органов -Альдостерон минералокортикостероидный гормон коры надпочечников (Ренин-ангиотензин альдестероновый каскад начинается с биосинтеза препрорениновой из рениновой мРНК в юкстагломерулярных клетках и превращается в проренин путём отщепления 23 аминокислот. В эндоплазматическом ретикулуме проренин подвергается гликозилированию и приобретает 3-D структуру. Большая часть проренина свободно выбрасывается в системный кровоток путём экзоцитоза, но некоторая доля превращается в ренин путём действия эндопептидаз в секреторных гранулах юкстагломерулярных клеток. Ренин, образуемый в секреторных гранулах в дальнейшем выделяется в кровоток, но этот процесс жёстко контролируется давлением , через внутриклеточные концентрации ионов кальция. Поэтому у здоровых людей объём циркулирующего проренина в десять раз выше концентрации активного ренина в плазме . Функционирование:При дефиците натрия в организме и уменьшении кровоснабжения почек в кровь выделяется образующийся в юкстагломерулярном аппарате ренин. Являясь протеиназой ренин действует на альфа-2 глобулин крови (гипертензиноген), отщепляя декапептид - ангиотензин I. Под влиянием пептидазы от молекулы физиологически неактивного ангиотензина I отщепляются две аминокислоты (гистидин и лейцин) и формируется октапептид - ангиотензин II. Большая часть этих превращений происходит во время прохода крови через легкие. Функции Ангиотензина II (Анг II), один из важнейших компонентов РАС, образуется из белкового предшественника ангиотензиногена в результате последовательного действия нескольких протеолитических ферментов. Классический путь образования Анг II включает реакцию, катализируемую ангиотензин-превращающим ферментом (АПФ) .Анг II стимулирует разнообразные физиологические ответы, обеспечивая регуляцию артериального давления крови, электролитного и водного баланса; он является наиболее известным и сильнодействующим гипертензивным веществом .Ангиотензин-II, кроме стимуляции продукции альдостерона, обладает следующими эффектами: • вызывает сужение артериальных сосудов, • активирует симпатическую нервную систему как на уровне центров, так и способствуя синтезу и освобождению норадреналина в синапсах, • повышает сократимость миокарда, • увеличивает реабсорбцию натрия и ослабляет клубочковую фильтрацию в почках, • способствует формированию чувства жажды и питьевого поведения. Искусственная регуляция системы: 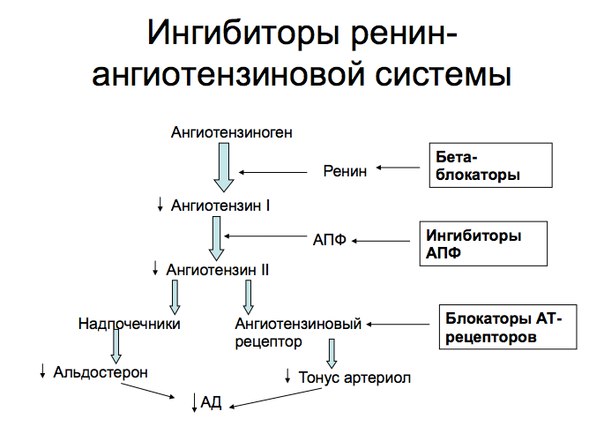 2.Кровь вне кровеносного русла сворачивается, этим обусловлено использование антикоагулянтов для сохранения жидкого состояния крови. В качестве антикоагулянтов в лабораторной практике наиболее часто используют: гепарин, тринатрий-цитрат и ЭДТА (этилендиаминтетраацетат, или три-лон Б). Механизм действия :гепарин в качестве кофактора участвует в формировании в плазме комплекса тромбин-антитромбин III, в результате чего тромбин, оказываясь связанным, становится неспособным переводить фибриноген в фибрин, вследствие чего кровь не сворачивается. ЭДТА и три-натрий-цитрат, связывая кальций крови, блокируют коагуляцию. Гепарин — наилучший антикоагулянт для определения осмотической резистентности эритроцитов и функциональных исследований лейкоцитов, в том числе и для иммуноцитохимического анализа. Его применение не предотвращает агрегацию тромбоцитов, что обусловливает артефакты автоматического анализа. Цитрат натрия (тринатрий-цитрат) является антикоагулянтом выбора, то есть он используется при исследовании свертывающей системы крови и тромбоцитов. Роль ионов кальция в свертывании крови: -способствует активации тромбоцитов -стабилизирует структуру тромбопластинов -участвует в ретракции тромба -способствует связыванию II,VII,IX,X факторов на поверхности тромбоцитов. 3.Маразм- Истощение организма - патологическое состояние, которое возникает при недостаточном поступлении питательных веществ. Выделяют 2 формы истощения. Первичное связано непосредственно с питанием и возникает из-за голодания. Вторичное истощение организма является следствием заболеваний различных органов (при панкреатите), нарушений обмена веществ. На начальных стадиях первичного истощения можно восстановить организм до первоначального состояния. Однако, если разрушающие процессы зашли далеко, то даже правильное питание и прием витаминно-минеральных комплексов не помогут вернуться к прежней работоспособности и восстановлению прежних сил. Причины истощения различны :длительное голодание или недостаточное употребление питательных веществ; заболевания желудочно-кишечного тракта (наблюдается при хроническом панкреатите); нервно-психическое истощение; сбои в гормональном фоне;заболевания эндокринных органов; Признаки истощения различны, однако, главным является стремительная потеря как мышечной, так и жировой массы. Появляются нервно-психические расстройства. Обостряются хронические заболевания Признаки и симптомы маразма следующие: 1) сморщенные и высохшие черты лица, делающие его похожим на лицо старика, глаза впалые; 2) дистрофия мышц, из-за чего руки и ноги становятся тонкими; низкое содержание жира в организме. 3) волосы не поражены; 4) отеков нет; 5) очень низкий вес; по некоторым оценкам, ребенок может терять более 60% массы, характерной для его возраста; 6) пониженная сопротивляемость инфекциям; 7) болезни дефицита витаминов, 4. Витамин В12 (кобаламин, Цианокобаламин,Метилкобаламин,) единственный витамин, содержащий в своём составе металл кобальт. Источники. синтезируемый почти исключительно микроорганизмами: бактериями, актиномицетами и сине-зелёными водорослями. Из животных тканей наиболее богаты витамином В12 печень и почки. Недостаточность витамина в тканях животных связана с нарушением всасывания кобала-мина из-за нарушения синтеза внутреннего фактора Касла, в соединении с которым он и всасывается. Фактор Касла синтезируется обкладочными клетками желудка. Он соединяется с витамином В12 при участии ионов кальция. Гипоавитаминоз В12 обычно сочетается с понижением кислотности желудочного сока, что может быть результатом повреждения слизистой оболочки желудка, также после тотального удаления желудка при хирургических операциях. Суточная потребность в витамине В12 крайне мала и составляет всего 1-2 мкг. двух коферментов: метилкобаламина в цитоплазме и дезоксиаденозилкобаламина в митохондриях (рис. 3-2). Метил-В12 - кофермент, участвующий в образовании метионина из гомоцистеина, принимает участие в превращениях производных фолиевой кислоты, необходимых для синтеза нуклеоти-дов - предшественников ДНК и РНК. Дезоксиаденозилкобаламин в качестве кофермента участвует в метаболизме жирных кислот с нечётным числом углеродных атомов и аминокислот с разветвлённой углеводородной цепью . Основной признак гиповитаминоза В12 - макроцитарная (мегалобластная) анемия. Для этого заболевания характерны увеличение размеров эритроцитов, снижение количества эритроцитов в кровотоке, снижение концентрации гемоглобина в крови. Нарушение кроветворения связано в первую очередь с нарушением обмена нуклеиновых кислот, в частности синтеза ДНК в быстроделящихся клетках кроветворной системы. также расстройство деятельности нервной системы, объясняемое токсичностью метилмалоновой кислоты, накапливающейся в организме при распаде жирных кислот с нечётным числом углеродных атомов, а также некоторых аминокислот с разветвлённой цепью. 5.Магний относится к незаменимым составным частям тканей и жидкостей организма. Содержание общего магния в организме около 25г. Около 60% находится в костной ткани, внутриклеточно магний находится в мышечной и нервной тканях. Большое содержание в гепатоцитах и гепатоцитах. Участие в метаболизме. Так как магний легко образует комплексы с фосфатами, он участвует во всех фосфатзависимых реакциях, в том числе АТФ-, УТФ-, и ГТФ- зависимых. Основные биохимические процессы, протекающие внутри клетки, являются магний –зависимыми: гликолиз, окислительный метаболизм, трансмембранный транспорт натрия и калия. Магний является кофактором ДНК-полимераз, он играет роль связующего звена при взаимодействии субъединиц рибосом друг с другом, с тРНК и факторамитрансляции. Он участвует в синтезе трипептида глутатиона.магний оказывает влияние на секрецию гормона паратирина. Нарушение обмена магния. Повышение концентрации магния в крови наблюдается редко. Пероральный прием солей магния вызывает диарею. Дефицит магния. так как магния достаточно в продуктах питания, то гипомагниемия обычно связана с общим недостатком питания. Дефицит развивается также при нарушении процессов всасывания в кишечнике, рвоте, осмотическом диурезе, цитотоксической лекарственной терапии. Симптомы: нарушается нейромышечная функция( подергивание мышц, тремор, судороги). Появляется чувство страха, отмечаются тревога и раздражительность. Потребность. Пищевые источники. Минимальная суточная потребность в магнии около 0,2-0,3 г. У детей, беременных и кормящих женщин потребность в этом элементе повышена. Так как магний является составной частью хдлрофилла, зеленые овощи, наряду со злаками и животной пищей, являются важными пищевыми ресурсами магния. Билет 6 1.В настоящее время выделено 4 основные пути использования кислорода в организме: 1. Оксидазный путь - окислительное фосфорилирование. Является основным источником АТФ в аэробных тканях. Потребляет 90% кислорода. 2. Монооксигеназный путь.Обеспечивает включение 1 атома кислорода в молекулу субстрата. Используется для синтеза новых веществ (стероидные гормоны), обезвреживания ксенобиотиков и токсических продуктов обмена в митохондриях и ЭПР. 3. Диоксигеназный путь. Обеспечивает включение молекулы кислорода в молекулу субстрата. Используется для деградации АК и синтеза новых веществ. 4. Пероксидазный и радикальный пути. Кислород участвует в образовании перекисей и активных радикалов, которые необходимы в пероксисомах для внутриклеточного пищеварения, разрушения макрофагами бактерий, вирусов, регуляции метаболизма и т.д. Реакции: 1. Окислительное декарбоксилирование ПВК, с образованием ацетил-КоА (пируватдегидрогеназный комплекс). 2. Окислительное декарбоксилирование альфа-кетоглутаровой кислоты(ЦТК). 3. Декарбоксилирование 6-фосфоглюконата(пентозофосфатный путь). 4. Декарбоксилирование ДОФА( реакции синтеза катехоламинов). В плазме крови небольшое количество углекислого газа находится в растворенном состоянии; при РС02= 40 мм рт. ст. переносится 2,5 мл/100 мл крови углекислого газа, или 5 %. Количество растворенного в плазме углекислого газа в линейной зависимости возрастает от уровня РС02. 3 пути взамоимодействия со2 с гемоглобином: Увеличение рСО2 увеличивает сродство гемоглобина к кислороду. При деоксигенации гемоглобина его сродство к СО2 увеличивается. Еще один путь обусловлен изменением кислотных свойств гемоглобина в зависимости от его соединений с кислородом. HbO2 обладает более сильными кислотными свойствами. Поэтому он забирает катионы от бикарбонатов. В результате образуется угольная кислота. При повышении ее концентрации активируется фермент карбоангидраза, которая разрушает угольную кислоту до CO2 и H2O. Углекислый газ диффундирует в альвеолярный воздух. Гемоглобин способен захватывать кислород из альвеолярного воздуха (соединение называется ок-сигемоглобином) и освобождать необходимое количество кислорода в тканях. Особенностью химической реакции кислорода с гемоглобином является то, что количество связанного кислорода ограничено количеством молекул гемоглобина в эритроцитах крови. Молекула гемоглобина имеет 4 места связывания с кислородом. 2. Фактор Виллебранда – антигеморрагический сосудистый фактор. Синтезируется эндотелием сосудов и мегакариоцитами, содержится в плазме и в тромбоцитах. Адгезия обусловлена наличием в плазме и тромбоцитах особого белка — фактора Виллебранда (FW), имеющего три активных центра, два из которых связываются с экспрессированными рецепторами тромбоцитов, а один — с рецепторами субэндотелия и коллагеновых волокон. Таким образом, тромбоцит с помощью FW оказывается «подвешенным» к травмированной поверхности сосуда. Одновременно с адгезией наступает агрегация тромбоцитов, осуществляемая с помощью фибриногена — белка, содержащегося в плазме и тромбоцитах и образующего между ними связующие мостики, что и приводит к появлению тромбоцитарной пробки. Из тромбоцитов, подвергшихся адгезии и агрегации, усиленно секретируются гранулы и содержащиеся в них биологически актив ные соединения — АДФ, адреналин, норадреналин, фактор Р4, ТхА2 и др. (этот процесс получил название реакции высвобождения), что приводит к вторичной, необратимой агрегации. Одновременно с высвобождением тромбоцитарных факторов происходит образовани ем тромбина, резко усиливающего агрегацию и приводящего к по явлению сети фибрина, в которой застревают отдельные эритроциты и лейкоциты. Благодаря контрактильному белку тромбостенину тромбоциты подтягиваются друг к другу, тромбоцитарная пробка сокращается и уплотняется, т. е. наступает ее ретракция. В норме остановка кровотечения из мелких сосудов занимает 2—4 мин. 3.Лептин— пептидный гормон, регулирующий энергетический обмен. Относится к гормонам жировой ткани. Оказывает анорексигенное действие. Снижение концентрации лептина ведёт к развитию ожирения. Основная физиологическая роль лептина проявляется снижением синтеза макроэргов и повышением затрат энергии. Его механизм действия заключается в передаче в гипоталамус информации о массе тела и жировом обмене. Взаимодействие лептина со специфическими рецепторами, расположенными в гипоталамической области, активирует выработку нервных импульсов, направленных в участки головного мозга, ответственные за регуляцию аппетита. Действие лептина стимулирует симпатическую нервную систему, что в свою очередь ведёт к повышению артериального давления, частоты сердечных сокращений и процессов термогенеза, путём разобщения процессов окисления (клеточного дыхания) и фосфорилирования (синтез молекул АТФ) в митохондриях белой жировой ткани. В результате этих процессов большое количество энергии, которое запасается в жировой ткани в виде липидов, может быть преобразовано в тепло. Таким образом, функциями лептина является подавление аппетита, регуляция менструальной функции у женщин (при критическом снижении уровня лептина прекращаются овуляции и менструации). Лептин секретируется адипоцитами, клетками жировой ткани. Грелин — пептидный гормон, обладающий свойствами гонадолиберина и другими метаболическими и эндокринными функциям, синтезируемый клетками в кишечной-желудочном тракте.Прогормон грелина продуцируется в основном P/D1-клетками слизистой оболочки фундального отдела желудка. Уровень грелина перед приёмами пищи увеличивается, а после приёмов пищи уменьшается. Механизм действия: Грелин активизирует клетки в дугообразном ядре, которые возбуждают аппетит, секретируя нейропептид Y (NPY-нейроны). Грелин также активизирует мезолимбическую холинергически-допаминергическую систему, связанную с потреблением питательных веществ. Депонирование жира в адипоцитах в абсорбтивном периоде. После еды при повышении концентрации глюкозы в крови увеличивается секреция инсулина. Инсулин активирует транспорт глюкозы внутрь адипоцитов, действуя на ГЛЮТ-4, и синтез ЛП-липазы в адипоцитах и её экспонирование на поверхности стенки капилляров. ЛП-липаза, связанная с эндотелием сосудов, гидролизует жиры в составе ХМ и ЛПОНП. АпоС-II на поверхности ХМ и ЛПОНП активирует ЛП-липазу. Жирные кислоты проникают в адипоцит, а глицерол транспортируется в печень. Так как в адипоцитах нет фермента глицеролкиназы, то свободный глицерол не может использоваться для синтеза ТАГ в этой ткани. Активированные жирные кислоты взаимодействуют с глицерол-3-фосфатом, образующимся из дигидроксиацетонфосфата, и через фосфатидную кислоту превращаются в ТАГ, которые депонируются в адипоцитах. 4.Инозитол(витамин B8) . Химическое строение и свойства. По химическому строению- шестиатомный спирт, хорошо растворимый в воде. Витаминными свойствами обладает фитин- соль инозитфосфорной кислоты. Метаболизм и функции: 1. Инозин входит в состав инозитолфосфатидов, содержащихся во всех тканях, особенно богата ими нервная ткань. 2. фосфорилированные формы инозитола, прежде всего ИТФ, являются посредниками в реализации действия некоторых гормонов. Пара-аминобензойная кислота. Строение. плохо растворяется в воде, хорошо в спирте и эфире. Химически устойчива. Функции : входит в состав молекулы фолиевой кислоты, следовательно принимает участие во всех реакциях, где необходим витамин Bc. Большинство микроорганизмов не могут синтезировать ПАБК, в связи с чем ее структурные аналоги широко используются в качестве антибактериальных средств.обладает способностью активировать тирозиназу- ключевой фермент в биосинтезе меланинов кожи. Следовательно ПАБК необходима для нормальной пигментации волос и коже. Витамин U. По строению- s- метилметионин. Хорошо растворим в воде, при варке пищи легко разрушается, особенно в нейтральной и щелочной средах. Функции: подобно метионину является донором мельных групп в реакциях синтеза холина и креатина.вероятно его липотропное действие на печень. Холин. Витами B4. Строение. Холин- аминоэтиловый спирт, содержащий три метильные группы у атома азота. Метаболизм: 1. Предшественник нейромедиатора- ацетилхолина.2.фосфохолин, активируясь с помощью ЦДФ, используется для синтеза фосфотидилхолина.(лецитина) необходим еще для синтеза сфингомиелина.3. донор метильных групп в реакциях трансметилирования. 5.Селен . В РБ отмечена недостаточность в пищевом рационе селена. Пищевые источники: печень, почки, яйца, морская рыба, моллюски , ракообразные.Для всасывания в кишечнике селена необходим творог, в котором содержится метионин. Суточная потребность 100 мкг. |