|
|
шпоры фх. 1. Физическая химия цель, задачи, методы исследования. Основные понятия физической химии. Физ химия
37)Реакции 3-ого порядка
Химическая кинетика рассматривает скорости химических реакций и параметры от которых они зависят. Наиболее важными параметрами являются концентрация, температура, давление. Скорость реакций в общем виде определяется изменением количества вещества в единицу времени, в единице реакционного пространства: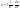 , где R- реакционное пространство, n-число молей данного компонента в момент времени t.Скорость реакций выражается как производная от концентраций по времени для любого вещества, участвующего в реакций. , где R- реакционное пространство, n-число молей данного компонента в момент времени t.Скорость реакций выражается как производная от концентраций по времени для любого вещества, участвующего в реакций.
Важной характеристикой в химической кинетике является константа скорости. Ее физический смысл состоит в том, что при условии равенства концентрации реагирующих веществ(Са=Св=1) для гомогенных реакции константа скорости равна скорости реакции W=k, а для гетерогенных реакции 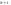 . .
Из всех кинетических характеристик химических реакции наиболее важной является константа скорости. Чем больше по величине константа скорости , тем больше скорость. Рассмотрим р-ции 3-его порядка с точки зрения кинетики. Есть 2 типа р-ции 3-его порядка
1)3А=С –при вз-ии получается один продукт
2)А+В+С=Е+Д+Ж-при вз-ии получается несколько продуктов.
1)СА+СВ+СС}=СА
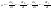
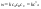
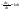 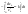 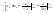 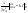 ; ;
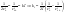 и и 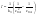 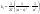 ; ; 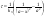 Для графического определения используем ур-ие: Для графического определения используем ур-ие: 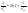 . .
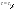 x=a/2 x=a/2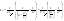 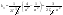 . Еще одной кинетической характеристикой реакции является период полупревращения t1/2 – время, за которое концентрация исходного вещества уменьшается вдвое по сравнению с исходной. Выразим t1/2 для реакции третьего порядка, учитывая, что . Еще одной кинетической характеристикой реакции является период полупревращения t1/2 – время, за которое концентрация исходного вещества уменьшается вдвое по сравнению с исходной. Выразим t1/2 для реакции третьего порядка, учитывая, что 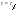 x=a/2 x=a/2 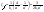 .Для реакции 3-его порядка период полураспада обратно пропорционален квадрату исх.с. Единица измерения К,т.е. dim .Для реакции 3-его порядка период полураспада обратно пропорционален квадрату исх.с. Единица измерения К,т.е. dim . Таким образом, химическая кинетика-раздел химии,изучающий скорость и механизмы химических реакции, как было рассмотрено выше. . Таким образом, химическая кинетика-раздел химии,изучающий скорость и механизмы химических реакции, как было рассмотрено выше.
38-40)определить константу скорости первого и n-ого порядка расчетным и графическим способом, укажите ее размерность.уравнение расчета периода полураспада реакций 1-ого порядка.
Химическая кинетика рассматривает скорости химических реакций и параметры от которых они зависят. Наиболее важными параметрами являются концентрация, температура, давление. Скорость реакций в общем виде определяется изменением количества вещества в единицу времени, в единице реакционного пространства: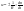 , где R- реакционное пространство, n-число молей данного компонента в момент времени t.Скорость реакций выражается как производная от концентраций по времени для любого вещества, участвующего в реакций. , где R- реакционное пространство, n-число молей данного компонента в момент времени t.Скорость реакций выражается как производная от концентраций по времени для любого вещества, участвующего в реакций.
Важной характеристикой в химической кинетике является константа скорости. Ее физический смысл состоит в том, что при условии равенства концентрации реагирующих веществ(Са=Св=1) для гомогенных реакции константа скорости равна скорости реакции W=k, а для гетерогенных реакции 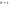 . .
Из всех кинетических характеристик химических реакции наиболее важной является константа скорости. Чем больше по величине константа скорости , тем больше скорость.
Рассмотрим зависимость от времени концентрации исходного вещества А для случая реакции первого порядка А ––> В. Реакции первого порядка характеризуются кинетическим уравнением вида
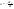 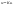 . .
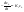 (1а) (1а)
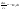  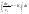  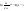 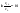 (1б) (1б)
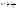 (1в) (1в)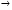 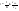 (1г) (1г)
Константу интегрирования определим из начальных условий: в момент времени t = 0 концентрация С0=a,или 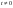 прореагировало х молей вещества.Тогда прореагировало х молей вещества.Тогда 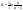 (1д). (1д).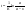 (1ж) (1ж)
Для графического определения используется уравнение (1б) в результате получаем: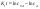 (1е) (1е)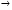 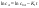 - уравнение прямой.В результате можно построить график зависимости логарифма концентрации от времени реакции первого порядка - уравнение прямой.В результате можно построить график зависимости логарифма концентрации от времени реакции первого порядка
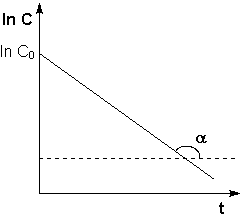
Можно проследить, что логарифм концентрации для реакции первого порядка линейно зависит от времени (рис. 2.3) и константа скорости численно равна тангенсу угла наклона прямой к оси времени: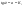 . .
Из уравнения 1б и 1д видно, что К зависит от концентрации исходных веществ. Уравнения 1в 1д 1е- кинетические уравнения первого порядка.Единица измерения К,т.е. dim[K]=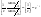
Еще одной кинетической характеристикой реакции является период полупревращения t1/2 – время, за которое концентрация исходного вещества уменьшается вдвое по сравнению с исходной. Выразим t1/2 для реакции первого порядка, учитывая, что С = ½Со: 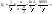
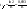 (1з). (1з).
Как видно из полученного выражения, период полупревращения реакции первого порядка не зависит от начальной концентрации исходного вещества.Таким образом,химическая кинетика-раздел химии,изучающий скорость и механизмы химических реакции,как было рассмотрено выше.
41. Влияние температуры на скорость химической реакции, правило Вант-Гоффа, закон Аррениуса.
Скорость химической реакции есть число элементарных актов химической реакции, происходящих в единицу времени в единице объема (для гомогенных реакций) или на единице поверхности (для гетерогенных реакций).
Скорость химической реакции есть изменение концентрации реагирующих веществ в единицу времени.
Средняя скорость в промежутке времени Δt
В различных интервалах времени средняя скорость химической реакции имеет разные значения; истинная (мгновенная) скорость реакции определяется как производная от концентрации по времени:
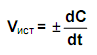 Истинная (мгновенная) скорость реакции Истинная (мгновенная) скорость реакции
Скорость химической реакции в каждый момент времени пропорциональна концентрациям реагентов, возведенным в некоторые степени.
Для элементарных реакций показатель степени при значении концентрации каждого вещества часто равен его стехиометрическому коэффициенту, для сложных реакций это правило не соблюдается. Кроме концентрации на скорость химической реакции оказывают влияние следующие факторы:
природа реагирующих веществ,
наличие катализатора,
температура (правило Вант-Гоффа),
давление,
площадь поверхности реагирующих веществ.
Правило Вант-Гоффа — эмпирическое правило, позволяющее в первом приближении оценить влияние температуры на скорость химической реакции в небольшом температурном интервале (обычно от 0 °C до 100 °C). Я. Х. Вант-Гофф на основании множества экспериментов сформулировал следующее правило: При повышении температуры на каждые 10 градусов константа скорости гомогенной элементарной реакции увеличивается в два — четыре раза.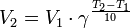
где — скорость реакции при температуре , — скорость реакции при температуре , — температурный коэффициент реакции (если он равен 2, например, то скорость реакции будет увеличиваться в 2 раза при повышении температуры на 10 градусов).
Следует помнить, что правило Вант-Гоффа применимо только для реакций с энергией активации 60-120 кДж/моль в температурном диапазоне 10-400oC. Правилу Вант-Гоффа также не подчиняются реакции, в которых принимают участие громоздкие молекулы, например белки в биологических системах. Температурную зависимость скорости реакции более корректно описывает уравнение Аррениуса.
Из уравнения Вант-Гоффа температурный коэффициент вычисляется по формуле:
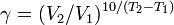
Уравне́ние Арре́ниуса устанавливает зависимость константы скорости химической реакции от температуры
Согласно простой модели столкновений химическая реакция между двумя исходными веществами может происходить только в результате столкновения молекул этих веществ. Но не каждое столкновение ведёт к химической реакции. Необходимо преодолеть определённый энергетический барьер, чтобы молекулы начали друг с другом реагировать. То есть молекулы должны обладать некой минимальной энергией (энергия активации ), чтобы этот барьер преодолеть. Из распределения Больцмана для кинетической энергии молекул известно, что число молекул, обладающих энергией E_A" ALIGN=BOTTOM WIDTH=31 HEIGHT=8 BORDER=0>, пропорционально 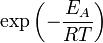 . В результате скорость химической реакции представляется уравнением, которое было получено шведским химиком Сванте Аррениусом из термодинамических соображений: . В результате скорость химической реакции представляется уравнением, которое было получено шведским химиком Сванте Аррениусом из термодинамических соображений:
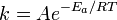
Где А-частота столкновений реагирующих молекул
Это уравнение в другом виде 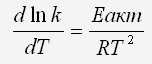
Скорость реакции сильнее изменяется с температурой в тех реакциях, в которых энергия активации больше и наоборот, если в данной реакции энергия активации незначительна, то скорость этой реакции слабо изменяется с температурой.
42. Энергия активации, ее физический смысл. Методы определения энергии активации.
Энергия активации - минимальное количество энергии, которое требуется сообщить системе (джоуль на моль), чтобы произошла реакция. Термин введён Сванте Августом Аррениусом в 1889. Типичное обозначение энергии реакции Ea
В химической модели, известной как Теория активных соударений, есть три условия, необходимых для того, чтобы произошла реакция:
Молекулы должны столкнуться. Это важное условие, однако его не достаточно, так как при столкновении не обязательно произойдёт реакция.
Молекулы должны обладать необходимой энергией (энергией активации). В процессе химической реакции взаимодействующие молекулы должны пройти через промежуточное состояние, которое может обладать большей энергией. То есть молекулы должны преодолеть энергетический барьер; если этого не произойдёт, реакция не начнётся.
Молекулы должны быть правильно ориентированы относительно друг друга.
При низкой (для определённой реакции) температуре большинство молекул обладают энергией меньшей, чем энергия активации, и неспособны преодолеть энергетический барьер. Однако в веществе всегда найдутся отдельные молекулы, энергия которых значительно выше средней. Даже при низких температурах большинство реакций продолжают идти. Увеличение температуры позволяет увеличить долю молекул, обладающих достаточной энергией, чтобы преодолеть энергетический барьер. Таким образом повышается скорость реакции.
Уравнение Аррениуса устанавливает связь между энергией активации и скоростью протекания реакции: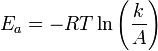
k — константа скорости реакции, A — фактор частоты для реакции, R — универсальная газовая постоянная, T — температура в кельвинах.
С повышением температуры растёт вероятность преодоления энергетического барьера.
Для количественного описания температурных эффектов в химической кинетике для приближённых вычислений кроме уравнения Аррениуса используют правило Вант-Гоффа: повышение температуры на 10 К увеличивает для большинства реакций скорость в 2-4 раза. Математически это означает, что скорость реакции зависит от температуры степенным образом:
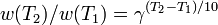
где γ — температурный коэффициент скорости (его значение лежит в интервале от 2 до 4). Правило Вант-Гоффа является весьма грубым и применимо только в очень ограниченном интервале температур.
Переходное состояние — состояние системы, при котором уравновешены разрушение и создание связи. В переходном состоянии система находится в течение небольшого (10−15 с) времени. Энергия, которую необходимо затратить, чтобы привести систему в переходное состояние, называется энергией активации. В многоступенчатых реакциях, которые включают в себя несколько переходных состояний, энергия активации соответствует наибольшему значению энергии. После преодоления переходного состояния молекулы вновь разлетаются с разрушением старых связей и образованием новых или с преобразованием исходных связей. Оба варианта возможны, так как происходят с высвобождением энергии. Существуют вещества, способные уменьшить энергию активации для данной реакции. Такие вещества называют катализаторами. Биологи же такие вещества называют ферментами.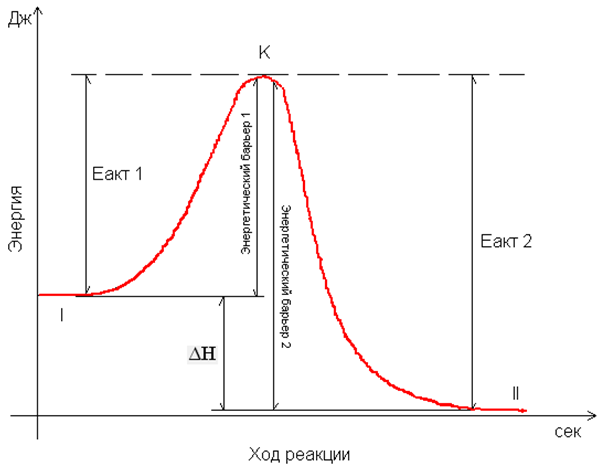 I - энергетический уровень до реакции I - энергетический уровень до реакции
II - более низкий энергетический уровень после реакции
ΔН - выделившиеся энергия в ходе реакции
К – уровень наименьшего запаса энергии, для взаимодействия молекул
Еакт 1 - энергия активации прямой реакции
Еакт 2 - энергия активации обратной реакции
В большинстве случаев для расчета энергии активации Еа по экспериментальным данным используют интегральную форму уравнения Вант-Гоффа-Аррениуса или его запись в виде:
lgK=lgKo- Е а/2,303RT (9)
Следовательно, lgK линейно зависит от обратной абсо�лютной температуры
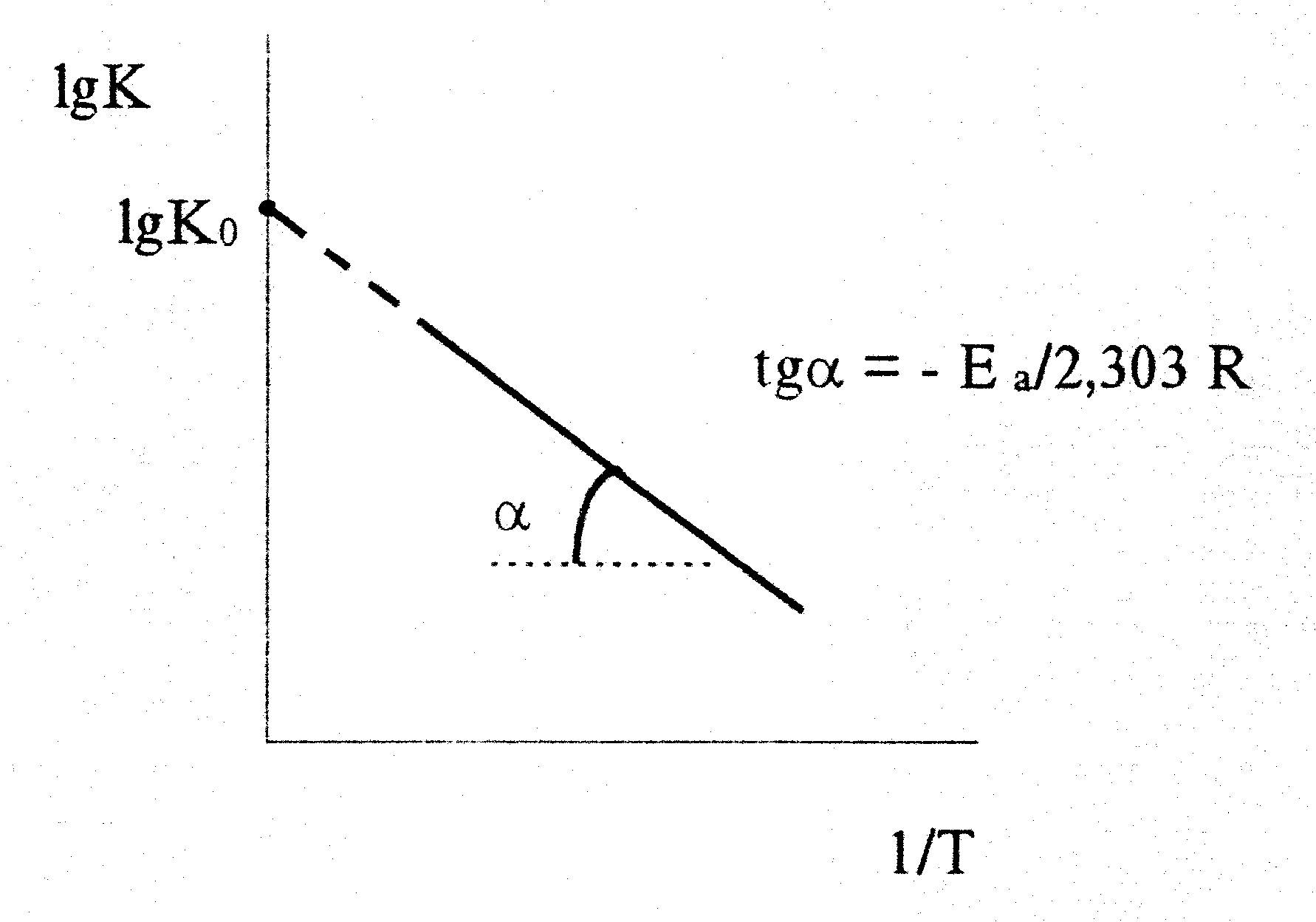 Значение Еа находят по тангенсу угла наклона прямой, проходящей через экспериментальные точки: Е а= -2,303Rtgα. Значение Еа находят по тангенсу угла наклона прямой, проходящей через экспериментальные точки: Е а= -2,303Rtgα.
Предэкспоненциальный множитель К0 определяется от�резком, отсекаемым продолжением прямой на оси ординат при 1/Т = 0.
Если имеются значения константы скорости химической реакции при двух температурах, то из уравнения (9) можно полу�чить:
Еа =(2,303RT1T2 lgK2 /K1 )/(T2-T1) (10)
Энергия активации Еа имеет размерность энергия/моль и измеряется в единицах Дж/моль. Размерность К0 совпадает с раз�мерностью константы скорости. Теория и экспериментальные данные (для широкого температурного интервала) показывают, что Еа и К зависят от температуры. Однако эту зависимость мож�но не учитывать, если реакции исследуются в достаточно узком температурном интервале.
Изложенный выше метод расчета Еа предполагает, что константы скорости реакций при различных температурах извест�ны.
Однако, есть способ расчета Еа, так называемый метод трансформации, который не требует знания K=f(T).
Пусть при температурах T1 и T2в смесях одного и того же начального состава протекает химическая реакция. Если к момен�там времени τ1 и τ2 реакция прошла на одну и ту же глубину, то есть изменения концентраций исходных веществ или продуктов реакции одинаковы, то отношение скоростей реакции равно:
W1 / W2 = (dC/d τ1 ) /(dC/d τ2) = d τ2 / d τ1. (11)
Заменим в уравнении (11) скорости реакций при заданных температурах соотношением
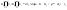 . (11а) . (11а)
Таким образом, отношение K1 /K2 можно заменить отно�шением τ1 / τ2
Подставим в отношение (11а) значения констант скорости при температурах T1 и Т2, используя уравнение Аррениуса:
K0exp(-Ea/RT1)/ K0exp(-Ea/RT2) = d τ2 / d τ1.
Полагая, что для узкого температурного интервала К0 и Еа= const находим
ехр[-Ea/R(l/T1 - 1/Т2)] = d τ2 / d τ1. (12)
Разделение переменных и интегрирование дают:
ехр[-Еа(Т2 – T1 )/RT1 T2 ] = τ2 / τ1. (13)
Следовательно, при заданных T1 и Т2 отношение τ2 / τ1 для реакций, протекающих на одну и ту же глубину, постоянно и называется коэффициентом трансформации. Если этот коэффици�ент известен, то значение энергии активации рассчитывается по формуле:
Еа = R[T1 T2 /(Т2 – T1)]-ln(τ2 / τ1).
|
|
|
 Скачать 0.58 Mb.
Скачать 0.58 Mb.