шпоры фх. 1. Физическая химия цель, задачи, методы исследования. Основные понятия физической химии. Физ химия
 Скачать 0.58 Mb. Скачать 0.58 Mb.
|
|
43.Катализ, основные свойства катализатора Ката́лиз - избирательное ускорение одного из возможных термодинамически разрешенных направлений химической реакции под действием катализаторов, которые многократно вступают в промежуточное химическое взаимодействие с участниками реакции и восстанавливают свой химический состав после каждого цикла промежуточных химических взаимодействий. Термин «катализ» был введён в 1835 году шведским учёным Йёнсом Якобом Берцелиусом. Катализатор изменяет механизм реакции на энергетически более выгодный, то есть снижает энергию активации. Катализатор образует с молекулой одного из реагентов промежуточное соединение, в котором ослаблены химические связи. Это облегчает его реакцию со вторым реагентом. Важно отметить, что катализаторы ускоряют обратимые реакции, как в прямом, так и в обратном направлениях. Вещества , которые замедляют реакцию называются ингибиторами. Если при добавлении катализатора к реагирующей системе происходит ускорение химического процесса , то такое явление называют положительным катализом, а при замедлении реакции отрицательным катализом. Реакции в которых катализатором является исходные или конечные продукты называются автокаталитическими. Каталитические процессы имеют ряд общих характерных особенностей:
Каталитические реакции по фазовому составу участников и катализатора , а не по существу механизма процесса удобно разделить на гомогенный и гетерогенный. При гомогенном катализе катализатор и реагирующие вещества находятся в одной фазе- газовой или в растворе. Плюсы:
Минусы:
Часто неустойчивы и не подлежат регенерации. При гетерогенном катализе реагент и катализатор находятся в разных фазах. Плюсы:
Минусы:
По признакам относящимся к катализатору, гомогенный катализ подразделяется на кислотно-основной и окислительно-восстановительный. Ферменты-«Природные катализаторы» белковые молекулы, регулирующие биохимические реакции. Плюсы: Минусы: работают только при определенных условиях, таких, в которых протекают реакции в живых организмах. 44. биогенные каталитические реакции. Кинетический анализ гомогенной каталитической реакции. Явление катализа распространено в природе (большинство процессов, происходящих в живых организмах, являются каталитическими) и широко используется в технике (в нефтепереработке и нефтехимии, в производстве серной кислоты, аммиака, азотной кислоты и др.). Большая часть всех промышленных реакций — это каталитические. Ферменты – это особые белки, ко торые действуют как катализаторы в биологических системах. Ферменты – уникальные катализаторы, обладающие непревзойденной эффективностью действия и высокой селек тивностью. В настоящее время известно более 2000 ферментов, многие из которых катализируют одну реакцию. Активность большой группы ферментов проявляется только в присутствии определенных соединений небелковой природы, называемых кофакторами. В качестве ко факторов выступают ионы металлов или органические соединения. Примерно третья часть ферментов активируется переходными металлами. Ионы металлов в ферментах выполняют ряд функций: являются электрофильной группой активного центра фермента и облегчают взаимодействие с отрицательно заряженными участками молекул субстрата, формируют каталитически активную конформацию структуры фермента (в формировании спиральной структуры РНК, участвуют ионы цинка и марганца), участвуют в транс порте электронов (комплексы переноса электрона). Способность иона металла выполнять свою роль в активном центре соответствующего фермента зависит от способности иона металла к комплексообразованию, геометрии и устойчивости образуемого комплекса. Это обеспечивает повышение селективности фермента по отношению к субстратам, активации связей в ферменте или субстрате посредством координации и изменении формы субстрата в соответствии со стерическими требованиями активного центра. Биокомплексы различа ются по устойчивости. Одни из них настолько прочны, что постоянно находятся в организме и выполняют определенную функцию. В тех случаях, когда связь кофактора и белка фермента прочна и разделить их трудно, его называют «простетической группой». Такие связи обнаружены в ферментах, содержащих гем-комплексное соединение железа с про изводным порфина. Роль металлов таких комплексов высокоспецифична: замена его даже на близкий по свойствам элемент приводит к значительной или полной утрате физиологической активности. Данные ферменты относят к специфическим ферментам. Примерами таких соединений является хлорофилл, полифенилоксидаза, витамин В12, гемоглобин и некоторые металлоферменты (специфические ферменты). Немногие ферменты участвуют только в одной определенной или единственной реакции. Каталитические свойства большинства ферментов определяются активным центром, образуемым разными микроэлементами. Ферменты синтезируются на период выполнения функции. Ион металла выполняет роль активатора и его можно заменить ионом другого металла без потери физиологической активности фермента. Такие отнесены к неспецифическим ферментам. Биокомплексы различа ются по устойчивости. Одни из них настолько прочны, что постоянно находятся в организме и выполняют определенную функцию. В тех случаях, когда связь кофактора и белка фермента прочна и разделить их трудно, его называют «простетической группой». Такие связи обнаружены в ферментах, содержащих гем-комплексное соединение железа с про изводным порфина. Роль металлов таких комплексов высокоспецифична: замена его даже на близкий по свойствам элемент приводит к значительной или полной утрате физиологической активности. Данные ферменты относят к специфическим ферментам. Примерами таких соединений является хлорофилл, полифенилоксидаза, витамин В12, гемоглобин и некоторые металлоферменты (специфические ферменты). Немногие ферменты участвуют только в одной определенной или единственной реакции. Каталитические свойства большинства ферментов определяются активным центром, образуемым разными микроэлементами. Ферменты синтезируются на период выполнения функции. Ион металла выполняет роль активатора и его можно заменить ионом другого металла без потери физиологической активности фермента. Такие отнесены к неспецифическим ферментам. 45. Электрохимия, особенности электрохимических реакций. ЭЛЕКТРОХИМИЯ, раздел физ. химии, к-рый изучает системы, содержащие ионы (р-ры, расплавы и твердые электролиты), а также процессы и явления с участием заряженных частиц (ионов и электронов), имеющие место на границе раздела двух фаз. Обычно одной из фаз является металл или полупроводник, другая фаза - р-р или расплав электролита либо твердый электролит. Для таких двухфазных систем термин "электрохимия" имеет более узкий смысл как наука, изучающая взаимод. зарядов металла или полупроводника с ионами и молекулами р-ра (расплава, твердого электролита). Часто это взаимод. сопровождается возникновением в цепи электрич. тока, тогда электрохимию можно определить как науку, изучающую физ.-хим. процессы, к-рые сопровождаются появлением электрич. тока или, наоборот, возникают под действием электрич. тока на хим. соединения. Последнее определение широко распространено, хотя и является наиб. узким. Для того чтобы составить ясное представление об электрохимических реакциях, необходимо понять их особенности в сравнении с химическими. С этой целью рассмотрим какую-либо химическую реакцию, например: Cu+ + Fe3 + = Cu2 + + Fe2 + Если данная реакция протекает как химический процесс, то она будет характеризоваться некоторыми особенностями. Химическая реакция возможна только при столкновении ее участников друг с другом. Следовательно, необходимость контакта реагирующих частиц является первой особенностью химического превращения. В момент столкновения становится возможным переход электронов с одной частицы на другую - от восстановителя (Cu+) к окислителю (Fe3 +). Путь электрона окажется при этом очень малым, что является второй характерной особенностью химического процесса. Столкновения могут происходить в любых точках реакционного объема и при любых взаимных положениях реагирующих частиц, поэтому электронные переходы могут совершаться в любых направлениях в пространстве (рис. 1). Хаотичность, беспорядочность столкновений между реагирующими частицами и ненаправленность электронных переходов являются третьей особенностью химической реакции. В результате этих особенностей энергетический эффект химической реакции выражается в форме выделенной или поглощенной теплоты. Чтобы энергетические изменения, соответствующие химическому превращению, проявлялись в виде электрической энергии, то есть чтобы происходил электрохимический процесс, необходимо создать определенные условия. В электрохимических процессах переход электронов от одного участника реакции к другому должен совершаться по достаточно длинному пути, поскольку получение или затрата электрической энергии всегда связаны с прохождением электрического тока, представляющего собой поток электронов, перемещающихся по одному и тому же пути. Поэтому для электрохимического процесса обязательно пространственное разделение участников реакции: восстановитель и окислитель должны быть разделены, а электроны должны передаваться от восстановителя к окислителю по одному общему пути перехода. С этой целью необходимо непосредственный контакт между участниками реакции заменить их контактом с двумя пластинами металла, соединенными между собой каким-либо металлическим проводником. Чтобы поток электронов был непрерывным, нужно обеспечить прохождение электрического тока также и через реакционное пространство, что обычно осуществляется участниками электрохимической реакции (если они присутствуют в виде ионов) и специально добавленными соединениями, обладающими высокой ионной проводимостью. Таким образом, для осуществления электрохимической реакции необходима некоторая система - электрохимическая цепь (рис. 2). Существенные элементы такой системы: 1) два электрода, состоящие из электронопроводящих материалов (металла, графита и т.п.), контактирующих с ионными проводниками (электролитами), они осуществляют обмен электронами с участниками реакции; 2) металлический проводник (проводник I рода), соединяющий электроды и обеспечивающий прохождение электрического тока между ними, он представляет собой внешнюю цепь; 3) раствор электролита, его расплав или твердый электролит (проводники II рода), эта часть системы есть внутренняя цепь. Чтобы осуществить реакцию (1) электрохимическим путем, система должна содержать два отделения, между которыми имеется ионопроницаемая мембрана. В одно отделение нужно налить раствор CuCl, а в другое - FeCl3 , а затем погрузить в растворы по пластине инертного электрода, например платины, и замкнуть их металлическим проводником. После замыкания потечет электрический ток, причем электроны будут двигаться от пластины, погруженной в раствор CuCl, к пластине, погруженной в раствор FeCl3 . Ионы Cu+ будут отдавать электроны платиновой пластине, превращаясь в ионы Cu2 +, а ионы Fe3 + будут забирать электроны с платиновой пластины, превращаясь в Fe2 +. В итоге химическая реакция (1) разделяется на две полуреакции. Одна из них, сопровождающаяся отщеплением электронов, является реакцией окисления; другая, связанная с поглощением электронов, - восстановления: Сu+ = Cu2 + + e, Fe3 + + e = Fe2 + Электрод, на котором происходит окисление, является анодом, а восстановление - катодом. В сумме двух процессов (2) и (3), происходящих на аноде и катоде, реализуется реакция (1). В качестве еще одного примера приведем хорошо известную реакцию вытеснения металлическим цинком меди из водных растворов Zn + Cu2 + = Zn2 + + Cu идущую всегда по электрохимическому пути, состоящему в окислении цинка и осаждении меди Zn = Zn2 + + 2e- Cu2 + + 2e- = Cu Реакции, протекающие на границе проводник первого рода/проводник второго рода с участием электронов, и являются электрохимическими. К ним относятся реакции (2), (3), (5) и (6). Для них важную роль играет строение границы раздела между электродом и раствором. Существенна также направленность потоков окислителя и восстановителя к поверхности электродов, а продуктов реакции от электродов в объем раствора. Важным следствием этих особенностей является то, что большая часть химической энергии при электрохимическом способе проведения реакции превращается в электрическую, тогда как энергия обычной химической реакции выделяется в виде теплоты. Электрохимическая цепь работает как химический источник тока (гальванический элемент), если в ней электрический ток возникает в результате самопроизвольно идущей реакции, как в рассмотренных выше примерах. При помощи электрохимической цепи и внешнего источника тока можно осуществить различные химические превращения веществ. Такая цепь работает как электролизер. ЭЛЕКТРОДНЫЕ ПОТЕНЦИАЛЫ И ЭЛЕКТРОДВИЖУЩИЕ СИЛЫ. На границе раздела электроно- и ионопроводящих фаз, составляющих электрод, возникает разность потенциалов вследствие перехода заряженных частиц из одной фазы в другую. Эта разность потенциалов представляет собой так называемый электродный потенциал. Например, в случае электродов, состоящих из металла и раствора его соли (Cu2 + / Cu, Zn2 + / Zn), через межфазную границу переходят ионы металла и электроны, а электродная реакция Me 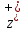 + ze- = Ме + ze- = Меявляется потенциалопределяющей. Если реакция равновесна, то есть протекает с одинаковой скоростью в прямом и обратном направлениях, то на электроде реализуется равновесный потенциал. Разность равновесных потенциалов двух электродов, из которых составлен гальванический элемент, представляет собой его электродвижущую силу (ЭДС). Гальванические элементы, соответствующие реакциям (1) и (4), можно записать в виде - Pt, Cu2 + | Cu+ | | Fe3 + | Fe2 +, Pt + - Zn | ZnSO4 | | CuSO4 | Cu + Для этих систем ЭДС есть разность потенциалов соответствующих электродов В общем виде ЭДС гальванического элемента равна разности равновесных потенциалов катода и анода Е = Ek - Еa Измерить или рассчитать скачок потенциала на отдельно взятой границе раздела двух различных фаз принципиально невозможно, в связи с чем под электродным потенциалом понимается ЭДС гальванического элемента, составленного из двух электродов, потенциал одного их которых подлежит определению, а потенциал другого условно принимается за нуль. Таким электродом служит нормальный (стандартный) водородный электрод Pt, H2 / H+, у которого активность ионов водорода и давление газообразного водорода равны единице при Т = 293 К. По величине равновесных потенциалов различные электроды в стандартных условиях (активность потенциалопределяющих ионов равна единице) можно расположить в электрохимический ряд, позволяющий предсказать, в каком направлении пойдет окислительно-восстановительная реакция при данных концентрациях реагентов, и, в частности, ответить на вопрос, почему реакции (1) и (4) самопроизвольно пойдут именно в указанном направлении, а не наоборот. Электродвижущая сила гальванического элемента, в котором реакция протекает самопроизвольно, есть величина положительная и Еk > Еa в соответствии с уравнением (7), то есть электрод, на котором совершается процесс восстановления, имеет более положительный потенциал, чем электрод, на котором идет процесс окисления. Данное условие строго выполняется для приведенных выше реакций. Следовательно, каждая электрохимическая реакция, потенциал которой отрицательнее, будет идти в направлении отдачи электрона (окисления), в то время как сопряженная с ней вторая электрохимическая реакция, потенциал которой положительнее, пойдет в направлении присоединения электрона (восстановления). Эти положения позволяют оценить принципиальную возможность электрохимических превращений, однако важно располагать данными о скорости таких превращений с тем, чтобы можно было сознательно управлять ими. УПРАВЛЕНИЕ СКОРОСТЬЮ ЭЛЕКТРОХИМИЧЕСКИХ РЕАКЦИЙ. Для того чтобы электрохимическая реакция не была равновесной, а происходила с определенной скоростью преимущественно в каком-то одном направлении, необходимо, чтобы через электрод протекал электрический ток. Достигнуть этого можно двумя путями: соединением между собой электродов гальванического элемента металлическим проводником или подключением извне источника тока. Потенциал электрода при этом сместится от равновесного значения в сторону увеличения при ускоренном отводе электронов (анодная поляризация) и в сторону уменьшения при ускоренном подводе электронов (катодная поляризация). Это означает, что скорость электрохимического процесса можно оценить по величине протекающего через электрод электрического тока j, а последний, в свою очередь, непосредственно связан с величиной электродного потенциала. Если j = 0, то потенциал равен равновесному значению. Чем больше потенциал смещен от равновесного значения, тем выше скорость соответствующей электрохимической реакции. Однако неправильно было бы думать, что повышать скорость какой-либо реакции можно беспредельно, изменяя потенциал электрода. Значительное смещение потенциала приводит к смене одной электрохимической реакции на другую. Таким образом, характерной особенностью электрохимических реакций является зависимость их скорости от потенциала. Задавая определенный потенциал, имеем возможность сравнительно просто управлять кинетикой электрохимической реакции, тем самым осуществлять химические превращения веществ не под действием других веществ, а под действием электрического тока. Электрохимический путь зачастую оказывается наиболее целесообразным как технологически, так и экологически. 46-47. Теория сильных электролитов. Сильные электролиты полностью диссоциируют на ионы. В водных растворах сильных электролитов существуют простые или сольватированные катионы и анионы. Это подтверждается современными физическими и физико-химическими исследованиями. Однако опытным путем найдено, что электропроводность водных растворов сильных электролитов не эквивалентна той электропроводности, которую можно было бы ожидать при 100%-ной диссоциации молекул на ионы. Такое несоответствие объясняется теорией сильных электролитов, предложенной Дебаем и Хюккелем. Согласно этой теории, в растворах сильных электролитов между ионами существует электростатическое взаимодействие. Каждый ион окружен ионной атмосферой из противоионов. Ионная атмосфера тормозит движение ионов в электрическом поле, в результате чего создается эффект неполной диссоциации сильного электролита. Мерой электростатического взаимодействия ионов является ионная сила раствора μ, равная полусумме произведений квадрата заряда каждого из присутствующих в растворе ионов на его концентрацию.
В связи с влиянием ионной силы раствора та концентрация, согласно которой ион действует в растворе, называется активной концентрацией (активностью):
где f – коэффициент активности, который характеризует взаимодействие ионов. Коэффициент активности может быть рассчитан в зависимости от ионной силы по выражениям:
или взят из справочной литературы (необходимо объяснить учащимся, как пользоваться таблицей «Коэффициенты активности ионов при различной ионной силе»). Активность необходимо использовать при расчете любого химического равновесия, если в системе находится сильный электролит, концентрация которого больше 1.10-4 моль/л. ОСНОВНЫЕ ПОЛОЖЕНИЯ ТЕОРИИ СИЛЬНЫХ ЭЛЕКТРОЛИТОВ В связи с тем что теория Аррениуса не могла объяснить по- ведение электролитов (особенно сильных), появились другие представления о свойствах растворов электролитов и о процессах, происходящих в них. Так, Д.И.Менделеев предложил химическую теорию строения растворов электролитов, согласно которой бла- годаря химическому взаимодействию между растворенными ве- ществами и растворителем образуются "непрочные соединения в состоянии диссоциации". Одной из теорий, количественно учитывающих ион-ионные взаимодействия, явилась т е о р и я Дебая — Гюккеля (1923), достаточно хорошо объясняющая свойства разбавленных раство- ров сильных электролитов. Эта теория построена на основе следующих предпосылок. 1. В качестве рабочей гипотезы было принято представление, что сильные электролиты в растворах любой концентрации со- держатся только в виде ионов, т.е. для них всегда а = 1. Эта гипоте- за подтвердилась позднее с помощью спектроскопических и дру- гих методов. 2. Между ионами в растворе наблюдаются электростатичес- кие взаимодействия. 3. Силы электростатического взаимодействия в соответствии с законом Кулона обратно пропорциональны квадрату расстоя- ния между ними. Поэтому эти силы убывают с расстоянием гораздо медлен- нее, чем межмолекулярные силы Ван-дер-Ваальса, и в разбавленных растворах сохраняют достаточную величину, чтобы оказывать влияние на свойства растворов. Для расчета сил взаимодействия надо знать закон распределения ионов и их кон- центрации. 4. Распределение ионов в растворе как функция расстояния от любого иона, т.е. как функция силового поля, создаваемого ионом с некоторым средним потенциалом ц/ в единице объема, подчиняется известному закону распределения Больцмана, выве- денному, правда, для нейтральных частиц: 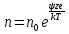 5. Некоторая упорядоченность распределения ионов в ра- створе является следствием того, что в данном объеме раствора около любого иона должны преобладать ионы противоположного знака. Суммарный заряд сферы, описанной из центра, где находится произвольный ион, имеет избыточный заряд, противоположный по знаку заряда центрального иона, но равный ему по величине. Сфера, в которой преобладает заряд, противоположный по знаку центральному иону, называется ионной атмосферой. Тепловое движение постоянно меняет картину распределения ионов в ионной атмосфере. |
