шпоры фх. 1. Физическая химия цель, задачи, методы исследования. Основные понятия физической химии. Физ химия
 Скачать 0.58 Mb. Скачать 0.58 Mb.
|
|
Скорость химической реакции Под скоростью химической реакции понимают изменение количества веществ, вступающих в реакцию или образующихся в ходе процесса, в единицу времени, в единице реакционного пространства: 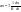 . .Количество вещества (n), реагирующего за единицу времени, всегда пропорционально величине реакционного пространства – объему фазы (в гомогенной системе) или площади поверхности раздела фаз (в гетерогенной системе). Различают среднюю и мгновенную (истинную) скорость химической реакции. Средней скоростью реакции за данный промежуток времени называется отношение изменения концентрации исходных веществ (продуктов реакции) ко времени, в течение которого это изменение произошло: 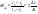 . .Мгновенная (истинная) скорость определяется как производная концентрации от времени в каждой точке кинетической кривой, т.е. как отношение изменения концентрации реагирующих веществ или продуктов реакции к бесконечно малому промежутку времени: 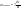 .В случае гетерогенной реакции: .В случае гетерогенной реакции: 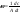 . .Основной постулат химической кинетики Для реакции 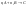 , основной постулат можно записать , основной постулат можно записать 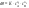 , ,  - скорость. На основании закона действия масс основной постулат химической кинетики был открыт в 1864 году скандинавским химиком Гульдбергом и математиком Вааге. Коэффициент пропорциональности в уравнении основного постулата К - это константа скорости химической реакции. Ее физический смысл определяется следующим образом: если - скорость. На основании закона действия масс основной постулат химической кинетики был открыт в 1864 году скандинавским химиком Гульдбергом и математиком Вааге. Коэффициент пропорциональности в уравнении основного постулата К - это константа скорости химической реакции. Ее физический смысл определяется следующим образом: если 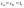 то то 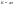 и поэтому ее иногда называют удельной скоростью.Порядок реакции и молекулярность. Порядок реакции - это сумма показателей степени, в которые возведены концентрации в уравнении основного постулата химической кинетики. Общий порядок реакции может быть равен сумме стехиометрических коэффициентов только для простейших реакций, а в общем случае это не выполняется. Другая важная характеристика химических реакций - молекулярность. Молекулярность - это число молекул, участвующих в одном элементарном химическом акте. Молекулярность – может быть равна единице - это мономолекулярные реакции, 2 - это бимолекулярные и реже – 3 (вероятность столкновения одновременно трех молекул в одном элементарном акте очень мала) - это тримолекулярные реакции. и поэтому ее иногда называют удельной скоростью.Порядок реакции и молекулярность. Порядок реакции - это сумма показателей степени, в которые возведены концентрации в уравнении основного постулата химической кинетики. Общий порядок реакции может быть равен сумме стехиометрических коэффициентов только для простейших реакций, а в общем случае это не выполняется. Другая важная характеристика химических реакций - молекулярность. Молекулярность - это число молекул, участвующих в одном элементарном химическом акте. Молекулярность – может быть равна единице - это мономолекулярные реакции, 2 - это бимолекулярные и реже – 3 (вероятность столкновения одновременно трех молекул в одном элементарном акте очень мала) - это тримолекулярные реакции.32) Основной постулат химической кинетики. Гомогенные, гетерогенные реакции. Порядок и молекулярность реакции, отличая между ними. Хими́ческая реа́кция — превращение одного или нескольких исходных веществ (реагентов) в отличающиеся от них по химическому составу или строению вещества (продукты реакции). В отличие от ядерных реакций, при химических реакциях ядра атомов не меняются, в частности не изменяется их общее число, изотопный состав химических элементов, при этом происходит перераспределение электронов и ядер и образуются новые химические вещества.Химические реакции происходят при смешении или физическом контакте реагентов самопроизвольно, при нагревании, участии катализаторов (катализ), действии света (фотохимические реакции), электрического тока (электродные процессы), ионизирующих излучений (радиационно-химические реакции), механического воздействия (механохимические реакции), в низкотемпературной плазме (плазмохимические реакции) и т. п. Взаимодействие молекул между собой происходит по цепному маршруту: ассоциация – электронная изомеризация – диссоциация, в котором активными частицами являются радикалы,ионы, координационно-ненасыщенные соединения. Скорость химической реакции определяется концентрацией активных частиц и разницей между энергиями связи разрываемой и образуемой.Существует большое количество признаков, по которым можно классифицировать химические реакции.По фазовому составу реагирующей системы Гомогенные гомофазные реакции. В реакциях такого типа реакционная смесь является гомогенной, а реагенты и продукты принадлежат одной и той же фазе. Примером таких реакций могут служить реакции ионного обмена, например, нейтрализация кислоты и щелочи в растворе: NaOH(раств.) + HCl(раств.) → NaCl(раств.) + H2O(жидкость) Гетерогенные гетерофазные реакции. В этом случае реагенты находятся в разном фазовом состоянии, продукты реакции также могут находиться в любом фазовом состоянии. Реакционный процесс протекает на границе раздела фаз. Примером может служить реакция солей угольной кислоты (карбонатов) с кислотами Бренстеда: CO3(твердое) + 2HCl(раств.) → Cl2(раств.) + CO2(газ) + H2O(жидкость) Гетерогенные гомофазные реакции. Такие реакции протекают в пределах одной фазы, однако реакционная смесь является гетерогенной. Например, реакция образования хлорида аммония из газообразных хлороводорода и аммиака: NH3(газ) + HCl(газ) → NH4Cl(твердое) Гомогенные гетерофазные реакции. Реагенты и продукты в такой реакции существуют в пределах одной фазы, однако реакция протекает на поверхности раздела фаз. Примером таких реакций являются некоторые гетерогенно-каталитические реакции, например, реакция синтеза аммиака из водорода и азота: N2(газ) + 3H2(газ) → 2 NH3(газ) (катализатор Pt) в зависимости от фазового состояния компонентов (исходных вещ-в и продуктов) различают реакции гомогенные гетерогенные, а также гомофазные и гетерофазные. Гомогенными называют реакции, протекающие в одной фазе: в смеси газов, в жидком растворе или (реже) в твёрдой фазе. К гетерогенным относят реакции , протекающие на границе двух фаз. Таких случаев 9границ фаз) может быть 5:Т-Т, Т-Ж, Т-Г, Ж-Ж, Т-Г. Граница Г-Г не реализуется на практике, так как газы смешиваются в любых соотношениях.В зависимости от числа исходных частиц, участвующих в элементарном акте, говорят о разной молекулярности элементарной стадии или реакции. В мономолекулярной стадии в элементарном акте участвует одна частица и молекулярность равна 1. В бимолекулярной стадии молекулярность равна 2 и в тримолекулярном- 3. Тримолекулярные стадии встречаются редко, так как одновременная встреча 3х частиц в элементарном акте хим.превращения маловероятна. А четырёхмолекулярные стадии в действительности не встречаются, так как одновременная встреча 4хчастиц – событие почти невероятное, и поэтому на практике оно не осуществляется. 33) Влияние концентрации на скорость химической реакции. Физический смысл, размерность константы скорости. Химическая кинетика - это учение о скорости и механизме процесса и его зависимости от различных факторов, позволяющих ускорить или замедлить ход реакции. Скорость химической реакции есть число элементарных актов химической реакции, происходящих в единицу времени в единице объема (для гомогенных реакций) или на единице поверхности (для гетерогенных реакций): Vгом = Δn/VΔt = ± ΔC/Δt; Vгетер = Δn/SΔt Это выражение используют со знаком «+», если скорость определяется по образующемуся в реакции веществу, в противном случае со знаком «-». Т.о. скорость реакции всегда положительна. Скорость химической реакции есть изменение концентрации реагирующих веществ в единицу времени. Средняя скорость в промежутке времени Δt: В различных интервалах времени средняя скорость химической реакции имеет разные значения; истинная (мгновенная) скорость реакции определяется как производная от концентрации по времени: Графики: а) кинетические кривые для исходных веществ (А) и продуктов реакции (В); б) графическое определение истинной скорости. 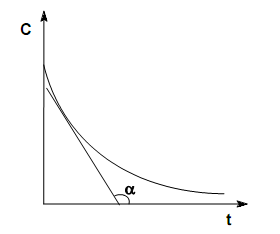 а) б) Для реакции в общем виде скорость химической реакции с учетом стехиометрических коэффициентов: aA + bB = cC + dD Vt = -dCA/dt = -dCB/dt = -dCC/dt = dCD/dt Закон действующих масс: скорость простой реакции при постоянной температуре прямо пропорциональна произведению концентраций реагентов в степени их стехиометрических коэффициентов. Этим правилом и определяется влияние концентрации на скорость реакции. Оно было выражено (в несколько иной форме) впервые Гульдбергом и Вааге (1867). Для простой реакции: aA + bB = cC + dD математическое выражение ЗДМ: V = kCAaCBb, где V – скорость реакции; k – константа скорости реакции; СА и СВ – молярные концентрации реагентов; a и b – кинетический порядок реакции по веществу А и В соответственно. В общем случае: aA + bB + dD +……….. V = kCAaCBbCDd………. Скорость химической реакции, проводимой без добавления реагентов извне, максимальна в начале(кон-ции реагентов max ) и минимальна в конце (конц-я реагентов min) Размерность V: V = [моль/(л•с)] = [моль/(м3•мин)] Константа скорости реакции. Коэффициент пропорциональности k есть константа скорости химической реакции. Физический смысл k вытекает из уравнения V = kCAaCBb .Константа скорости численно равна скорости реакции при концентрациях всех реагирующих веществ, равных 1 моль/л. Константа при постоянной t0 зависит только от природы веществ и не зависит от их концентрации. Размерность k: n =0, [k] = [ моль/л•с] n = 1, [k] = [1/с] Показатель степени при концентрации каждого из реагирующих веществ в кинетическом уравнении химической реакции (соответственно a, b и c) есть частный порядок реакции по данному компоненту. Сумма показателей степени в кинетическом уравнении химической реакции (a + b + c) представляет собой общий порядок реакции. Порядок реакции определяется только из экспериментальных данных и не связан со стехиометрическими коэффициентами при реагентах в уравнении реакции. Стехиометрическое уравнение реакции представляет собой уравнение материального баланса и никоим образом не может определять характера протекания этой реакции во времени. 34) Кинетический анализ необратимых реакций первого порядка в закрытых системах. Химическая кинетика – раздел химии, изучающий скорость и механизмы химических реакций. При кинетических исследованиях химических реакций обычно возникают 3 типа задач: 1) изучение зависимости скорости от конц-ии реагентов определение последних во времени. 2) определение таких кинетических параметров как удельная скорость, константа скорости и энергия активации, нахождение которых является основной задачей химической кинетики. 3) исследование механизма сложных химических превращений. Механизм реакций – совокупность элементарных стадий, слагающих процесс. Классификация по механизму реакции: 1) Простой процесс – протекает в одну стадию (реагент → продукт); 2) Сложный процесс – многостадийный (реагент → промежуточные продукты → конечный продукт) Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в некоторых степенях. Т. е. для реакции aA + bB + dD + ……→ eE + ….. можно записать: V = kCAx CBy CDz….. Коэффициент пропорциональности k есть константа скорости химической реакции. Константа скорости численно равна скорости реакции при концентрациях всех реагирующих веществ, равных 1 моль/л. Показатель степени при концентрации каждого из реагирующих веществ в кинетическом уравнении химической реакции (соответственно х, у и z) есть частный порядок реакции по данному компоненту. Сумма показателей степени в кинетическом уравнении химической реакции (х + у + z) представляет собой общий порядок реакции. Порядок реакции определяется только из экспериментальных данных и не связан со стехиометрическими коэффициентами при реагентах в уравнении реакции. Стехиометрическое уравнение реакции представляет собой уравнение материального баланса и никоим образом не может определять характера протекания этой реакции во времени. A→B W = -dCA/dt W = kCA -dCA/dt = k1CA (1a) -dCA/CA = - k1dt CA t ∫ dCA/CA = -k1 ∫ dt C0A 0 lnCA/C0A = - k1t lnC0A/CA = k1t (1б) k1 = 1/t • lnC0A/CA (1в) – константа первого порядка t = 1/k1 • lnC0A/CA (1г) Если t = 0, C0A = a t = 0, x молей вещества прореагировало k1 = 1/t • lna/a-x (1д) t = 1/k1• lna/a-x (1ж) Для графического определения используем уравнение (1в). Из уравнения (1в) можем записать: k1t = lnC0A – lnCA (1е) lnCA = lnC0A – k1t - уравнение прямой . Из уравнения (1в) и (1д) видно, что константа зависит от начальной концентрации исходных веществ. Уравнения (1в), (1д), (1ж), (1е), называются кинетическими уравнениями первого порядка. dim[k1] = [1/c-1 • моль/л / моль/л] = [1/c-1] = c-1 Чаше всего рассматривают так называемые периоды полураспада – время необходимое для превращения половины начального вещества. Отсчитываем время от начала реакции, полагая, что t = t1/2, тогда x = ½ a, подставляем эти данные в уравнение (1д), тогда k1 = 1/ t1/2 • lna/a – a/2 = ln2/t1/2 = 0,693/ t1/2 (1к) t1/2 = ln2/ k1 = 0,693/ k1 (1з) Из уравнения (1з) видно, что время полупревращения для реакции 1-го порядка не зависит от начальной концентрации. 35) Кинетический анализ необратимых реакций второго порядка в закрытых системах. Химическая кинетика – раздел химии, изучающий скорость и механизмы химических реакций. При кинетических исследованиях химических реакций обычно возникают 3 типа задач: 1) изучение зависимости скорости от конц-ии реагентов определение последних во времени. 2) определение таких кинетических параметров как удельная скорость, константа скорости и энергия активации, нахождение которых является основной задачей химической кинетики. 3) исследование механизма сложных химических превращений. Механизм реакций – совокупность элементарных стадий, слагающих процесс. Классификация по механизму реакции: 1) Простой процесс – протекает в одну стадию (реагент → продукт); 2) Сложный процесс – многостадийный (реагент → промежуточные продукты → конечный продукт) Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в некоторых степенях. Т. е. для реакции aA + bB + dD + ……→ eE + ….. можно записать: V = kCAx CBy CDz….. Коэффициент пропорциональности k есть константа скорости химической реакции. Константа скорости численно равна скорости реакции при концентрациях всех реагирующих веществ, равных 1 моль/л. Показатель степени при концентрации каждого из реагирующих веществ в кинетическом уравнении химической реакции (соответственно х, у и z) есть частный порядок реакции по данному компоненту. Сумма показателей степени в кинетическом уравнении химической реакции (х + у + z) представляет собой общий порядок реакции. Порядок реакции определяется только из экспериментальных данных и не связан со стехиометрическими коэффициентами при реагентах в уравнении реакции. Стехиометрическое уравнение реакции представляет собой уравнение материального баланса и никоим образом не может определять характера протекания этой реакции во времени. Различают 2 типа реакции 2-го порядка:
1)CA = CB W = - dCA/dt , W = kCACB = kCA2 - dCA/dt = kCA2 (2a) -dCA/CA2 = kdt CA t ∫ dCA/CA2 = k ∫ dt C0A 0 CA t ∫ CA-2 dCA = k ∫ dt C0A 0 CA t 1/CA ∫ = kd ∫ C0A 0 1/CA – 1/C0A = k2t (2б) k2 = 1/t • C0A – CA/ CAC0A (2в) t = 1/k2 • C0A – CA/ CAC0A (2г) Если t = 0, C0A = a t не равно 0, CA = a – x k2 = 1/t • a – (a-x)/a(a-x) = 1/t•x/a(a-x) (2д) t = 1/k2 • x/a(a-x) Для графического определения k используется ур-ие (2б) 1/CA – 1/CA = k2t 1/CA = k2t + 1/C0A 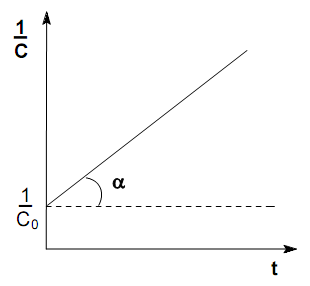 dim [k] = [1/c•моль/л / (моль/л)2] = [с-2•моль-1•л] t = t1/2 x = ½ a Подставим в уравнение (2д) K = 1/t1/2 • a1/2/a(a-a/2) = a/2 /(t1/2 • a2/2) = 1/t1/2 • a (2е) t1/2 = 1/ka Т.о. период полураспада для реакций 2-го порядка при CA = CB обратно проп-но конц-ии исходных вещ-в. 2) CA не равен CB -dCA/dt = -dCB/dt = -dx/dt W = kCACB Если t = 0, C0A=a, C0B=b t не равно 0, CA= (a-x), CB = (b-x) dx/(a-x)(b-x) = kdt Прежде чем взять этот интеграл, разобьем его на слагаемые 1/(a-x)(b-x) = A(b-x) + B(a-x)/(a-x)(b-x) A(b-x) + B(a-x) =1 Если x=b, то A(b-b) + B(a-b) =1 B(a-b) =1 B = 1/(a-b) Если x=a, то A(b-a) + B(a-a) =1 A(b-a) =1 A = 1/(b-a) Используем метод интегральных множителей x x t ∫ (A/(a-x))dx + ∫ (B/(b-x)) = k ∫ dt 0 0 0 Подставим значения А и В: x x t ∫ (1/(a-x)(b-a))dx + ∫ (1/(b-x)(a-b))dx = k ∫ dt 0 0 0 x x t -1/b-a ∫ (d/(a-x)/(a-x) – 1/a-b ∫ (d/(b-x)/(b-x) = k ∫ dt 0 0 0 x x t -1/b-a • ln(a-x) ∫ – 1/a-b • ln(b-x) ∫ = kt ∫ 0 0 0 -1/b-a • [ln(a-x) – ln(a-0)] – 1/a-b • [ln(b-x) – ln(b-0)] = kt -1/b-a • [ln(a-x) – lna] – 1/a-b • [ln(b-x) – lnb] = kt 1/a-b • [ln(a-x)/a] – 1/a-b • [ln(b-x)/b] = kt 1/a-b • [ln(a-x)/a – ln(b-x)/b] = kt 1/a-b • ln((a-x)/a / (b-x)/b) = k2t 1/a-b • ln(b(a-x) / a(b-x)) = k2t (2ж) k2 = 1/t(a-b) • ln(b(a-x) / a(b-x)) (2з) Для графического опр-я k при CA не равен CB используем уравнение (2ж) ln b(a-x)/ a(b-x) = k(a-b)t 36) Кинетический анализ необратимых реакций нулевого порядка в закрытых системах. Химическая кинетика – раздел химии, изучающий скорость и механизмы химических реакций. При кинетических исследованиях химических реакций обычно возникают 3 типа задач: 1) изучение зависимости скорости от конц-ии реагентов определение последних во времени. 2) определение таких кинетических параметров как удельная скорость, константа скорости и энергия активации, нахождение которых является основной задачей химической кинетики. 3) исследование механизма сложных химических превращений. Механизм реакций – совокупность элементарных стадий, слагающих процесс. Классификация по механизму реакции: 1) Простой процесс – протекает в одну стадию (реагент → продукт); 2) Сложный процесс – многостадийный (реагент → промежуточные продукты → конечный продукт) Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в некоторых степенях. Т. е. для реакции aA + bB + dD + ……→ eE + ….. можно записать: V = kCAx CBy CDz….. Коэффициент пропорциональности k есть константа скорости химической реакции. Константа скорости численно равна скорости реакции при концентрациях всех реагирующих веществ, равных 1 моль/л. Показатель степени при концентрации каждого из реагирующих веществ в кинетическом уравнении химической реакции (соответственно х, у и z) есть частный порядок реакции по данному компоненту. Сумма показателей степени в кинетическом уравнении химической реакции (х + у + z) представляет собой общий порядок реакции. Порядок реакции определяется только из экспериментальных данных и не связан со стехиометрическими коэффициентами при реагентах в уравнении реакции. Стехиометрическое уравнение реакции представляет собой уравнение материального баланса и никоим образом не может определять характера протекания этой реакции во времени. Иногда концентрации реагента не входят в выражение для скорости, в таком случае говоря, что реакция «нулевого порядка», т.е. нулевой порядок реакции указывает на независимость скорости реакции от концентрации. Такая зависимость возможна, если: 1) концентрация постоянна; 2) реакция протекает не совсем обычным путем (например, фотохим., каталит.) -dCA/dt = k , n = k -dCA/dt = k CA t - ∫ dCA = k ∫ dt C0A 0 C0A + CA = - kt k0 = 1/t • (C0A - CA) = C0A - CA/t t = C0A - CA/k0 При t = 0, C0A = a t не равно 0, CA = a – x k = a – (a-x)/t = x/t dim [k0] = [моль• с-1• л-1] Для графического определения используем: C0A - CA = kt - CA = kt - C0A CA = - kt + C0A t = t1/2 x = a/2 k0 = a/ 2t1/2 t1/2 = a/ 2k0 |
