шпоры фх. 1. Физическая химия цель, задачи, методы исследования. Основные понятия физической химии. Физ химия
 Скачать 0.58 Mb. Скачать 0.58 Mb.
|
|
Состояние химического равновесия определяется двумя признаками:
Состав равновесной смеси характеризуется тем, что в ней концентрации исходных веществ и концентрации конечных веществ находятся между собой в определенном соотношении. Эти соотношения определяются законом действующих масс. Константу равновесия можно выразить через равновесные парциальные давления системы КР = 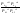 . . Для смеси идеальных газов закон действующих масс можно записать с помощью константы равновесия КР, Кс или Кх, выраженных через различные величины: парциальные давления реагентов Рi, молярные концентрации сi или молярные доли хi. Во всех случаях получается величина, не зависящая от соотношения реагентов в равновесной смеси и имеющая постоянное значение при постоянной температуре. Между КР, Кс и Кх для смеси идеальных газов существует взаимосвязь. Математическое выражение её выводится с использованием уравнения Клапейрона-Менделееева. Эти выражения имеют следующий вид: КР = Кс(RT)Dn, где Dn = n1 + n2 - n3 - n4 – изменение числа молей в ходе реакции, или КР = КхРDn. Эти формулы показывают, что в общем случае числовые значения КР, Кс и Кх не совпадают. Совпадение наблюдается лишь для реакций, идущих без изменения числа молей. Конста́нта равнове́сия — величина, определяющая для данной химической реакции соотношение между термодинамическими активностями (либо, в зависимости от условий протекания реакции, парциальными давлениями, концентрациями или фугитивностями) исходных веществ и продуктов в состоянии химического равновесия (в соответствии с законом действующих масс). Константы равновесия гомогенной хим. р-ии, протекающей в газовой фазе будет выражена через парциальное давление: аА+вВ= mM+nN Кр= 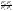 (1). Это ур-е показывает, что каждый компонент представляет собой идеальный газ, тогда для любого участка р-ии справедливо: PiV=niRT. Pi=niRT/V. ni/V=ci. Pi=Ci*RT (2), учитывая это уравнение, тогдаможно записать: Кр= (1). Это ур-е показывает, что каждый компонент представляет собой идеальный газ, тогда для любого участка р-ии справедливо: PiV=niRT. Pi=niRT/V. ni/V=ci. Pi=Ci*RT (2), учитывая это уравнение, тогдаможно записать: Кр=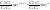 (3) (3)(4) Kc= 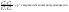 через молярную конц-ю реагирующих компонентов.Тогда Kp= Kc- через молярную конц-ю реагирующих компонентов.Тогда Kp= Kc- (5). Каждый компонент идеальной газовой системы подчиняется закону Дальтона: Pi=Xi (5). Каждый компонент идеальной газовой системы подчиняется закону Дальтона: Pi=Xi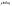 (6). Xi молярная доля i-го компонента в газовой смеси, (6). Xi молярная доля i-го компонента в газовой смеси, 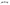 - общ. давление газа в системе. Подставляя ур-е (6) в ур.е (1) получаем: Kp= - общ. давление газа в системе. Подставляя ур-е (6) в ур.е (1) получаем: Kp=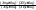 (7) (7)Kp= 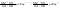 (8) (8)Kx=  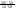 (9) - это ур-е выражает константу равновесия через равновесные молярные доли. Сравнив ур-я (9),(8), (5)- дает соотношение: Kp=Kc* (9) - это ур-е выражает константу равновесия через равновесные молярные доли. Сравнив ур-я (9),(8), (5)- дает соотношение: Kp=Kc*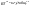 (10). Это ур-е выражает связь между константами равновесия для любой хим. р-ии, кот. Выражены через различные равновесные конц-ии. (10). Это ур-е выражает связь между константами равновесия для любой хим. р-ии, кот. Выражены через различные равновесные конц-ии.2) Р-ии протек-е с изменением числа молекул: а) А+ В= С   +1- +1- + + =2- =2- 1 1 - 1-  1- 1-  NA=  NB= NB= NC= NC=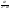 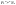 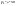 Pc= Pc=  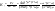 Б) А= С +Д 1 - - 1-     =1- =1- + + + + =1+ =1+  = = 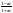 Nc= Nc=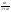 Nd= Nd=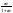 Pa= 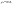 Pc= Pc=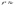 Pd= Pd= Kp= 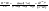 22. Химическое равновесие. Расчет константы равновесия для р-й без изменения числа молей в системе (А+В= С+Д и А=В). Состояние химического равновесия определяется двумя признаками:
Состав равновесной смеси характеризуется тем, что в ней концентрации исходных веществ и концентрации конечных веществ находятся между собой в определенном соотношении. Эти соотношения определяются законом действующих масс. Константу равновесия можно выразить через равновесные парциальные давления системы КР =  . . Для смеси идеальных газов закон действующих масс можно записать с помощью константы равновесия КР, Кс или Кх, выраженных через различные величины: парциальные давления реагентов Рi, молярные концентрации сi или молярные доли хi. Во всех случаях получается величина, не зависящая от соотношения реагентов в равновесной смеси и имеющая постоянное значение при постоянной температуре. Между КР, Кс и Кх для смеси идеальных газов существует взаимосвязь. Математическое выражение её выводится с использованием уравнения Клапейрона-Менделееева. Эти выражения имеют следующий вид: КР = Кс(RT)n, где n = n1 + n2 - n3 - n4 – изменение числа молей в ходе реакции, или КР = КхРn. Эти формулы показывают, что в общем случае числовые значения КР, Кс и Кх не совпадают. Совпадение наблюдается лишь для реакций, идущих без изменения числа молей.Химическое равновесие — состояние химической системы, в котором обратимо протекает одна или несколько химических реакций, причём скорости в каждой паре прямая-обратная реакция равны между собой.
Равновесие: гомогенное, гетерогенное. Гомогенное, если все реаг-е в-ва находятся в одной фазе. Гетерогенное, если они распределены по нескольким фазам: 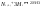 Тут: V1=V2 (выражается хим. равновесие). Основная задача теории хим. равновесия, исходя из справочных данных при использовании температуры и давл., предсказать равновесное состояние сложных смесей в-в, в кот. Может протекать большое число хим. р-й. Хим. равновесие характеризуется в основном общими условиями: 1)Равенством 0 всех термодин-х ф-й при сообтветствующих условиях. 2) динамич-м равновесием. 3) подвижным равновесием ( с изменением параметров равновесия), равновесие изменяется соответствующим образом, при прекращении действия параметров, равновесие возвращается в исходное состояние. Равновесие может быть достигнуто с 2х сторон, со стороны уменьшения или увеличения соответствующих параметров. Основной колич-й закон хим. равновесия-это зак. действующих масс: Закон действующих масс в кинетической форме (основное уравнение кинетики) гласит, что скорость элементарной химической реакции пропорциональна произведению концентраций реагентов в степенях, равных стехиометрическим коэффициентам в уравнении реакции . Этот закон применим для гомогенных равновесных систем. аА+вВ=mM+nN (1) Изменение энергии Гиббса для данной хим. р-ии будет: 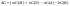 ) (2) ) (2)Изменение энерг. Гиббса для общего участка компонента: dG(i)=VdP(i)-SidT (3) Если р-я протекает при пост. Температуре, тогда dT=0. dG(i)=VdPi (4). Если для идеальн. Газов:PV=RT, V=RT/P, dGi=RT*dPi/Pi=RTlnPi (5) Давл. Газа в станд. Сост.= 1атм, тогда для каждого участка р-ии получим ур-е: Gi= 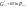 (6) (6)Poi-это парциальное давление i-го участка р-ии на начало р-ии. C учетом этого ур-я: 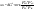 (7). (7).Если в хим. р-ии имеет место сост-е хим. равновесия, тогда 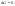 . . 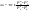 (8) P (A,B,M,N)- парциальное давление,m,n,a,b- коэф-ты. (8) P (A,B,M,N)- парциальное давление,m,n,a,b- коэф-ты. - равновесия. Ур-е закона действующих масс. - равновесия. Ур-е закона действующих масс.2)Без изменения числа молей.1) A+ B= C+ D 1 1 - - 1-  1- 1-     NA=  NB= NB= Nc= Nc=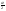 Nd= Nd=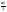 Pa= 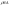 PB= PB= Pc= Pc= Nc PD= Nc PD= Kp= 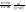 23) Влияние температуры на константу равновесия, вывод уравнения изобары Вант- Гоффа. Принцип Ле- Шателье. 1. Влияние температуры на равновесие. При повышении температуры системы, в которой возможна химическая реакция (системе, находящейся в равновесии, сообщается теплота), согласно принципу Ле Шателье-Брауна усиливается процесс, сопровождающийся поглощением теплоты, т.е. равновесие смещается в сторону эндотермической реакции.Качественные выводы о влиянии температуры на химическое равновесие могут быть получены из общего принципа смещения равновесия, сформулированного Ле-Шателье и Брауном. Этот принцип называется принципом подвижного равновесия: если на систему, находящуюся в устойчивом равновесии, оказывать воздействие извне, изменяя какое-нибудь из условий, определяющих положение равновесия, например, температуру, то в системе усилится то из направлений процесса, протекание которого ослабляет влияние произведенного воздействия. При равенстве энтальпийного и энтропийного факторов ΔН = ТΔS ΔG = 0, что является термодинамическим условием химического равновесия. Скорость реакции (число частиц образующихся в единицу времени в единице объема) в прямом направлении равна скорости реакции в обратном направлении. В этот момент концентрации исходных веществ и продуктов реакции не изменяются во времени и называются равновесными концентрациями. Они обозначаются символом вещества в квадратных скобках. Константа химического равновесия При равновесии химической реакции: bB + dD = lL + mM, где pp,L, ppM, pp,D, ppB –равновесные парциальные давления веществ, а [L], [M],[D],[B] –равновесные концентрации веществ; l, m, d, b - показатели степени, равные стехиометрическим коэффициентам. Из ур-я: Продифференцировав выражение (1) по температуре, получаем для зависимости константы равновесия от температуры уравнение (2) – изобару Вант-Гоффа: Это изобара равновесия. Она показывает, что константа равновесия экзотермической реакции уменьшается, а эндотермической реакции возрастает с повышением температуры. С увеличением абсолютного значения энтальпии реакции и уменьшением температуры чувствительность константы равновесия (d(lnKp)/dT) к изменению температуры повышается. 2)Характер смещения равновесия можно прогнозировать, применяя принцип французского ученого Ле Шателье: если на систему, находящуюся в равновесии, оказывается внешнее воздействие, то равновесие смещается в том направлении, которое ослабляет внешнее воздействие. Принцип Ле Шателье следует из закона действующих масс. Если система находится при постоянной температуре, то константа равновесия при внешних воздействиях остается постоянной. Поэтому любое изменение равновесных концентраций веществ должно приводить к такому изменению равновесных концентраций других веществ, чтобы соблюдалось постоянство константы равновесия. Рассмотрим процесс конверсии метана: CH4 + 2H2O = CO2 + 4H2, Константа равновесия этого процесса имеет вид: Кс = [CO2] [H2]4/[CH4] [H2O]2. 1)При увеличении концентрации метана СН4 равновесие системы нарушается, идет прямая реакция. Концентрации продуктов реакции СО2 и Н2 увеличиваются, а концентрации Н2О уменьшается. Процесс будет протекать до тех пор, пока не установится новое равновесие. Новые равновесные концентрации компонентов будут такими, что константа равновесия не изменится. Если увеличить концентрацию СО2, то по принципу Ле Шателье равновесие сместится влево. 2. Если в результате реакции изменяется число молей газообразных веществ, то изменяется общее давление в системе и происходит смещение равновесия. В соответствии с принципом Ле Шателье увеличение общего давления вызывает смещение равновесия в сторону уменьшения числа молей газообразных веществ, т.е. в сторону уменьшения давления. Для рассматриваемой реакции увеличение давления должно смещать равновесие влево (слева- 3 моля, справа – 5 молей). 3. С увеличением температуры равновесие смещается в сторону эндотермических реакций, т.е. реакций протекающих с поглощением теплоты, понижение – в сторону экзотермических реакций. Принцип Ле Шателье позволяет создавать такие условия протекания реакции, которые обеспечивают максимальный выход продуктов реакции. Зависимость константы равновесия реакции от температуры описывается уравнением Вант-Гоффа, называемом изобарой Вант-Гоффа: 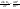 или или 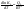 или изохорой Вант-Гоффа:  или или  . . Знак теплового эффекта определяется знаком производной 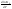 в уравнении изобары Вант-Гоффа. Поэтому: в уравнении изобары Вант-Гоффа. Поэтому:- если H0 0, т.е. химическая реакция протекает с поглощением тепла. Данная реакция эндотермическая; знак производной будет положительным. Следовательно, константа равновесия возрастает с увеличением температуры; - если H0 0, т.е. химическая реакция идет с выделением тепла; знак производной будет отрицательным. Следовательно, константа равновесия с увеличением температуры уменьшается; - если H0 = 0, химическая реакция идет без теплового эффекта, константа равновесия в данном случае не зависит от температуры. 24. Влияние температуры на константу равновесия, вывод ур-я изохоры Вант-Гоффа. Дать обоснование влияния температуры на химическое равновесие на основе анализа уравнения изохоры(изобары) Вант-Гоффа. 1. Влияние температуры на равновесие. При повышении температуры системы, в которой возможна химическая реакция (системе, находящейся в равновесии, сообщается теплота), согласно принципу Ле Шателье-Брауна усиливается процесс, сопровождающийся поглощением теплоты, т.е. равновесие смещается в сторону эндотермической реакции.Повышение либо понижение температуры означает приобретение либо потерю системой энергии и, следовательно, должно изменять величину константы равновесия. Для выявления зависимости константы равновесия от температуры продифференцируем уравнение изотермы химической реакции (1) по температуре: Отсюда: После сокращения получаем уравнение, называемое изохорой Вант-Гоффа: Изобара и изохора Вант-Гоффа связывают изменение константы химического равновесия с тепловым эффектом реакции в изобарных и изохорных условиях соответственно. Очевидно, что чем больше по абсолютной величине тепловой эффект химической реакции, тем сильнее влияет температура на величину константы равновесия. Если реакция не сопровождается тепловым эффектом, то константа равновесия не зависит от температуры. Экзотермические реакции: ΔH < 0 (> 0). В этом случае, если температурный коэффициент логарифма константы равновесия отрицателен. Повышение температуры уменьшает величину константы равновесия, т.е. смещает равновесие влево. Эндотермические реакции: ΔH > 0 (< 0). В этом случае температурный коэффициент логарифма константы равновесия положителен; повышение температуры увеличивает величину константы равновесия (смещает равновесие вправо). Схематические графики зависимостей константы равновесия от температуры для реакций с различным тепловым эффектом: 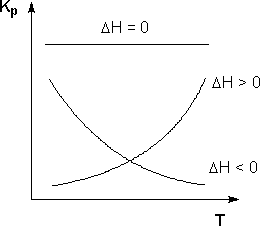 Зависимость константы равновесия от температуры. Зависимость константы равновесия от температуры.Чтобы рассчитать изменение константы равновесия при изменении температуры, уравнение изобары (изохоры) Вант-Гоффа необходимо проинтегрировать. Если принять, что тепловой эффект реакции не зависит от температуры, что обычно справедливо в достаточно узком интервале температур, то после определённого интегрирования (1) получаем: |
