Незаразные болезни. 1. Гнойнонекротические поражения дистального отдела конечностей. 5
 Скачать 5.28 Mb. Скачать 5.28 Mb.
|
|
Короткий новокаиновый блок осуществляется введением рас-тиора вокруг очага поражения по принципу инфильтрата, однако без высокой степени пропитывания тканей. Этот способ с большим эффектом применяется при локализованных воспалительных процессах. К новокаиновому раствору рационально добавлять пенициллин из расчета 1500—2000 ЕД на 1 кг веса животного. Такое сочетание средств в ранний период течения гнойной инфекции дает возможность купировать воспалительный процесс. Циркулярный новокаиновый блок практикуют на конечностях при локализации воспалительных процессов в их дистальных отделах. Раствором новокаина пропитывают все ткани, включая надкостницу, по всей окружности конечности; особенно тщательно инфильтрируют клетчатку фасциальных футляров, где проходят fосновные сосудистые и нервные стволы. Методически правильно это удается выполнить у крупных животных в областях пальца, 1ясти, плюсны, нижней половины предплечья и голени при расходе 150—250 мл раствора. Вводят его из 3—4 уколов через гонкую длинную иглу. Шейная ваго-симпатическая блокада применяется при воспалении легких и повреждениях, угрожающих развитием шока (проникагощио ранения груди, операции на органах грудной полости и др.). И практике эту блокаду используют с одновременным выключением каротидного синуса, когда раствор новокаина, распространяясь периартериально, достигает ветвления сонной артерии. Рациональна также блокада каудальнвго шейного симпатического узла. Обоснования способа представлены А. Д. Сперанским и его учениками, доказавшими ведущее значение нервно-дистрофических расстройств в патогенезе пневмонии. Паранефральная (поясничная) новокаиновая блокада в настоящее время широко используется при желудочно-кишечных заболеваниях, характеризующихся спазматическими сокращениями, при воспалительных процессах брюшины, органов брюшной и тазовой полостей, при процессах в различных отделах тела, возникающих вследствие трофических нарушений (язвы, свищи), при различных острых воспалительных процессах покровов тела и глубоких тканей. В обоснование этого способа А. В. Вишневский писал: «Мы рассчитывали получить эффект как благодаря феномену выключения наибольшего количества связей между центром и периферией, так и на путях общей регуляторной функции нервной системы в связи с тем «раздражением», которое представляет собой анестезия как активный процесс. Поясничную область с обильными скоплениями больших нервных узлов и стволовых проводников мы рассматриваем, как особо подходящую для этой цели». 0,25%-ный раствор новокаина вводят в околопочечную жировую клетчатку из расчета 1 мл на 1 кг веса животного. В таком количестве он широко инфильтрирует рыхлую паранефральную подушку, клетчатку смежных участков, лежащие здесь нервные сплетения и их коммуникации. Экспериментальные и клиническж данные свидетельствуют о большей эффективности одновременно^ двусторонней блокады. Повторное введение раствора новокаина назначают на 4—5-й день. Новокаиновая блокада чревных нервов и пограничных симпатических стволов успешно применяется как метод профилактики перитонита при травматических повреждениях органов брюшной полости, в том числе при операциях, а также с лечебной целью, когда явления перитонита уже существуют (В. В. Мосин). К числу основных способов терапии при гнойной инфекции относят разрез. Разрезом достигают удаление гноя и содержащихся в нем токсических веществ, скопляющихся в тканях; ослабление давления в очаге воспаления и уменьшение болезнен ности; расслабление тканей и улучшение крово- и лимфообраще ния в зоне поражения. Эти факторы составляют основу патогенетической терапии при любой инфильтрации тканей и формиро вании полостей с гнойным эксудатом. Относительно времени разреза при гнойной инфекции в прош лом господствовал известный консерватизм: хирурги выжидали «созревания» очага нагноения, то есть образования полости, отгра- именной гранулирующей стенкой. Этот процесс ускоряли геп-опыми процедурами; с появлением флуктуации делали разрез. дкой подход связан с неизбежностью лихорадки в течение всего гриода активного состояния инфекции, с угрозой распростране-и и микробов за пределы первичного очага поражения, развития имфангита, тромбофлебита, воспаления в смежных органах и олостях, сепсиса. Если тепло-влажные укутывания, катаплазмы, спиртовые компрессы, новокаиновая блокада не дают положительных результатов (рассасывание инфильтратов), то ограничить распад тканей, редотвратить образование обширных гнойных полостей и добиться ыздоровления в короткий срок можно только ранним разрезом. После одного широкого или нескольких меньших разрезов всегда получаются более ограниченные разрушения тканей, чем тот естественный распад их, который наступает при самопроизвольном прорыве гноя наружу. Важно и то, что при раннем оперативном вмешательстве можно выбирать доступ, наиболее рациональный и топографоанатомическом отношении. В поздние же периоды нагноения разрез, как правило, делают в соответствии с направлением того пути из глубины наружу, который возник в процессе естественного разрушения тканей. Послеоперационное лечение при гнойной инфекции основы-иается на тех же предпосылках, что и при инфицированных ранах (см. выше) и нередко требует применения дренажей и рых-ii ых тампонов. Из числа внешних факторов, осложняющих течение гнойной инфекции, особенно пагубно действуют температурные колебания. Нервные окончания, находящиеся в состоянии повышенной чувствительности, воспринимают охлаждение как дополнительный. Сильный раздражитель. Этим усугубляются расстройства центральной нервной системы, порожденные инфекцией, и ухудшается состояние в очаге поражения: снижается активность противомикробной защиты организма, усиливается протеолиз тканей, нарастает агрессивность инфекционного начала. В качестве меры, способной ограничить большие колебания температуры в воспаленном очаге, служит сухая асептическая повязка с достаточным слоем ваты. Роль ее в первый период заболевания, до образования грануляционного барьера в окружности фокуса нагноения, особенно важна. Значение повязки после разреза такое же, как и в терапии при ранениях. В терапии при гнойной инфекции в профилактике ее осложнений можно рационально использовать тканевые препараты. От парэнтерального введения их усиливается иммунобиологическая реактивность организма с активированием фагоцитарных реакций нейтрофилов, с увеличением количества гемоглобина, эритроцитов, лейкоцитов. Вполне обоснованно добавление к тканевой взвеси 5% очищенного скипидара (И. М. Голосов, М. И. Кли-мошов). Таковы принципы лечения при гнойной инфекции. Естественно, что в каждом случае оно зависит от локализации процесса, его особенностей и сопутствующих осложнений. Часто требуется усиленное полноценное кормление. Элементы терапии к отдельным группам гнойных процессов приводятся при их описании (см. ниже). АНТИБИОТИКОТЕРАПИЯ Основные данные о природе антибиотиков, о методах их получения, о показаниях к применению, о токсичности и т. п. приведены в фармакологии. В курсе общей хирургии требуют упоминания данные, особо важные в борьбе с гнойной инфекцией. Начало антибиотикотерапии положено в 1939—1940 гг. применением тиротрицина в лечении ран, ожогов и других хирургических процессов. Этот препарат (смесь некоторых полипептидов) оказался действенным в отношении грамгтоложнтельной микрофлоры. Широкие пути к применению анти-биотикои были открыты установлением высокой эффективности пенициллина (1940—1941). И в настоящее время местные гнойные процессы, пневмония, общая гнойная инфекция и многие другие заболевания, вызываемые главным образом грамположительными микробами, курируются с использованием пенициллина. Последующий важный этан в учении об антибиотиках — открытие препаратов широкого спектра действия: левомицетин, биомицин, террамицин, тетрациклин и многие другие. Далее были выяснены возможности использовать в действии антибиотиков синергизм: комбинирование этих средств с вакцинами, гормонами, витаминами, с новокаиновой блокадой, что позволяет уменьшить дозу каждого препарата и ослабить их побочное действие. Более сложной оказалась задача выяснить механизм действия самих антибиотиков. В этом направлении частично изучены только отдельные вещества. Известно, что пенициллин поглощается микробными клетками в очень небольшом количестве, независимо от концентрации его в окружающей среде. Достаточно обоснованно также суждение о роди в этом процессе «пенициллин-связывающего компонента» микробной клетки. Таковым является липоидный слой, лежащий под ее оболочкой. Когда концентрация препарата в нем достигает предела (становится оптимальной), в микробной клетке снижается окислительно-восстановительный потенциал, она набухает, теряет жизнеспособность и лизируется. В практическом отношении весьма важно знать, что пенициллин в очень малых концентрациях стимулирует развитие микробов: сульфгидрилыше соединения, в частности цистеин, ослабляют его действие. В отношении стрептомицина установлено, что он поглощается микробными клетками в зависимости от концентрации в окружающей среде, но также в небольшом количестве и весьма медленно. При более или менее длительном воздействии этого препарата микробы становятся неспособными к размножению даже после полного выведения его из организма. Следовательно, обусловленное стрептомицином нарушение в микробных клетках окислительных процессов и обмена нуклеиновых кислот сопровождается бактериостатическим и бактерицидным действием. В последнее время выяснены некоторые особенности антимикробных механизмов левомицетина. Он не нарушает функций амилаз, оксидаз, дегид-раз и других ферментов; его действие, сказываясь весьма мало на синтезе полисахаридов и неуклеиновых кислот, выражение угнетар синтез белков, глюкошшазы, пенициллиназы. Подобное свойственно также антибиотикам тетрациклиновой группы: Антибиотики, подавляя жизнеспособность микробов, способствуют фагоцитозу; например, обработанные антибиотиками стрептококки, стафилококки поглощаются клетками организма во много раз интенсивнее но сравнению с контрольными культурами. При использовании антибиотиков, кроме прямого антимикробного действия, необходимо учитывать их влияние на сам организм: при воздействии их повышаются окислительные процессы, усиливается обмен веществ в организме. Большинство исследователей, учитывая нарастание поглотительной способности ретикулоэндотелиальной системы после внодония антибиотиков, а также эффект сочетанного применения вакцин и антибиотических веществ, приходят к выводу, что антибиотики обладают свойством стимулировать иммуногенез. Следует также иметь в виду, что длительное применение антибиотиков нередко осложняется выраженными нарушениями в организме: при пенициллинотерапии повышается температура тела, припухают лимфоузлы и суставы, от синтомицина и левомицетина развивается анемия, от стрептомицина угнетается функция слухового нерва; от биомицина нарушается пищеварение и снижается содержание витамина С. Кроме того, необходимо учитывать изменения свойств гноеродной микрофлоры от чрезмерно широкого и бессистемного использования антибиотиков. В результате в сравнительно короткое время нарастает количество микробов, устойчивых к антибиотикам. Появляются штаммы стафилококков, устойчивых к пенициллину, стрептомицину, биомицину, террамицину. Поэтому нужно исследовать микрофлору каждого очага поражения на чувствительность к определенным антибиотикам. В хирургической практике необходимо учитывать нолиморфностг, (наличие грамположительной и грамотрицателышй) микрофлоры. В развитии и течении гнойной инфекции обычно участвуют в различных сочетаниях стафилококки, стрептококки, кишечная палочка, диплококки и др. Этим предопределяется рациональность сочетанного применения антибиотиков-синергнетов, например, пенициллина и стрептомицина. Недостаточно выраженный в течение первых двух суток эффект данной смеси требует введения тетрациклина или других антибиотиков. Выбор представляется более сложным, если микрофлора гнойного очага устойчива к нескольким антибиотикам. В таком случае рационально назначать нужный препарат в больших дозах, а также вводить его внутривенно или внут-риартериально. Последнее имеет существенные преимущества перед непосредственным введением антибиотиков в очаг поражения. Эффективность препаратов усиливается с одновременным применением ферментных средств, снижающих вязкость гнойного эксудата (стрептокиназа — из фильтратов гемолитического стрептококка, плазмин). АНАЭРОБНАЯ И ГНИЛОСТНАЯ ИНФЕКЦИЯ АНАЭРОБНАЯ ИНФЕКЦИЯ Возбудители. Анаэробная инфекция относится к числу чрезвычайно тяжелых осложнений ран. Среди возбудителей, обусловливающих ее развитие, важное место занимает так называемая группа четырех (А. В. Мельников): Clostridium perfringens, Cl. oedematiens, Cl. hislolylinirn, CI. septicum, а также Cl. sordelli, Cl. falhiK, Cl. carnis и др. Исследования М. Р. Нечаевской (1951) дают основания причислить сюда же Бас. gaugraenae rubrae. В ассоциации с упомянутыми микробами при анаэробной инфекции часто встречаются представители гнилостной анаэробной группы Str. anaeurobius, Str. putridus, Str. parvus, B. proteus vulgare), гноеродные микробы, некробациллы, сапрофиты. Взаимовлияние микробов в ассоциациях часто сказывается усилением Патогенного действия основного возбудителя процесса. В качестве иллюстрации можно привести значительное нарастание патогенности Cl. perfringens в ассоциации с гноеродными стрептококками и стафилококками, с сенной палочкой, сарцинами. Способность проникать в глубину тканей особенно выражена yCl. perfringens вследствие выделения им гиалуронидазы. Наряду с' большой силой токсинообразования он обладает сахаролитиче-скими, гемолитическими и некротизирующими свойствами с образованием газов. Несколько медленнее вырабатывают токсины другие представители патогенных анаэробов. Cl. oedematiens свойственно развитие отека в клетчатке, в мышцах с гемолизом и распадом тканей без образования газов. Также отсутствуют газы при развитии в тканях Cl. histolyticum. Его чрезвычайно сильные некротизи-рующие свойства обусловлены образованием фибринолизина. Этот фермент расплавляет тк*ани в отсутствие или при ограниченной степени отека. Cl. septicum в сопоставлении с Cl. perfringens обладает меньшей способностью газообразования. Силы его саха-ролитических и гемолитических ферментов, некротизирующее действие и токсичность продуктов жизнедеятельности очень велики. Патогенные анаэробы — постоянные обитатели кишечника животных и человека. В природе они распространены повсеместно. Особенно много их в земле, загрязненной калом животных и человека, в почве, богатой органическими удобрениями, в помещениях для животных^ на покровах тела. Высокая устойчивость 188 анаэробов к температурным колебаниям воздуха, высыханию, действию солнечных лучей обусловлена их спорообразованием. Условия, способствующие развитию анаэробов в тканях. При случайных ранениях почти неизбежно попадание на поверхность травмированных тканей анаэробных микробов, в том числе и высоковирулеитшлх. В связи с этим заслуживает внимания тот факт, что развитие анаэробной инфекции по сравнению с гнойной наблюдается относительно редко. Для ее возникновения требуются несколько особые условия, в первую очередь наличие тканевой среды, лишенной доступа кислорода. В этом отношении первостепенное значение имеет травмирование тканей. В участках размозжения, простирающихся далеко от раневого края, где ткани представлены нежизнеспособной массой, микробы, в том числе и анаэробы, размножаются беспрепятственно. Здесь исключены мобилизация защитных сил организма и противодействие их инфекту непосредственно в месте его инокуляции. Вместе с тем именно в участках омертвения тканей существуют все условия для успешного размножения микробов, наращивания их вирулентности и накопления токсинов. Особую угрозу таят в себе ранения, сопровождающиеся раздроблением костей. Обломки последних, погружаясь вглубь, разрушают ткани и усугубляют травмирование их. Возбудители анаэробной инфекции находят также благоприятные для себя условия в сгустках крови, скопляющихся в раневом канале и в межтканевых карманах. Важным фактором, облегчающим развитие и распространение анаэробной инфекции, является повреждение крупных сосудистых стволов в области ранения. При этом вследствие недостаточного кровоснабжения или затрудненного оттока крови и лимфы жизнеспособность тканей одновременно подавляется на большом протяжении. Условия анаэробиоза неизбежно возникают при ранениях, сопровождающихся образованием узких каналов, проникающих на большую глубину в мягкие ткани. Такие каналы, как правило, во многих местах перекрыты об-ломкамн тканей, фасциями, смещающимися после ранения, апоневрозами и мышечными пластами. Этим исключается доступ воздуха в глубокие отделы раны, где обычно скопляются сгустки крови, служащие при таких обстоятельствах бескислородной питательной средой для микробов. К категории повреждений, нередко осложняющихся анаэробной инфекцией, относятся колотые раны, нанесенные вилами, употребляемыми для уборки навоза, загрязненными гвоздями и другими предметами. Случаи анаэробной инфекции подкожной клетчатки шеи и подгрудка наблюдаются в месте угола иглой, при погрешностях введения (пользование загрязненными иглами и шприцами) вакцин и лечебных препаратов. В широкозияющих ранах условия, исключающие свободный доступ воздуха в глубокие участки полости, создаются при грубом тампонировании, когда q силой продвигаются и туго спрессовываются комки ваты или марли. При этом анаэробиоз в тканях усугубляется вследствие сдавливания сосудов в области ранения и в смежных участках. Особенно благоприятна для анаэробов среда в размозженных ранах, проникающих в толщу рыхлых мышечных пластов. Здесь, как это отмечают многие авторы, гликоген мышц служит для анаэробов специфическим элементом питания Именно мышечная ткань под воздействием грубого травмирования больше всего разрушается, превращаясь в кашицу, смешанную с кровью. Помимо всего, повреждение мышц рефлекторно влечет за собой длительное спастическое сокращение их. Такое состояние сопряжено с нарушением крово-и лимфообращения и накоплением продуктов обмена в тканях, непосредственно прилегающих к очагу травмы и удаленных от него. Степень травмирования тканей возрастает, если в ране остаются инородные тела: обломки дерева, комки шерсти, полностью отделившиеся обломки кости, осколки снарядов, пули. Инфекция обычно гнездится в тканях, окружающих инородное тело, а при инкапсулировании его часто остается в дремлющем состоянии. Развитию анаэробной инфекции благоприятствуют возбудители гноеродной группы. Размножаясь в травмированных тканях и п их 199 окружности, omr поглощают кислород и тем самым усугубляют состояние анаэробшмл. Охарактеризованные анатомо-физиологические условия наиболее полно продстанлопы при ранениях с обширными разрушениями тканей в области крупи, бедра, лопатки, шеи. Реже это заболевание возникает в других участках тола, где менее массивны пласты мускулатуры и клетчатки. Ткани боковой грудной стенки, спины, черепа, диетальных отделов конечностей относительно часто поражаются анаэробной инфекцией, когда ранение сопровождается многооскольчатыми переломами костей. В области брюшной стенки и в брюшной полости анаэробная инфекция — редкое осложнение. Объясняется это тем, что здесь особую роль играет кишечная палочка: она является антагонистом Cl. perfringens как к основному представителю группы патогенных анаэробов. Классификация. Процессам, относящимся к анаэробной инфекции, в доантисептический период присваивали названия: госпитальная гангрена, газовый отек, газово-гангренозный сепсис. Эти определения не соответствуют современным представлениям о патогенезе и клинике заболевания; в настоящее время о них упоминают, излагая этапы развития учения о раневой инфекции. Наиболее правильно отображают сущность патологического процесса два названия — анаэробная флегмона и анаэробная гангрена. Среди множества случаев с различной степенью проявления отдельных симптомов в практике выделяют три основные формы анаэробной инфекции: эмфизематозную (газовую), отечную и смешанную, когда основные симптомы (скопление газов в тканях и отек их) развиваются одновременно. По тяжести заболевания (в зависимости от глубины локализации очага поражения) многие авторы различают более легкую — эпифасциальную и тяжелую — субфасциаль-н у ю, а по течению — молниеносную и развивающуюся более медленно — острую форму анаэробной инфекции. Течение и диагностика. В небольшом числе случаев признаки анаэробной инфекции проявляются уже на протяжении первых суток после ранения; обычно же инкубационный период длится от 2 до 5 дней. Иногда анаэробная инфекция возникает через несколько недель и даже месяцев после заживления раны. Развитие процесса, характер тканевых изменений при нем, степень интоксикации организма зависят от тяжести травмирования тканей, состояния больного животного и патогенности инфекционного начала. При одновидовой анаэробной инфекции процесс протекает легче, чем при воздействии ассоциации двух анаэробов или анаэробов с аэробами. Сочетание анаэробов с несколькими представителями гноеродных микробов делает заболевание особенно тяжелым. В начале анаэробной инфекции возникают сильные боли, которые в дальнейшем уменьшаются. ^Иногда в очаге поражения, захватывающем обширный участок, понижается чувствительность вследствие угнетения функции нервных окончаний и ухудшения проводимости нервных стволов в связи с состоянием, аналогичным парабиозу. Отек тканей — постоянный симптом анаэробной инфекции. Он быстро распространяется, захватывая па далеком расстоянии от раны подкожную, межмышечную, перинаскулярную, перине-вральную клетчатку, мышцы и другие мягкие ткани. При анаэробной инфекции в тканях часто скапливаются газы. Начало газообразования нередко отмечается уже в течение первых суток после ранения. Об этом свидетельствуют рентгенологические данные. Обычным клиническим исследованием этот важнейший симптом вспышки анаэробной инфекции определяется позже, когда пузырьки газа проникают в более поверхностные слои клетчатки. Здесь пальпаторпо легко обнаружить крепитацию, тимпаыический звук при перкуссии и сбривании волос («симптом бритвы»). Пигментированная кожа животных не представляет каких-либо характерных изменений, за исключением отека и значительного напряжения. Эти явления хорошо выражены при эмфизематозной, отечной и смешанной формах анаэробной инфекции. На непигментированпой коже отмечают побледнение, просвечивание расширенных подкожных вей сине-багровые и голубоватые пятна. Температура тканей в участке поражения повышена только в начальной стадии анаэробного процесса. В дальнейшем покровы тела в окружности раны и на значительном отдалении от нее при бурно развивающейся эмфизематозной форме на ощупь представляются похолодевшими. Такое состояние обусловлено тромбозом кровеносных сосудов, сдавливанием их разбухшими тканями. Характерно «безжизненное» состояние тканей в ране. Они имеют пепельный, зеленоватый цвет, слизисты. Присущие воспалительному процессу клеточная инфильтрация тканей, а в дальнейшем пролиферация отсутствуют. Подобное состояние раны — признак того, что при анаэробной инфекции организм лишен способности эффективно противопоставить инфекту свои защитные приспособления. Обильное отделяемое раны содержит много пигментов крови и по цвету, а также по консистенции напоминает мясные помои. Осс»бенностыо его является, кроме того, неприятный запах. Эти свойства раневого отделяемого мало изменяются в течение всего периода активной жизнедеятельности анаэробов. В начальной стадии заболевания, как и при гнойной инфекции, наблюдается повышение температуры тела, учащение пульса и дыхания, угнетенное состояние. В дальнейшем с углублением интоксикации частота пульса нарастает, между тем как температура тела остается мало повышенной. В случае особенно тяжелой анаэробной инфекции животное бывает несколько возбуждено. Оно охотно принимает корм и по виду не кажется тяжелобольным, тогда как прогрессирующее падение кровяного давления, учащение и ослабление пульса дают все основания предвидеть неизбежную гибель, мышечной области при анаэробной инфекции  . Обычно смерть наступает при явлениях токсического шока. Нередко животные гибнут по дороге в лечебницу, так как громадные количества токсинов, скопляющихся в очаге поражения, при движении поступают в кровеносное русло и вызывают угнетение центральной нервной системы. Способствуют развитию шока анемия, истощение и обезвоживание организма, развивающиеся в короткое время течения этого грозного заболевания. В более поздний период иногда возникает септицемия. Анаэробная инфекция в области гортани влечет за собой острый отек ее и смерть животного Рис. 65. Некроз кожи в под- вследствие асфиксии. Патологоанатомические изменения. Картина очаговых патологоанатомиче-ских изменений при анаэробной инфекции выражается главным образом омертвением тканей. Подкожная клетчатка и глубокие ее слои разбухают на большом расстоянии от места ранения. Особенно далеко простирается отек клетчатки в окружности сосудистых и нервных стволов. Она приобретает желтый или розовато-красный цвет, усеяна оранжевыми пятнами, местами расплавлена. Мышечная ткань при эмфизематозной форме анаэробной инфекции аспидно-серого цвета, при отечной — розовато-красного. Она хрупка и легко разрывается, раздавливается пальцами. При разрывах тканей и сдавливании их выделяется красноватая, а при эмфизематозной форме — пенистая жидкость. Мелкие и более крупные вены, а также многие артерии малого калибра затромбированы. Более длительное время остаются проходимыми в толще омертвевающих тканей только крупные артериальные стволы, если они не были травмированы при ранении. В числе многих факторов, обусловливающих тромбоз сосудов, главнейшим является сенсибилизация организма огромным количеством продуктов распада тканей и токсических веществ микробного происхождения, поступающих из очага поражения; повышение свертываемости крови с изменениями ее химизма способствует тромбированию. Лимфатические сосуды зоны отека переполнены лимфой. Редко наблюдаются поражения регионарных лимфатических узлов. При анаэробной инфекции с эпифасциальным распространением процесса часто некротизируется кожа, особенно в областях тела, где рыхлая соединительная ткань представлена массивным пластом и при движении животного ткани смещаются в широких границах (рис. 65). . 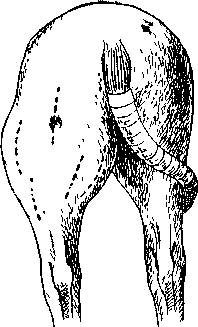 Рис. 66. Схема разрезов при анаэробной инфекции. У свиней сравнительно часто наблюдают отечную форму с высокой смертностью у жирных животных. Прогноз. В начальных стадиях анаэробной флегмоны, когда еще отсутствует прогрессирующее падение кровяного давления, прогноз сомнительный. При выраженных симптомах и быстром их нарастании прогноз остается таким же только при поражении конечностей у мелких животных: гибель собак и кошек удается предотвратить,'если ампутация проводится в порядке срочной операции, при необходимости с отчленением бедра, удалением лопатки. У крупных животных бурное течение заболевания в областях тела, мало доступных хирургическому вмешательству, относится к группе процессов с неблагоприятным прогнозом. Весьма достоверным признаком выздоровления служит уменьшение отека тканой с одновременным появлением более густого эксудата и изменением его цвета из кровянистого в беловатый. Последнее свидетельствует о достаточной мобилизации защитных сил организма. «Зарей выздоровления» считают появление большого количества лейкоцитов в очаге поражения, а также увеличение количества их в крови вместо лейкопении, обычной спутницы анаэробной инфекции. Профилактика. Мероприятия, предпринимаемые с целью предотвратить развитие анаэробной инфекции, должны быть направлены на подавление жизнедеятельности возбудителей анаэробной и одновременно гноеродной групп. Важнейшее из них — своевременная, тщательно выполненная первичная хирургическая обработка. Основные ее элементы, как иссечение травмированных тканей, рассечение перемычек, устранение карманов, удаление сгустков крови, должны осуществляться с должпрй последовательностью при самом бережном отношении к тканям. Раны с узкими каналами необходимо дренировать под контролем глаза. Лечение. При анаэробной флегмоне необходимо широко вскрыть очаг инфекции и пути ее распространения. Редко можно ограни-<ь* литься одним разрезом. Нужна система их, открывающая свободный доступ к основному фокусу с прилежащими карманами в межмышечных промежутках, а также к периваскулярным и перине-вральным пространствам области поражения. Дополнительные разрезы делают во всей области распространения отека (рис. 66) на всю его глубину. Осложнение раш,[ анаэробной инфекцией противопоказует наложению швов. Выходом из такой операции являетсч прокладка на всю глубину раны и во всех углублениях ее полости рыхлого марлевого дренажа после тщательного ^припудривания тканей порошком противомикробных веществ. Целесообразно также дренирование марлей, пропитанной скипидаром, смесью его с растительным маслом в соотношении 1:1. В послеоперационный период применяют камфару, кофеин, раствор глюкозы, физиологический раствор, уротропин, сульфаниламиды, антибиотики, как при тяжелой раневой инфекции. (Не следует применять стрептомицин, Cl. perfringens к нему весьма устойчив). Специфическая профилактика и терапия, достигаемые введением смеси сыворотки против четырех основных представителей анаэробной инфекции, используются в качестве дополнительного к оперативному вмешательству способа воздействия. По данным медицинских авторов, к весьма оффоктивньш вспомогательным приемам терапии относится лечение анаэробным бактериофагом. Его можно вводить с тампоном в раневую полость, внутритканно в окружности очага поражения, внутривенно. (Антисептические вещества, за исключением сульфаниламидов, уничтожают бактериофаг, и поэтому одновременно использовать их нельзя.) В ветеринарной практике оба эти способа терапии широкого распространения до настоящего времени не получили. ГНИЛОСТНАЯ (ПУТРИДНАЯ) ИНФЕКЦИЯ Гнилостная инфекция — полимикробное заболевание, характеризующееся распадом тканей с образованием зловонного эксудата. Запах его в помещении, где находится больное животное, чувствуется на расстоянии. Такому эксудату издревле присвоено название ихор. В числе газообразных веществ, образующихся при расщеплении белков в процессе гниения, имеется значительное количество дурнопахнущих, как сероводород, метилмеркаптан, индол, аммиак. В многочисленной группе микробов, участвующих в развитии гнилостной инфекции, первое место занимают анаэробы: Cl. sporo-genes, Cl. putrificum, Cl. tertium, Str. anaerobius, B. aerofoetidus.) Важное значение имеют и гнилостные аэробы: В. proteus vulgare, В. coli commune, Str. faecalis, В. pyocyaneum faecale, Micr. foe-tidus) и др. Представителей обеих этих групп находят в ранах в самых разнообразных ассоциациях. Они лишены способности проникать в жизнеспособные ткани и успешно размножаются в тканях, размозженных, находящихся в состоянии некробиоза, омертвевающих вследствие ущемления. Обычно гнилостная инфекция сопутствует анаэробной и гнойной инфекции. При ранениях гнилостный распад чаще наблюдают в тканях, пораженных анаэробной инфекцией. В качестве первичного процесса в свежих: ранах гнилостная инфекция относительно часто встречается у крупного рогатого скота. У хряков она нередко развивается как осложнение после кастрации. Большинство представителей гнилостной микрофлоры не вырабатывает токсинов. Их патогенное действие обусловлено значительной ферментативной способностью расщеплять белки тканей с обраюванием алкалоидов гниения — птомаинов (тирамин, гиста-мин, путресцин, кадаверин, фенилэтил'амин и др.). Эта группа метилированных, так называемых биогенных аминов при всасывании из раневой полости или другого очага тканевого распада может вызывать сильную интоксикацию организма, сопровождающуюся иногда тяжелыми расстройствами сердечно-сосудистого аппарата и нервной системы, характерными для шока. Гнилостные микробы экзогенно попадают в раны, в ткани отмороженных участков тела, в свищевые каналы. Встречая при этом в глубоко лежащих участках тела соответствующие условия (мертвые ткани), гнилостные микробы быстро размножаются и изменяют течение первоначального процесса. Инфицирование часто происходит со слизистых оболочек. Открытые в полость рта переломы челюстей, эксудативные перио-дош.ты, пульпиты, как правило, осложняются гнилостной инфекцией. Из полости глотки и пищевода при ранениях часто загрязняются глубокие ткани шеи, что также завершается гнилостной инфекцией. Это заболевание почти неизбежно наступает при попадании кишечного содержимого в участки грубого травмирования тканей брюшной стенки, тазовой полости и паховой области. Абсцессы со зловонным эксудатом иногда появляются в местах онтероцентеза. Примером эндогенной гнилостной инфекции является поражение петли кишки и тканей стенки грыжевого мешка при ущемлении. Течение и диагностика. В течение гнилостной инфекции отмечают некоторые особенности, зависящие от характера предшествующих ей тканевых изменений и состояния организма. В ранах, осложненных анаэробной инфекцией, присоединение и начало деятельности гнилостных микробов трудно уловимы. Только появление ихорозного запаха, обнаружение в нем большого количества бесструктурных, крупных и мелких обломков тканей дает основания утверждать, что углубляющийся распад связан с гнилостным процессом. В организме, ослабленном анаэробной инфекцией, такое осложнение ведет к быстро нарастающей интоксикации. Если гнилостная инфекция сочетается с гнойной, захватывающей мягкие ткани области ранения на значительном поражении, заболевание также приобретает угрожающее течение. Клетчатка, фасции, сухожильная и мышечная ткань превращаются в бесструктурную, грязно-зелеповатую или коричневую массу, пропитанную ихорозным эксудатом. При этом почти неизбежен гнилостный распад сосудистых стволов, встречающихся на пути распространения инфекции. Громаднейшее большинство аррозион-ных кровотечений из крупных вен и артерий обусловливается влиянием гнилостных микробов. Необходимо оттенить, что такое поражение кровеносных сосудов отмечают, как правило, в местах, где они проникают в эмиссарии мощных фасций и апоневрозов. Если гнилостная инфекция возникает в свежей ране первично, признаки осложнения, характерные для этого процесса, выри-совынаются и более поздние сроки, чем при анаэробной или гнойной инфекции. К 4—5-му дню появляется в большом количестве зловонный жидкий буроватого оттенка эксудат с примесью рыхлых, дегтеобразных комков свернувшейся крови и распадающихся тканей. За несколько дней раневое отделяемое изменяется лишь в том отношении, что в нем увеличивается примесь комков разложившихся тканей. Особенностью такой раны является угнетение гранулирования при отсутствии выраженного отека тканей в окружности очага поражения. Такое состояние свидетельствует о глубоком ослаблении защитных приспособлений организма в связи с интоксикацией. Причинами осложнения процесса в гранулирующих ранах служат чрезмерное давление повязки, травмирование при движении животного, повторные разрушения грануляций вследствие прижатия к полу области поражения во время лежания и т. п. В закрытых очагах ограниченных размеров заболевание протекает в сравнительно легкой форме. Здесь образуется по типу абсцесса полость, наполненная жидким буроватым зловонным эксудатом с обломками погибших тканей, иногда с газами. Пролежни, когда они обусловливаются кратковременным (несколько дней) вынужденным лежанием животного на жестком полу или давлением сбруи в ^области спины и заднего склона холки, также обычно осложняются относительно легко протекающей гнилостной инфекцией. Наоборот, пролежни у ослабленных, анемичных, особенно у септических больных характеризуются бурно прогрессирующим гнилостным распадом тканей. Гнилостная инфекция постоянно сопровождается лимфангитами и лимфонодулитами. С, ее развитием температура тела значительно повышается и устойчиво держится на подъеме в течение всего периода распада тканей. Серьезные нарушения отмечаются в сердечно-сосудистой системе: глухость сердечных тонов, резкое учащение и ослабление (мягкость) пульса, аритмия. Бросающееся в глаза несоответствие между большой частотой пульса и температурой тела — неблагоприятный признак. У таких больных часто обнаруживается гнилостная гангрена легких. При гнилостной инфекции уменьшается мочеотделение. Бурный распад тканей вызывает индиканурию. Тяжелому течению гнилостной инфекции присущи нарастающая гипопротеинемия и значительная потеря тканевой жидкости. Животное быстро худеет. Кожа у него сухая и, будучи собранной в складку, пяло расправляется. Больные с такими явлениями отказываются от корма и неохотно пьют. Большинство их погибает от пневмонии или сепсиса. Лечение. Очаг инфекции вскрывают широким разрезом. Омертвевшие ткани тщательно удаляют. Рану рыхло дренируют полосами марли, как при анаэробной инфекции. При поражении костной ткани (гнилостный распад остистых отростков, отломанных бугров костей таза, бедра и пр.), когда секвестры трудно отделимы без грубо травмирующего вмешательства, целесообразно ограничиться перечисленными мероприятиями, направленными к устранению прогрессированпя гнилостной инфекции. В последующем, с улучшением состояния животного и укреплением грануляционного барьера участки омертвевшей костной ткани удаляют с меньшим риском вызвать септические осложнения, чем первоначально. В течение гнилостной инфекции, а также в послеоперационный период применяют средства общей противосептической терапии: сульфаниламиды, антибиотики, уротропин. Физиологический раствор, глюкозу, камфару, кофеин вводят повторно до устойчивого улучшения состояния больного животного. |
