1. Образование антибиотиков в естественных и лабораторных условиях. Вещества предшественники для биосинтеза антибиотиков
 Скачать 0.99 Mb. Скачать 0.99 Mb.
|
|
14. Лантибиотики, их характеристика и биосинтез.     16.Противоопухолевые антибиотики Первый противоопухолевый антибиотик - дактиномицин - был получен в 1963 году. В последующем скрининг продуктов жизнедеятельности микробов привел к открытию целого ряда эффективных химиотерапевтических противоопухолевых препаратов, являющихся продуктами разных видов почвенных грибов или их синтетическими производными. В настоящее время из противоопухолевых антибиотиков наибольшее практическое применение имеют антрациклины (антрахиноновые соединения), блеомицин, относящийся к флеомицинам, дактиномицин, являющийся актиномицином, и митомицин - своеобразный антибиотик с алкилирующим механизмом действия. Антрациклиновые антибиотики (даунорубицин, доксорубицин, идарубицин, карубицин и эпирубицин) относятся к наиболее эффективным противоопухолевым средствам. Структурной основой антрациклиновых противоопухолевых антибиотиков является тетрагидротетраценхиноновый хромофор, состоящий из шестичленного алифатического и трех ароматических колец. В химическом отношении они отличаются друг от друга заместителями в хромофоре и наличием сахарных остатков. Механизм цитотоксического действия антрациклиновых антибиотиков связан, главным образом, с ингибированием синтеза нуклеиновых кислот путем интеркаляции между парами азотистых оснований, нарушением вторичной спирализации ДНК за счет взаимодействия с топоизомеразой II, а также связыванием с липидами клеточных мембран, сопровождающимся изменением транспорта ионов и клеточных функций. Такой механизм обусловливает высокую антимитотическую активность при низкой избирательности действия. Антрациклиновые антибиотики оказывают также иммунодепрессивное (миелосупрессивное) и антибактериальное действие, однако в качестве антимикробных средств не применяются. Антрациклиновые противоопухолевые антибиотики применяют при многих злокачественных новообразованиях - различных гематологических видах рака, саркомах мягких тканей, карциномах и других солидных опухолях. Спектр показаний к применению конкретного антибиотика определяется его химическим строением, индивидуальными фармакокинетическими и фармакодинамическими свойствами и степенью его изученности. Помимо терапевтического действия все противоопухолевые антрациклиновые антибиотики вызывают ряд побочных эффектов, обусловленных низкой избирательностью действия. Главным из этих эффектов является потенциально необратимая кумулятивная дозозависимая кардиотоксичность, которая предположительно обусловлена свободнорадикальным повреждением клеточных мембран миокарда. Антрациклиновые антибиотики обладают также эмбриотоксическими, мутагенными и тератогенными свойствами. Применение их в комбинации с другими противоопухолевыми средствами позволяет уменьшить дозы и снизить частоту и выраженность токсических эффектов. Блеомицин представляет собой смесь различных гликопептидов, продуцируемых Streptomyces verticillus. Он также подавляет синтез нуклеиновых кислот (главным образом ДНК) и белка, индуцируя фрагментацию ДНК с последующим образованием свободных радикалов. Более активен на ранних стадиях опухолевого процесса, относительно мало угнетает костномозговое кроветворение, не оказывает существенного иммуносупрессивного действия. Применяют блеомицин главным образом при комбинированном лечении тестикулярных видов рака, карцином и лимфом. Так же как и другие противоопухолевые антибиотики, блеомицин вызывает ряд побочных эффектов, наиболее тяжелыми из которых являются анафилактический шок, респираторная токсичность и лихорадка. Дактиномин, как и антрациклиновые антибиотики, встраивается между парами азотистых оснований, образуя стойкий комплекс с ДНК, и нарушает ДНК-зависимый синтез РНК. Применяют его в сочетании с хирургическим вмешательством, лучевой терапией и/или в комбинации с винкристином, циклофосфамидом и метотрексатом при лечении опухоли Вильмса, рабдомиосаркомы, хориокарцином и некоторых других видов опухолей. Основной дозозависимый токсический эффект дактиномицина - угнетение функции костного мозга, вплоть до развития апластической анемии. Митомицин, в отличие от других противоопухолевых антибиотиков, проявляет свойства алкилирующего агента, вызывая избирательное ингибирование синтеза ДНК, а в высоких концентрациях и супрессию клеточной РНК и синтеза белка. Применяют его в качестве вспомогательного средства при лучевой терапии и в комбинации с другими противоопухолевыми средствами (в т.ч. и противоопухолевыми антибиотиками) при лечении диссеминированных аденокарцином различной локализации, хронического лимфо- и миелолейкоза. Основным побочным эффектом митомицина является тяжелая миелосупрессия с относительно поздним токсическим действием на все три ростковых элемента костного мозга. 17. Общие представления о механизмах устойчивости клеток к антибиотикам. Рациональная антибиотикотерапия.    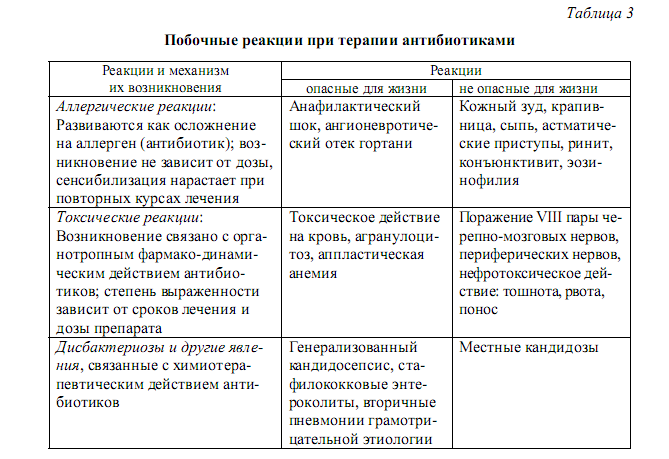 18. Классификация β – лактамных антибиотиков и механизм действия на бактерии Антибиотики β-лактамные являются, пожалуй, самыми широко распространенными в лечебной практике. Они используются для лечения ряда заболеваний и активны в отношении многих возбудителей, так как обладают широким спектром антимикробного действия, высокой активностью, стабильностью и эффективностью. Продуцентами β-лактамных антибиотиков являются грибы Penicillium chrysogenum (пенициллины) и Cephalosporium acremоnium (цефалоспорины). Общим свойством антибиотиков данной группы является наличие в молекуле β-лактамного кольца, а в биологическом смысле – механизм антимикробного действия. В лечебной практике используется около 50 различных препаратов группы пенициллинов. Современная их классификация является комплексной, учитывает как химические особенности, так и спектр действия и выглядит следующим образом: 1. Природные пенициллины (бензилпенициллин, бициллин и др.). 2. Полусинтетические пенициллины: а) активные в отношении преимущественно грамположительных бактерий, устойчивые к пенициллиназе (оксациллин); б) широкого спектра действия (ампициллин, карбенициллин и их производные); в) антипсевдомонадные (азлоциллин, мезлоциллин); г) активные в отношении преимущественно грамотрицательных бактерий. 3. Структурно близкие к пенициллинам соединения: а) ингибиторы β-лактамаз; б) карбапенемы (имипенем, тиенам); в) монобактамы (азтреонам). Препараты группы цефалоспоринов, обнаруженные в 1945 году(в настоящее время используется в клинике около 30), классифицируются с учетом последовательности их внедрения в практику, спектра действия и делятся на поколения: I – антибиотики с антистафилококковой, антистрептококковой и ан-тигонококковой активностью (цефалоридин, кефзол, цефалексин); II – обладающие дополнительной активностью в отношении эшерихий, клебсиелл, протеев (клафоран); III – проявляющие активность в отношении большого числа гра-мотрицательных бактерий, в том числе и P. aeruginosa (цефокситин, цефобид); IV – проявляющие активность в отношении грамположительных кокков, а также многих штаммов кишечных бактерий и псевдомонад (цефпиром, цефипим). Все β-лактамные антибиотики являются бактерицидными. Между собой они различаются по способности всасываться, используемым дозам, фармакокинетическим показателям, способам применения и т. д. Еще в 1960-х годах (на модельной системе Staphylococcus aureus) было показано, что мишенью действия пенициллина являются ферменты, обеспечивающие образование клеточной стенки бактерий. Единственной приемлемой стала гипотеза о сходстве между молекулой фермента транс- пептидазы и молекулой пенициллина. Вероятно, пенициллин связывается с активным центром фермента транспептидазы, ацилирует его и блокиру- ет доступ для субстрата. Высвобождение молекулы пенициллина из ком- плекса происходит крайне медленно, в то время как природный субстрат (пентапептид) высвобождается быстро. Установлено сходство между про- странственной ориентацией атомов и полярных групп пенициллинового ядра и одной из конформаций остатков D-аланина-D-аланина, причем та- кое сходство устанавливается при взаимодействии с ферментом. β-Лактамные антибиотики действуют и на карбоксипептидазы, удаляющие сво- бодные остатки D-аланина, однако такое действие не является для клетки летальным. Рассматривая действие β-лактамных антибиотиков на клеточную стенку, а также анализируя возможные механизмы устойчивости к ним, следует отметить и роль так называемых пенициллинсвязывающих белков (ПСБ, PBP”s). Открыты эти белки были собственно по способности свя- зываться с меченым пенициллином, а также конъюгатами пенициллина и сывороточных белков. ПСБ локализованы в цитоплазматической мембране, по своей активности относятся к ферментам классов транспептидаз и D-аланин-карбоксипептидаз. Основная их роль – участие в процессах синтеза клеточной стенки, формообразовательных процессах в клетке и ее физиологическом цикле. Разные типы ферментов включены в увеличение длины, приобретение формы, образование перегородки клетки. Считается, что типов ПСБ меньше у кокков, нежели у палочек: у E. coli – 9, S. aureus – 2–4, B. subtilis – 7–8. Количество молекул на клетку составляет у E. coli – 2000–3000 или примерно 1 % от всех мембранных белков. ПСБ доступны для антибиотика, так как они располагаются частично в мембране, частично – в периплазме грамотрицательных бактерий или на границе мембрана – среда. Сигнальной частью пептид заякорен в мембране (у ПСБ-1 E. coli – это остатки с 64 по 87), с 88 по 844 находятся в периплазме. Такое расположение связывают с тем, что активный центр транспептидаз захватывает структурные единицы пептидогликана и включает их в полимер. Степень необходимости тех или иных ПСБ для клеток различается, что означает наличие существенных и менее существенных. Например, у S. aureus из четырех ПСБ существенными являются только второй и третий, дефекты в белках 1 и 4 не являются летальными для клетки. У S. faecalis – шесть ПСБ, однако существенными являются только три из них. Важно отметить, что при действии пенициллинов и разрушении существенных белков несущественные могут выполнять функции последних. Наиболее полно изученными являются ПСБ у E. coli. Белки ПСБ 1А и ПСБ 1В рассматривались ранее как один белок, однако в последние годы показано, что они кодируются отдельными генами, локализованными на 3-й и 73-й минутах карты. Неодинаковы и условия их функционирования: потребность в катионах (Mg2+), сродство к отдельным лактамным антибиотикам. Их основная роль – элонгация пептидогликана, и обладают они бифункциональной активностью (наращивание полисахаридной цепи и замыкание мостиков пептидов), хотя трансгликозидазная функция и не чувствительна к действию пенициллинов. 19. Исторический очерк развития исследований об антимикробных средствах. Не многие события в истории медицины оказали такое влияние на жизнь человека и общества, как открытие возможности контролировать инфекции, вызываемые микроорганизмами. Однако следует указать, что некоторые дезинфицирующие вещества применялись задолго до выявления механизмов их действия. Первым термином, характеризующим такие соединения, был, вероятно, «антисептик», введенный Дж. Принглем в 1750 году для обозначения веществ, предотвращающих гниение. Однако широкое распространение антисептиков началось лишь в XIX веке (водный раствор хлорида и гипохлорида натрия стал использоваться в 1825 году, а настойка иода – в 1839 году). Практическому внедрению антисептиков в значительной степени способствовала настойчивость английского хирурга Дж. Листера, который первым стал использовать 2,5 % раствор фенола для обработки рук хирурга, а 5 % − для стерилизации хирургических инструментов и помещений. Однако даже в этом случае можно говорить лишь об эмпирическом использовании антисептических средств, без знания механизмов их действия, в силу чего этот период получил название эмпирической химиотерапии. Работы Л. Пастера о микробной природе брожения, а также Р. Коха, который усовершенствовал методы выделения чистых культур, выращивания бактерий на плотных средах и предложил способы проведения исследований в стерильных условиях, обеспечили возможность изучения действия на микроорганизмы антисептиков и дезинфицирующих веществ. Наиболее важный вывод из экспериментальных данных этого периода – необходимость создания условий, в которых будет невозможно заражение. Основополагающими работами, которые использовали научный подход к проблеме химиотерапии инфекционных заболеваний, стали исследования П. Эрлиха, опубликованные в 1897 году, а в период с 1902 по 1912 год им были сформулированы почти все концепции, которые легли в основу последующего изучения антимикробных агентов. Его первые идеи возникли при работе с прижизненными красителями, избирательно поглощаемыми живыми клетками. Основываясь на работах Р. Коха о лечебном действии оксида мышьяка при терапии трипаносомоза, П. Эрлих синтезировал другие родственные соединения и исследовал их активность. В 1910 году им был создан лекарственный препарат сальварсан, получивший широкое применение в лечении сифилиса. П. Эрлихом был предложен и сам термин «химиотерапия» для обозначения химических соединений, с помощью которых можно бороться с инфекционными болезнями. Впоследствии были сформулированы основные принципы этого научного направления. Во-первых, было постулировано, что лекарственные препараты должны связываться с определенными рецепторами, имеющимися на поверхности клеток. Данное положение нашло свое отражение в современных представлениях о механизмах транспорта лекарств через клеточные мембраны. Во-вторых, было постулировано, что химиотерапевтическое соединение должно обладать двумя функциональными особенностями: иметь участок связывания, или «гаптофор», обеспечивающий взаимодействие с рецепторами клеток; и «токсофор» − токсичную группировку, обусловливающую воздействие на клетку. В-третьих, П. Эрлих установил важность количественных измерений соотношения между дозой соединения, достаточной для лечебного эффекта и оказывающей токсическое действие. Им были введены такие понятия, как максимально переносимая доза (ДТ), минимальная лечебная доза (ДС), а их соотношение (ДТ/ДС) получило название химиотерапевтического индекса. Малотоксичные и нетоксичные препараты имеют индекс больше 1; если эта величина равна или меньше 1, то препарат является токсичным или высокотоксичным. П. Эрлих предложил и стратегию поиска новых лекарственных препаратов. Один из подходов – проведение испытания большого числа различных химических соединений в относительно простом биологическом тесте для установления связи биологической активности с тем или иным типом химической структуры. Второй метод, предложенный ученым, заключался в направленном синтезе химических соединений, обладающих нужной антимикробной активностью. Любое улучшение антимикробных свойств (расширение спектра действия, снижение токсичности и др.) может быть использовано для получения наилучшей из возможных химических структур. П. Эрлих также считал, что соединения, действующие на возбудителей инфекции, не обязательно должны вызывать гибель последних. Вполне достаточным может быть предотвращение его размножения, а в дальнейшем природные защитные механизмы организма-хозяина (клеточные и гуморальные факторы иммунитета) справятся с чужеродными организмами. П. Эрлих обратил внимание и на проблему устойчивости микроорганизмов к химиотерапевтическим соединениям. На основании различной чувствительности трипаносом к гистологическим красителям был сделан вывод о наличии у клеток различных рецепторов для взаимодействия с ними. В случае устойчивости и меньшего накопления красителя внутри клеток происходит снижение сродства между рецепторами и красителем. Важность научных выводов П. Эрлиха и сформулированных им основных положений теории химиотерапии позволяет назвать данный этап периодом научной химиотерапии. В 1935 году появилось сообщение Г. Домагка об эффективности пронтозила красного (красный стрептоцид) при терапии бактериальных инфекций, вызванных грамположительными кокками. Оказалось, что в организме данное соединение распадается с образованием сульфаниламида, который и является эффективным антибактериальным агентом. В дальнейшем были синтезированы другие производные сульфаниламидов (этазол, фталазол), которые успешно используются до настоящего времени. Однако и сейчас достигнуто относительно мало в создании и использовании синтетических препаратов для терапии инфекционных заболеваний: синтетическими, например, являются производные 8-оксихинолина, нитрофурановые соединения и некоторые другие. Этот период развития иссследований, посвященный обнаружению синтетических антимикробных препаратов, получил название сульфаниламидотерапии и продолжался примерно до 1940 года, когда был получен в кристаллическом виде первый антибиотик – пенициллин. История открытия антибактериальных свойств пенициллина является увлекательной сама по себе и стала классическим примером для молодых исследователей. В 1929 году А. Флеминг обнаружил факт задержки роста стафилококков в присутствии плесени Penicillium notatum, и вещество, которое вызывало такой эффект, было названо пенициллином. Однако только в 1939−1940 годах Г. Флори и Э. Чейну удалось получить это вещество в неочищенном кристаллическом, но высокоактивном виде и продемонстрировать его активность in vitro. Данные исследования следует рассматривать как величайшие в медицине и биологии. Именно они послужили основой для возникновения такой отрасли знания, как учение об антибиотиках, заложили основы создания медицинской промышленности и промышленного получения антибиотиков. Многие исследователи занимались проблемой поиска новых антибиотических препаратов. Следует отметить работы С. Ваксмана, которые привели к обнаружению и выделению стрептомицина. К 1940 году были известны пять антибиотиков: микофеноловая кислота (1896 год, Б. Го-зио), пиоционаза (1899 год, Р. Эммерих и О. Лоу), актиномицетин (1937 год, М. Вельш), мицетин (1939 год, А. Красильников) и тиротрицин (1939 год, Р. Дюбо). Этот этап развития учения об антибиотиках получил название периода антибиотикотерапии. 20. Общая характеристика антибиотиков – ингибиторов биосинтеза белка Антибиотики, относящиеся к данной группе, весьма многочисленны и подавляют синтез белка за счет различных механизмов и на различных уровнях. Условно их можно разделить на четыре группы: 1. Ингибиторы активации аминокислот и реакций переноса. 2. Ингибиторы функций малых субъединиц (30S) рибосомы. 3. Ингибиторы функций больших субъединиц (50S) рибосомы. 4. Ингибиторы внерибосомных функций. Особенностями действия антибиотиков данной группы являются следующие: 1) временная остановка биосинтеза белка сама по себе не является летальной для клетки, поэтому антибиотики – ингибиторы биосинтеза белка обладают бактериостатическим действием, если только не связываются необратимо с какими-либо компонентами системы синтеза; 2) остановка биосинтеза белка имеет различные последствия для клеточного цикла: уже начавшийся цикл репликации ДНК продолжается, но новых циклов не инициируется, синтез РНК также продолжается в течение короткого промежутка времени, скорость синтеза клеточной стенки снижается и в конце концов прекращается; 3) биосинтез белка у про- и эукариот различается, поэтому может подавляться разными антибиотиками. В качестве представителей антибиотиков первой группы можно рас-сматривать природные и синтетические аналоги аминокислот, подав-ляющие образование комплексов « ацилированная аминокислота – тРНК». Связываясь с тРНК, они могут включаться в полипептид, что приводит к образованию аномальных белков. К числу аналогов аминокислот можно отнести этионин, норлейцин, этилглицин, дигидропролин. Природными соединениями являются боррелидин и индолмицин, которые конкурентно подавляют связывание с аминоацил-тРНК треонина и триптофана соответственно. За исключением индолмицина, который яв-ляется специфическим ингибитором прокариотической тРНК-синтетазы триптофана, остальные соединения действуют неспецифически и поэтому не нашли использования в клинике. На стадии взаимодействия с пептидил-тРНК действует пуромицин. Это уникальный ингибитор белкового синтеза, так как он вступает в реакцию образования пептидной связи с С-концевым аминокислотным остатком растущей полипептидной цепи на рибосоме, что приводит к преждевременной терминации образования полипептида. Отмечено структурное сходство пуромицина и концевого аминоациладенозина в тРНК. Аминоациладенозин является концевым участком в тРНК как про-, так и эукариотических клеток, и действие пуромицина распростра-няется на клетки этих типов. Структурное сходство пуромицина и ами-ноациладенозина приводит к тому, что аминогруппа антибиотика образует пептидную связь с ацильной группой концевого аминоациладенозина пептидил-тРНК, связанной с рибосомой. Образование стабильного комплекса приводит к завершению образования пептидных связей и вы-свобождению пептидилпуромицина из рибосомы. 21. Принципы классификации антибиотиков Классификации антибиотиков различаются в зависимости от того,какие цели преследуют при этом исследователи различных профилей. Так, например, для биолога интерес представляет классификация поштаммам-продуцентам, для врача – по спектру действия на различныхвозбудителей и т. д. В зависимости от продуцирующих организмов антибиотикимогут быть разделены на следующие группы: 1. Образуемые эубактериями: • бактериями рода Bacillus: грамицидины, полимиксины и др.; • бактериями рода Pseudomonas: мупироцин, пиоцианин, антифунгин и др.; • бактериями других родов (Micrococcus, Streptococcus, Escherichia,Proteus): низин, колиформин и др. 2. Образуемые бактериями рода Streptomyces: стрептомицин, тетрациклин, новобиоцин и др. 3. Образуемые несовершенными грибами: пенициллин, гризеофульвин и др. 4. Образуемые грибами классов базидио- и аскомицетов: термофиллин, лензитин, хетомин и др. 5. Образуемые лишайниками, водорослями, низшими растениями:усниновая кислота и др. 6. Образуемые высшими растениями: аллицин, рафанин и др. 7. Образующиеся в организмах животных: лизоцим, интерферон,круцин и др. По механизму биологического действия антибиотики могут быть классифицированы следующим образом: 1. Нарушающие синтез клеточной стенки бактерий: бацитрацин,фосфомицин, циклосерин и др.; 2. Нарушающие функции мембран: альбомицин, грамицидин и др.; 3. Подавляющие синтез нуклеиновых кислот: • ингибиторы синтеза пуринов и пиримидинов; • синтеза ДНК; • синтеза РНК. 4. Подавляющие синтез белков: хлорамфеникол, аминогликозиды,тетрациклины; 5. Ингибирующие процессы клеточного дыхания: пиоцианин, усни- новая кислота, антимицины. 6. Антиметаболического действия: боррелидин, пуромицин; 7. С иммунокорректирующей активностью: циклоспорин. По спектру действия антибиотики делятся на такие группы: 1. Противобактериальные узкого спектра действия, активные в отношении грамположительных бактерий: природные пенициллины, некоторые макролидные антибиотики. 2. Противобактериальные широкого спектра действия: тетрациклины, хлорамфеникол, аминогликозиды. 3. Противотуберкулезные: рифампицин. 4. Противогрибковые: нистатин, леворин. 5. Противоопухолевые: актиномицины, блеомицины. 6. Антипротозойные: фумагиллин. При классификации антибиотиков по химической структуре учитывают, что природные и полусинтетические соединения, имеющие общую структуру, составляют один класс, название которого присваиваетсяпо первому выделенному представителю или по названию антибиотика, имеющего наиболее характерные свойства и структуру. При наименовании антибиотиков используются и другие подходы. Если структура вещества неизвестна, то название следует давать по наименованию рода или порядка, к которому относится продуцент, при этом суффикс «-мицин» присваивается только антибиотикам, продуцируемым актиномицетам. Если название было использовано ранее, то допускается применение эпитетак видовому названию продуцента. В названии антибиотика можно использовать спектр или способ его антимикробного действия. Необходимо также, чтобы название антибиотика было благозвучным. Выделяют следующие химические группы соединений: 1. β-лактамные антибиотики, имеющие в структуре четырехчленное лактамное кольцо и подразделяющиеся на пенициллины и цефалоспорины. 2. Аминогликозидные антибиотики (стрептомицин, канамицин, гентамицин и др.), имеющие в структуре циклический аминоспирт, к которым через гликозидные связи присоединяются один или несколько сахаров или аминосахаров. 3. Тетрациклины, имеющие четыре конденсированных кольца. 4. Макролидные антибиотики, имеющие макроциклическое лактонное кольцо, с которым соединяются несколько аминосахаров или сахаров (эритромицин, олеандомицин). В этот класс входят также и полиеновые |
